电解池的工作原理
图片预览





文档简介
(共19张PPT)
电解池的工作原理
高二化学备课组
电解池(电解槽):把电能转化为化学能的装置。
电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程叫做电解。
电解熔融氯化钠(见课本P17原理图)
通电前, Na+ Cl- 在 __________运动。
通电后, Na+向__ 极(与电源____相连)移动,Cl-向___极(与电源____相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。
阴
无规则自由
负极
阳
正极
电解池阴
2NaCl 2Na +Cl2↑
氧化
还原
电源正
2Na++ 2e- == 2Na
2Cl --2e-==Cl2↑
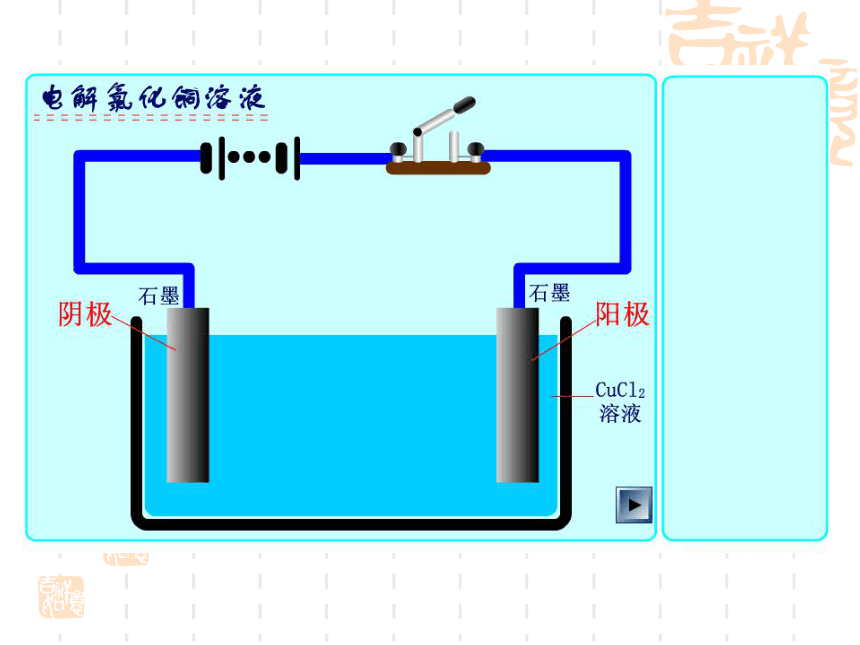
下面以石墨为电极电解氯化铜溶液为例来分析。
这是电解熔融盐的情况。
电解电解质溶液又会发生什么反应呢?
以石墨为电极电解饱和食盐水
阳极:
2Cl - - 2e- == Cl2↑
阴极:
2H+ + 2e- == H2 ↑
2NaCl+2H2O 2NaOH +Cl2↑+H2 ↑
已知其电解反应为:
⑴请根据方程式分析哪些离子在电极上发生反应。
⑵在工业生产中,用阳离子交换膜将阴极区与阳极区隔开,使阴极区的OH-不能进入阳极区,为什么要这么做?
Cl –在阳极失电子生成Cl2, OH-进入阳极区会与Cl2反应,既减少Cl2的产量,又会生成NaClO,使产品不纯且干扰电解。
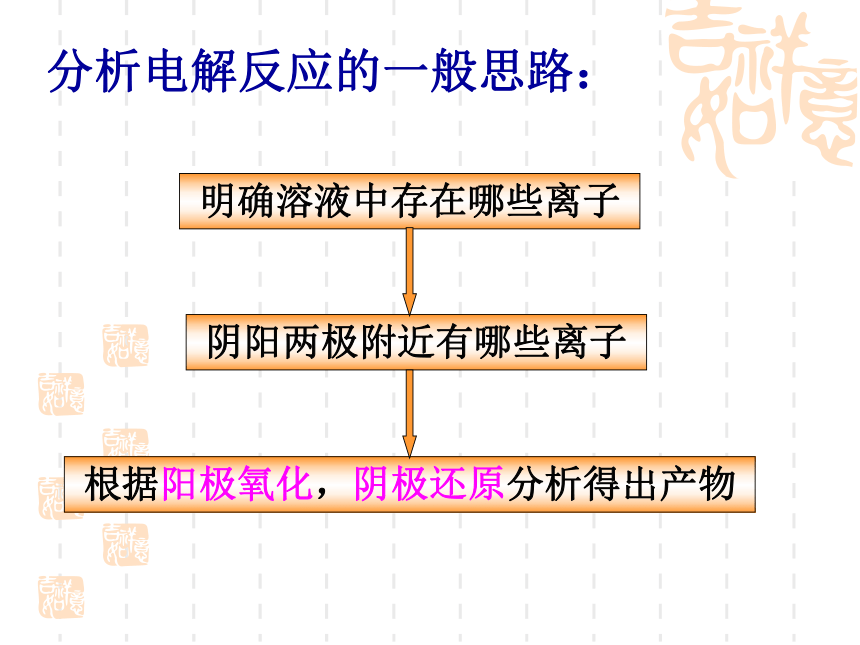
分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化,阴极还原分析得出产物
阴阳两极附近有哪些离子
为何当一个电极存在多种可能的放电离子时,不是大家共同放电,而是只有一种离子放电?放电能力与什么因素有关?
思考:
(物质在电解池的阴、阳两极发生反应的过程叫放电。)
阴极: ___电子,发生____反应,离子 _____越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
得
还原
氧化性
失
氧化
还原性
想一想:
若以铜为阳极,铁为阴极,电解
氯化铜溶液,情况又如何?
电解池
能量转换
离子的迁移方向
发生氧化反应的电极
发生还原反应的电极
电能转化为化学能
阳极(接电源正极)
阴极(接电源负极)
阴离子向阳极迁移
阳离子向阴极迁移
原电池
化学能转化为电能
负极
正极
阴离子向负极迁移
阳离子向正极迁移
相同点
(从原理分析)
都是氧化还原反应
练习:完成下列溶液的电极反应。
(以石墨为电极电解)
硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
再 见!
阴极: 得电子,发生还原反应,离子氧化性越强,反应越容易。
常见阳离子放电顺序:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+> Al3+>Mg2+>Na+
阳极:失电子,发生氧化反应,离子还原性越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:4H+ + 4e- = 2H2↑
总反应:
2H2O 2H2↑ + O2↑
阳极:
2Cl - - 2e- == Cl2↑
阴极:
2H+ + 2e- == H2 ↑
2HCl H2 ↑+ Cl2↑
总反应:
阳极:Cu – 2e- = Cu 2+
阴极:Cu 2+ + 2e- = Cu
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:2Cu 2+ + 4e- = 2Cu
总反应:
2CuSO4 + 2H2O
2Cu + 2H2SO4 + O2↑
电解池的工作原理
高二化学备课组
电解池(电解槽):把电能转化为化学能的装置。
电解:在直流电的作用下,在两电极上分别发生氧化反应和还原反应的过程叫做电解。
电解熔融氯化钠(见课本P17原理图)
通电前, Na+ Cl- 在 __________运动。
通电后, Na+向__ 极(与电源____相连)移动,Cl-向___极(与电源____相连)移动。
电子从电源负极流向_________极,电极反应为__________,发生_______反应。
电子从电解池阳极流向_______极,电极反应为__________,发生_______反应。
总反应为_______________________。
阴
无规则自由
负极
阳
正极
电解池阴
2NaCl 2Na +Cl2↑
氧化
还原
电源正
2Na++ 2e- == 2Na
2Cl --2e-==Cl2↑
下面以石墨为电极电解氯化铜溶液为例来分析。
这是电解熔融盐的情况。
电解电解质溶液又会发生什么反应呢?
以石墨为电极电解饱和食盐水
阳极:
2Cl - - 2e- == Cl2↑
阴极:
2H+ + 2e- == H2 ↑
2NaCl+2H2O 2NaOH +Cl2↑+H2 ↑
已知其电解反应为:
⑴请根据方程式分析哪些离子在电极上发生反应。
⑵在工业生产中,用阳离子交换膜将阴极区与阳极区隔开,使阴极区的OH-不能进入阳极区,为什么要这么做?
Cl –在阳极失电子生成Cl2, OH-进入阳极区会与Cl2反应,既减少Cl2的产量,又会生成NaClO,使产品不纯且干扰电解。
分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化,阴极还原分析得出产物
阴阳两极附近有哪些离子
为何当一个电极存在多种可能的放电离子时,不是大家共同放电,而是只有一种离子放电?放电能力与什么因素有关?
思考:
(物质在电解池的阴、阳两极发生反应的过程叫放电。)
阴极: ___电子,发生____反应,离子 _____越强,反应越容易。
常见阳离子放电顺序:
Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
阳极:___电子,发生____反应,离子 _____越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
得
还原
氧化性
失
氧化
还原性
想一想:
若以铜为阳极,铁为阴极,电解
氯化铜溶液,情况又如何?
电解池
能量转换
离子的迁移方向
发生氧化反应的电极
发生还原反应的电极
电能转化为化学能
阳极(接电源正极)
阴极(接电源负极)
阴离子向阳极迁移
阳离子向阴极迁移
原电池
化学能转化为电能
负极
正极
阴离子向负极迁移
阳离子向正极迁移
相同点
(从原理分析)
都是氧化还原反应
练习:完成下列溶液的电极反应。
(以石墨为电极电解)
硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
再 见!
阴极: 得电子,发生还原反应,离子氧化性越强,反应越容易。
常见阳离子放电顺序:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+> Al3+>Mg2+>Na+
阳极:失电子,发生氧化反应,离子还原性越强,反应越容易。
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:4H+ + 4e- = 2H2↑
总反应:
2H2O 2H2↑ + O2↑
阳极:
2Cl - - 2e- == Cl2↑
阴极:
2H+ + 2e- == H2 ↑
2HCl H2 ↑+ Cl2↑
总反应:
阳极:Cu – 2e- = Cu 2+
阴极:Cu 2+ + 2e- = Cu
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:2Cu 2+ + 4e- = 2Cu
总反应:
2CuSO4 + 2H2O
2Cu + 2H2SO4 + O2↑
