上海市青浦高级中学11-12学年高一下学期期中考试化学试题
文档属性
| 名称 | 上海市青浦高级中学11-12学年高一下学期期中考试化学试题 |

|
|
| 格式 | zip | ||
| 文件大小 | 126.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-25 00:00:00 | ||
图片预览



文档简介
青浦高级中学2011学年第二学期期中考试
高一化学试题
命题人:钱澄 审题:命题研讨小组
试卷说明:
本试卷考试时间为90分钟,满分为100分
可能用到的相对原子质量:
O-16 Fe-56 S-32 H-1 N-14 Cu-64 Na-23
一、选择题(每小题只有一个正确选项)
1.右图是一个一次性加热杯的示意图,当水袋破裂时,水与固体碎块混和,可安全加热杯
内食物,加热杯中可选用的固体碎块是 ( )
A.硝酸铵 B.生石灰 C.氯化钠 D.胆矾
2.下列说法正确的是 ( )
A.冷却饱和溶液有晶体析出后的溶液,不一定是饱和溶液
B.从溶液中结晶析出的晶体都含有结晶水
C.晶体失去结晶水,一定是风化的结果
D.无水氯化钙吸水后表面形成溶液是发生了潮解
3.下列属于吸热反应的是 ( )
A.碳酸钙受热分解 B. 硫酸和NaOH溶液反应
C.锌粒与稀H2SO4反应制取H2 D. 铁粉与硫粉混合后加热生成FeS
4. 已知:H2(g)+1/2O2(g)→H2O(g)+241.8KJ H2(g)+S(g)→H2S(g)+20.1KJ
则H2O和H2S的热稳定性比较正确的是 ( )
A. H2O稳定 B. H2S稳定 C.一样稳定 D.无法比较
5. 已知:H2(g)+F2(g)→2HF(g)+270KJ,下列说法正确的是 ( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出
热量大于270KJ
D.该反应过程的能量变化可用右图来表示
6.化学与能源开发、环境保护、资源利用等密切相关。
下列说法错误的是( )
A.为提高农作物的产量和质量,应适量合理使用化肥和农药
B.使燃料充分利用,通常需要考虑两点:一是燃料的充分燃烧;二是热能的充分利用
C.实现化石燃料清洁利用,同时需要开发新能源
D.绿色化学的核心是应用化学原理对环境污染进行治理
7.铜锌原电池是最早被研究的电池。关于该电池的说法中正确的是 ( )
A.铜片是负极
B.锌变成了锌离子
C.电子从铜片经导线流向锌片
D.铜片表面没有气泡
8.下列物质可以由单质直接化合得到的是 ( )
A.CuS B.NO2 C.FeCl3 D.SO3
9.下列实验中没有硫生成的是 ( )
A.H2S气体受热分解 B.氢硫酸中滴入少量氯水?
C.SO2气体中通入H2S气体 D.在足量氧气里充分燃烧H2S气体
10.NA为阿伏加德罗常数,下列叙述正确的是 ( )
A. 在铜与硫的反应中,1mol铜完全反应失去的电子数为2 NA
B. 1L1mol/L盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,2.24L三氧化硫所含分子数为0.1 NA
D.常温常压下,0.2mol NH3中含N—H键数目为0.6 NA
11. 鉴别SO2和CO2,可将它们分别通过下列溶液,其中不可行是 ( )
A.盛有酸性高锰酸钾溶液的洗气瓶 B.盛有澄清石灰水的洗气瓶
C.盛有溴水的洗气瓶. D.盛有品红溶液的洗气瓶
12.下列有关说法中错误的是 ( )
A. 硫化氢的水溶液叫氢硫酸,易被氧化
B. SO2是一种有刺激性气味的有毒气体,易溶于水,是亚硫酸的酸酐
C. pH在5.6~7.0之间的降水通常称为酸雨
D. 推广使用低硫煤,并向煤中加生石灰的方法,可减少SO2的排放
13.在下图的实验装置中,从实验开始后过一段时间,对看到的现象叙述错误的( )
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出
D.蓝色石蕊试纸变红
14.下列关于浓硫酸的说法错误的是( )
A.浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不显示酸性的性质
B.实验室用浓硫酸来制取氯化氢显示了浓硫酸的难挥发性或高沸点
C.在一定体积18mol/L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,
则硫酸的实际体积为100mL
D.常温下,冷的浓硫酸可以用铁或铝的容器贮存,是因为铁或铝发生了“钝化”
15.下列用途中所选用的物质正确的是( )
A.X射线透视肠胃的内服剂——碳酸钡
B.生活用水的消毒剂——明矾
C工业生产氯气的原料——浓盐酸和二氧化锰
D.配制波尔多液原料——胆矾和石灰乳
16.下列检验方法错误的是 ( )
A.加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I-
B.加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42-
C.加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中
肯定存在NH4+
D.某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO
17.下列有关说法错误的是( )
A. 晶体中一定存在化学键 B.金刚石是自然界最硬的物质
C. SO2可用作食品防腐剂 D.NO可用于某些疾病的治疗
18.室温时,在体积相同的容器里混合下列气体,混合后压强最大的是 ( )
A. 100mL NO与50mLO2 B. 100mLH2S与50mL SO2
C. 37.5mLN2与112.5mLH2 D. 100mL HCl与50mLNH3
19.右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。
挤压胶管的胶头,下列与试验事实不相符的是( )
A.CO2 (饱和NaHCO3溶液) 无色喷泉
B.NH3(H2O含酚酞) 红色喷泉
C.H2S(CuSO4溶液) 黑色喷泉
D.HCl (AgNO3溶液) 白色喷泉
20.在实验室里按图所示的装置来干燥、收集气体R,
多余的气体R可用水吸收,则R是( )
A.H2S B.HCl C.NH3 D.SO2
21.在一定条件下,将12mLNO和NO2的混合气的试管倒立于盛满水的水槽中,充分反应
后,容器内残留6mL的气体,则原混合气中NO的体积为 ( )
A.3mL B.6mL C.9 mL D.12 mL
22.把L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用mol烧碱刚好把NH3全部赶
出,另一份与氯化钡溶液完全反应消耗molBaCl2,则原溶液中(NO)为( )
A.mol/L B.mol/L
C.mol/L D.mol/L
23.把一定量的铁和硫化亚铁的混合物与100 mL 2 mol/L的硫酸充分反应后,固体完全
溶解,同时生成气体Y 3.36L(在标准状况下)。将反应后的溶液稀释到1 L,
测得溶液中C(H+)=0.1mol/L,则下列叙述一定正确的是( )
A.气体Y是H2 B. 反应中转移电子小于0.3 mol
C.反应中共消耗混合物10g D. 气体Y中H2和H2S的体积比为1:2
二、填空题
24.(1) 单质硫既能被氧化,又能被还原,请你写出一个化学方程式来体现硫的还原性:
__________________________________________________________________
黑火药爆炸时,发生的反应之一为:S+2KNO3+3CK2S+3CO2↑+N2↑
该反应中 1molS能氧化C______mol
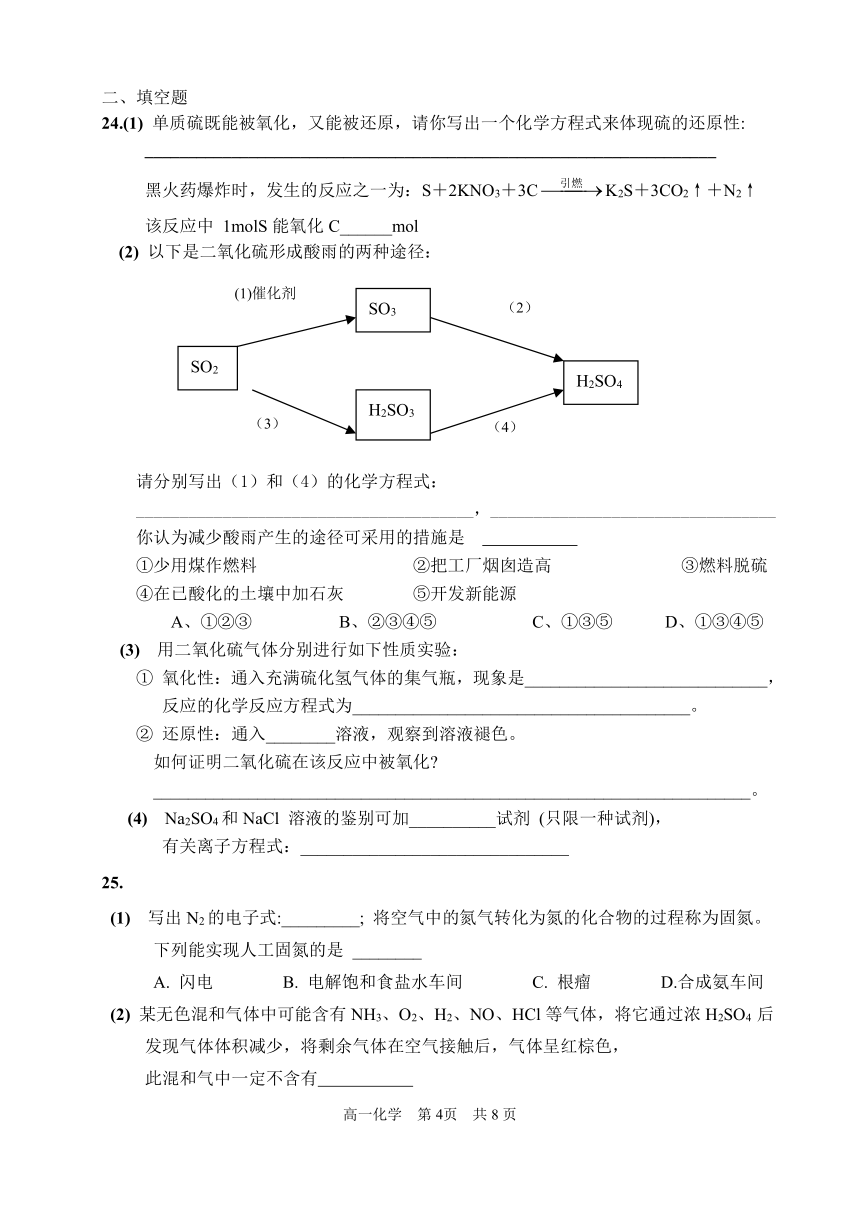
(2) 以下是二氧化硫形成酸雨的两种途径:
请分别写出(1)和(4)的化学方程式:
_______________________________________,_________________________________
你认为减少酸雨产生的途径可采用的措施是
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A、①②③ B、②③④⑤ C、①③⑤ D、①③④⑤
(3) 用二氧化硫气体分别进行如下性质实验:
① 氧化性:通入充满硫化氢气体的集气瓶,现象是____________________________,
反应的化学反应方程式为_______________________________________。
② 还原性:通入________溶液,观察到溶液褪色。
如何证明二氧化硫在该反应中被氧化
_____________________________________________________________________。
(4) Na2SO4和NaCl 溶液的鉴别可加__________试剂 (只限一种试剂),
有关离子方程式:_______________________________
25.
(1) 写出N2的电子式:_________; 将空气中的氮气转化为氮的化合物的过程称为固氮。
下列能实现人工固氮的是 ________
A. 闪电 B. 电解饱和食盐水车间 C. 根瘤 D.合成氨车间
(2) 某无色混和气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后
发现气体体积减少,将剩余气体在空气接触后,气体呈红棕色,
此混和气中一定不含有
(3) 在实验室有几种方法可制取氨气:
通常用加热消石灰与硫酸铵固体的方法来制取氨气。
①写出此反应的化学方程式________________________________________________ ,
下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ________
A B C D
②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
______________________________________________________________________
③用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶
内,锥形瓶中不可能生成的物质是:
A H2 B NO2 C HNO3 D NH4NO3
写出乙装置中氨催化氧化的化学方程式:
(4) 如果在实验室里检验某白色固体是铵盐,提供下列试剂给你选择,
其中不应选择的试剂是____________
A蒸馏水 B氢氧化钠溶液 C浓盐酸 D稀硫酸
(5) 已知:3Cl2+2NH3 AUTOTEXT => \* MERGEFORMAT →N2+6HCl, 常温常压下,在一密闭容器中将15ml Cl2和40ml NH3
充分反应后,剩余气体的体积为 mL。
(6) 在标况下,1L水中溶解700LNH3,所得溶液的密度为0.9g/cm3,
则氨水的物质的量浓度为_________mol/L(保留一位小数)
三、实验题
26. 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验:
(1) 通过试管乙中发生的__________________现象说明了铜和浓硫酸发生了化学反应,
并且该现象还能说明产生的气体具有 _______ 性。
(2)写出试管甲所发生的化学反应方程式____________________________________________ .
(3) 试管乙口放置有碱液的棉花的作用是 _______________________________________ ,
(4) 实验中,取一定质量的铜片和浓硫酸放在试管甲中共热,直到反应完毕,最后发现试管甲中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①下列药品中能用来证明反应结束后的试管甲中确有余酸的是____________。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
② 为测定上述反应中铜消耗的质量,还需进行的实验是:取出试管甲内反应后的混合液,
向其中加入足量的 试剂, 然后进行的操作步骤是 。
(选出测定过程中所需的基本操作且按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤
(c) 蒸发、结晶 (d) 冷却、称量 (e) 烘干或灼烧
四、计算题
27. (1)硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~900℃时,
硫铁矿在在沸腾炉中煅烧,发生下列反应: 4FeS2+11O2→2Fe2O3+8SO2
(杂质不与氧气反应)
设120 kg纯净的FeS2与氧气完全反应,产生标准状况下SO2_________m3。
(2) 0.65mol铜与100ml、18mol/L的浓硫酸充分反应后,铜完全溶解,
将所得溶液稀释到10L,在此溶液中滴加5mol/L的氢氧化钠溶液至沉淀质量最大时,
需氢氧化钠溶液________ ml.
(3) 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应。
如图是加入的混合物质的质量和产生的气体体积(标准状况)的关系。
则NaOH的物质的量浓度为_______________ mol/L
(4) 某Na2SO3固体已部分被氧化为Na2SO4,经测定该混合物中含硫的质量分数为25%,
取51.2g该混合物加入某浓度过量的硫酸50mL,加热使气体全部逸出并收集,然后再向
溶液中加入0.5mol/L氢氧化钠溶液50 mL恰好中和余酸。
求硫酸溶液的物质的量浓度(要求解答过程)
青浦高级中学2011学年第二学期期中考试
高一化学答题卷
一、单选题:
1 2 3 4 5 6 7 8 9 10
11 12 13 14 15 16 17 18 19 20
21 22 23
二、填空
24.
(1) ___________________________ _______mol
(2) _____________________________, ______________________________, ________
(3)
①_____________________________________; ________________________________ ② ________, ____________________________________________________________
(4) _________________, _________________________________________________
25.
(1) ____________, _________________ (2) _____________________
(3)
①_________________________________________________________; __________
②_____________________________________________________________________
③ ____________, ___________________________________________________
(4) ______________ (5) ____________ ml (6) __________________mol/L
三、实验题
26. (1)__________________, __________________
(2)________________________________________________________________
(3)________________________________________________________________
(4)
① ________________ ② ____________ _________________________
四、计算题
27. (1) ____________ m3 (2) ____________ ml (3)__________ mol/L
(4)
青浦高级中学2011学年第二学期期中考试
高一化学参考答案
一、单选题:(每小题2分,共46分)
1 2 3 4 5 6 7 8 9 10
B D A A C D B C D D
11 12 13 14 15 16 17 18 19 20
B C D C D B A C A C
21 22 23
A B B
二、填空
24.(共14分)
(1) S + O2 → SO2 (1分) 0.5 mol (2分)
(2) 2SO2+O2 2SO3 2H2SO3 + O2 → 2 H2SO4 C (1+1+1分)
(3)
① 瓶壁有淡黄色粉末和无色的小液滴(2分); SO2 + 2H2S →3 S↓ + 2H2O(1分)
② 溴水(合理即可) 检验溶液中有SO42—离子生成即可证明(1+2分)
(4) BaCl2(合理即可) Ba2++ SO42-→ BaSO4↓(1+1分)
25.(共20分)
(1) (1分) D (1分) (2) O2、HCl (2分)
(3)
①(NH4)2SO4+Ca(OH)2CaSO4+2NH3↑+2H2O(2分) AC(2分)
② NH3+H2O NH3 H2O (1分) NH3 H2O NH+OH-(1分)
③ A (2分) 4NH3+5O24NO+6H2O (2分)
(4) D (2分) (5) 5ml (2分) (6) 18.4mol/L(2分)
三、实验题(共10分)
26. (1)褪色(1分), 漂白性(1分)
(2) Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O(2分)
(3)吸收有毒的尾气,防止污染大气(1分)
(4)
①AD (2分) ② NaOH(合理即可) (1分) bed(2分)
四、计算题(共10分)
(1) 44.8 m3 (2分) (2) 460 ml (2分) (3)5 mol/L(2分)
(4) 7.25mol/L (4分)
水袋
水袋
固体
碎块
食物
SO2
SO3
H2SO3
H2SO4
(1)催化剂
(2)
(3)
(4)
点燃
催
△
△
1
高一化学 第1页 共8页
高一化学试题
命题人:钱澄 审题:命题研讨小组
试卷说明:
本试卷考试时间为90分钟,满分为100分
可能用到的相对原子质量:
O-16 Fe-56 S-32 H-1 N-14 Cu-64 Na-23
一、选择题(每小题只有一个正确选项)
1.右图是一个一次性加热杯的示意图,当水袋破裂时,水与固体碎块混和,可安全加热杯
内食物,加热杯中可选用的固体碎块是 ( )
A.硝酸铵 B.生石灰 C.氯化钠 D.胆矾
2.下列说法正确的是 ( )
A.冷却饱和溶液有晶体析出后的溶液,不一定是饱和溶液
B.从溶液中结晶析出的晶体都含有结晶水
C.晶体失去结晶水,一定是风化的结果
D.无水氯化钙吸水后表面形成溶液是发生了潮解
3.下列属于吸热反应的是 ( )
A.碳酸钙受热分解 B. 硫酸和NaOH溶液反应
C.锌粒与稀H2SO4反应制取H2 D. 铁粉与硫粉混合后加热生成FeS
4. 已知:H2(g)+1/2O2(g)→H2O(g)+241.8KJ H2(g)+S(g)→H2S(g)+20.1KJ
则H2O和H2S的热稳定性比较正确的是 ( )
A. H2O稳定 B. H2S稳定 C.一样稳定 D.无法比较
5. 已知:H2(g)+F2(g)→2HF(g)+270KJ,下列说法正确的是 ( )
A.1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270KJ热量
B.2L氟化氢气体分解成1L氢气与1L氟气吸收270KJ热量
C.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出
热量大于270KJ
D.该反应过程的能量变化可用右图来表示
6.化学与能源开发、环境保护、资源利用等密切相关。
下列说法错误的是( )
A.为提高农作物的产量和质量,应适量合理使用化肥和农药
B.使燃料充分利用,通常需要考虑两点:一是燃料的充分燃烧;二是热能的充分利用
C.实现化石燃料清洁利用,同时需要开发新能源
D.绿色化学的核心是应用化学原理对环境污染进行治理
7.铜锌原电池是最早被研究的电池。关于该电池的说法中正确的是 ( )
A.铜片是负极
B.锌变成了锌离子
C.电子从铜片经导线流向锌片
D.铜片表面没有气泡
8.下列物质可以由单质直接化合得到的是 ( )
A.CuS B.NO2 C.FeCl3 D.SO3
9.下列实验中没有硫生成的是 ( )
A.H2S气体受热分解 B.氢硫酸中滴入少量氯水?
C.SO2气体中通入H2S气体 D.在足量氧气里充分燃烧H2S气体
10.NA为阿伏加德罗常数,下列叙述正确的是 ( )
A. 在铜与硫的反应中,1mol铜完全反应失去的电子数为2 NA
B. 1L1mol/L盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,2.24L三氧化硫所含分子数为0.1 NA
D.常温常压下,0.2mol NH3中含N—H键数目为0.6 NA
11. 鉴别SO2和CO2,可将它们分别通过下列溶液,其中不可行是 ( )
A.盛有酸性高锰酸钾溶液的洗气瓶 B.盛有澄清石灰水的洗气瓶
C.盛有溴水的洗气瓶. D.盛有品红溶液的洗气瓶
12.下列有关说法中错误的是 ( )
A. 硫化氢的水溶液叫氢硫酸,易被氧化
B. SO2是一种有刺激性气味的有毒气体,易溶于水,是亚硫酸的酸酐
C. pH在5.6~7.0之间的降水通常称为酸雨
D. 推广使用低硫煤,并向煤中加生石灰的方法,可减少SO2的排放
13.在下图的实验装置中,从实验开始后过一段时间,对看到的现象叙述错误的( )
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出
D.蓝色石蕊试纸变红
14.下列关于浓硫酸的说法错误的是( )
A.浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不显示酸性的性质
B.实验室用浓硫酸来制取氯化氢显示了浓硫酸的难挥发性或高沸点
C.在一定体积18mol/L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,
则硫酸的实际体积为100mL
D.常温下,冷的浓硫酸可以用铁或铝的容器贮存,是因为铁或铝发生了“钝化”
15.下列用途中所选用的物质正确的是( )
A.X射线透视肠胃的内服剂——碳酸钡
B.生活用水的消毒剂——明矾
C工业生产氯气的原料——浓盐酸和二氧化锰
D.配制波尔多液原料——胆矾和石灰乳
16.下列检验方法错误的是 ( )
A.加入AgNO3溶液和稀硝酸有黄色沉淀产生,证明原溶液中肯定存在I-
B.加入盐酸酸化的BaCl2溶液有白色沉淀产生,证明原溶液中肯定存在SO42-
C.加NaOH溶液,加热,若生成的气体能使湿润的红色石蕊试纸变蓝,证明原溶液中
肯定存在NH4+
D.某无色气体,通入氧气后出现红棕色气体,证明原气体中肯定存在NO
17.下列有关说法错误的是( )
A. 晶体中一定存在化学键 B.金刚石是自然界最硬的物质
C. SO2可用作食品防腐剂 D.NO可用于某些疾病的治疗
18.室温时,在体积相同的容器里混合下列气体,混合后压强最大的是 ( )
A. 100mL NO与50mLO2 B. 100mLH2S与50mL SO2
C. 37.5mLN2与112.5mLH2 D. 100mL HCl与50mLNH3
19.右图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液。
挤压胶管的胶头,下列与试验事实不相符的是( )
A.CO2 (饱和NaHCO3溶液) 无色喷泉
B.NH3(H2O含酚酞) 红色喷泉
C.H2S(CuSO4溶液) 黑色喷泉
D.HCl (AgNO3溶液) 白色喷泉
20.在实验室里按图所示的装置来干燥、收集气体R,
多余的气体R可用水吸收,则R是( )
A.H2S B.HCl C.NH3 D.SO2
21.在一定条件下,将12mLNO和NO2的混合气的试管倒立于盛满水的水槽中,充分反应
后,容器内残留6mL的气体,则原混合气中NO的体积为 ( )
A.3mL B.6mL C.9 mL D.12 mL
22.把L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用mol烧碱刚好把NH3全部赶
出,另一份与氯化钡溶液完全反应消耗molBaCl2,则原溶液中(NO)为( )
A.mol/L B.mol/L
C.mol/L D.mol/L
23.把一定量的铁和硫化亚铁的混合物与100 mL 2 mol/L的硫酸充分反应后,固体完全
溶解,同时生成气体Y 3.36L(在标准状况下)。将反应后的溶液稀释到1 L,
测得溶液中C(H+)=0.1mol/L,则下列叙述一定正确的是( )
A.气体Y是H2 B. 反应中转移电子小于0.3 mol
C.反应中共消耗混合物10g D. 气体Y中H2和H2S的体积比为1:2
二、填空题
24.(1) 单质硫既能被氧化,又能被还原,请你写出一个化学方程式来体现硫的还原性:
__________________________________________________________________
黑火药爆炸时,发生的反应之一为:S+2KNO3+3CK2S+3CO2↑+N2↑
该反应中 1molS能氧化C______mol
(2) 以下是二氧化硫形成酸雨的两种途径:
请分别写出(1)和(4)的化学方程式:
_______________________________________,_________________________________
你认为减少酸雨产生的途径可采用的措施是
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
A、①②③ B、②③④⑤ C、①③⑤ D、①③④⑤
(3) 用二氧化硫气体分别进行如下性质实验:
① 氧化性:通入充满硫化氢气体的集气瓶,现象是____________________________,
反应的化学反应方程式为_______________________________________。
② 还原性:通入________溶液,观察到溶液褪色。
如何证明二氧化硫在该反应中被氧化
_____________________________________________________________________。
(4) Na2SO4和NaCl 溶液的鉴别可加__________试剂 (只限一种试剂),
有关离子方程式:_______________________________
25.
(1) 写出N2的电子式:_________; 将空气中的氮气转化为氮的化合物的过程称为固氮。
下列能实现人工固氮的是 ________
A. 闪电 B. 电解饱和食盐水车间 C. 根瘤 D.合成氨车间
(2) 某无色混和气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后
发现气体体积减少,将剩余气体在空气接触后,气体呈红棕色,
此混和气中一定不含有
(3) 在实验室有几种方法可制取氨气:
通常用加热消石灰与硫酸铵固体的方法来制取氨气。
①写出此反应的化学方程式________________________________________________ ,
下面是实验室制取氨气的装置和选用的试剂,其中错误的是 ________
A B C D
②氨气可使湿润的红色的石蕊试纸变蓝的原因(用方程式表示)
______________________________________________________________________
③用乙装置吸收一段时间氨后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶
内,锥形瓶中不可能生成的物质是:
A H2 B NO2 C HNO3 D NH4NO3
写出乙装置中氨催化氧化的化学方程式:
(4) 如果在实验室里检验某白色固体是铵盐,提供下列试剂给你选择,
其中不应选择的试剂是____________
A蒸馏水 B氢氧化钠溶液 C浓盐酸 D稀硫酸
(5) 已知:3Cl2+2NH3 AUTOTEXT => \* MERGEFORMAT →N2+6HCl, 常温常压下,在一密闭容器中将15ml Cl2和40ml NH3
充分反应后,剩余气体的体积为 mL。
(6) 在标况下,1L水中溶解700LNH3,所得溶液的密度为0.9g/cm3,
则氨水的物质的量浓度为_________mol/L(保留一位小数)
三、实验题
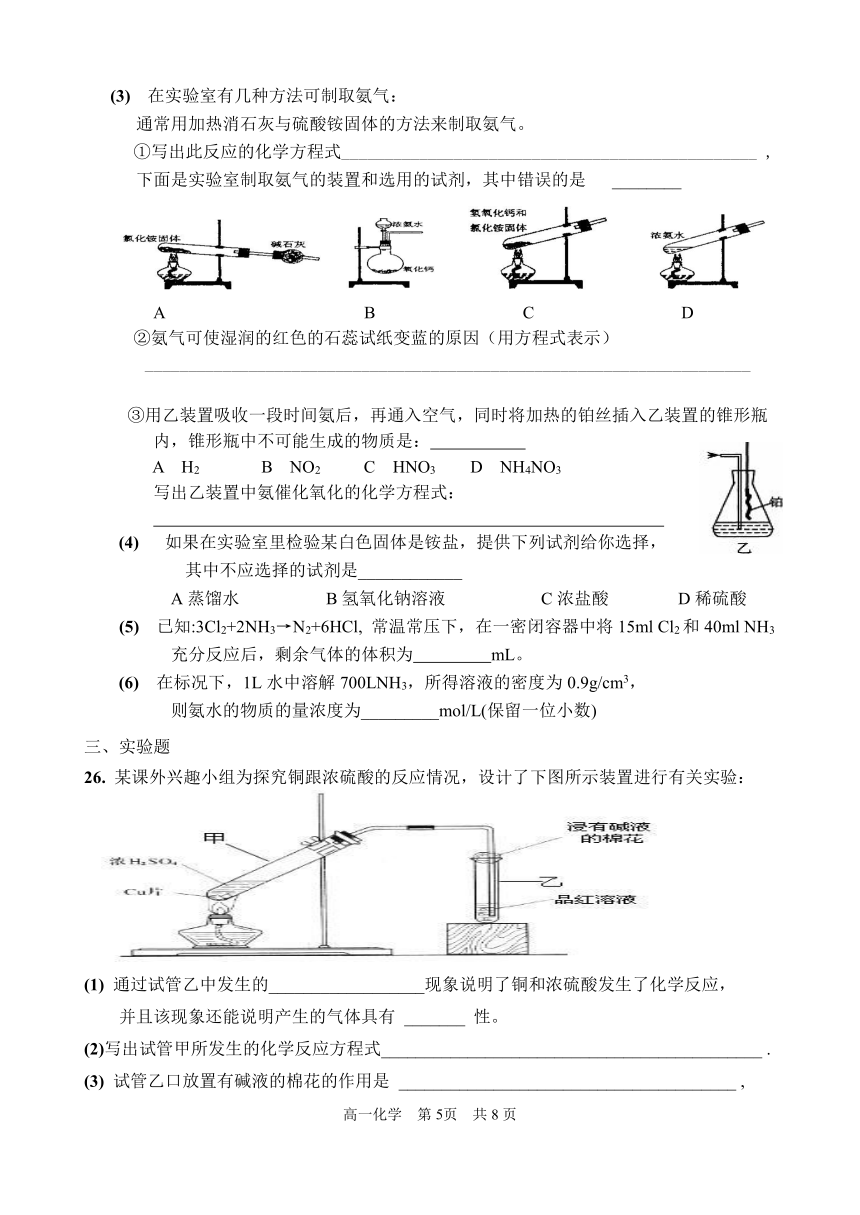
26. 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进行有关实验:
(1) 通过试管乙中发生的__________________现象说明了铜和浓硫酸发生了化学反应,
并且该现象还能说明产生的气体具有 _______ 性。
(2)写出试管甲所发生的化学反应方程式____________________________________________ .
(3) 试管乙口放置有碱液的棉花的作用是 _______________________________________ ,
(4) 实验中,取一定质量的铜片和浓硫酸放在试管甲中共热,直到反应完毕,最后发现试管甲中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①下列药品中能用来证明反应结束后的试管甲中确有余酸的是____________。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
② 为测定上述反应中铜消耗的质量,还需进行的实验是:取出试管甲内反应后的混合液,
向其中加入足量的 试剂, 然后进行的操作步骤是 。
(选出测定过程中所需的基本操作且按操作先后顺序列出)。
(a) 萃取、分液 (b) 过滤、洗涤
(c) 蒸发、结晶 (d) 冷却、称量 (e) 烘干或灼烧
四、计算题
27. (1)硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~900℃时,
硫铁矿在在沸腾炉中煅烧,发生下列反应: 4FeS2+11O2→2Fe2O3+8SO2
(杂质不与氧气反应)
设120 kg纯净的FeS2与氧气完全反应,产生标准状况下SO2_________m3。
(2) 0.65mol铜与100ml、18mol/L的浓硫酸充分反应后,铜完全溶解,
将所得溶液稀释到10L,在此溶液中滴加5mol/L的氢氧化钠溶液至沉淀质量最大时,
需氢氧化钠溶液________ ml.
(3) 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热使之充分反应。
如图是加入的混合物质的质量和产生的气体体积(标准状况)的关系。
则NaOH的物质的量浓度为_______________ mol/L
(4) 某Na2SO3固体已部分被氧化为Na2SO4,经测定该混合物中含硫的质量分数为25%,
取51.2g该混合物加入某浓度过量的硫酸50mL,加热使气体全部逸出并收集,然后再向
溶液中加入0.5mol/L氢氧化钠溶液50 mL恰好中和余酸。
求硫酸溶液的物质的量浓度(要求解答过程)
青浦高级中学2011学年第二学期期中考试
高一化学答题卷
一、单选题:
1 2 3 4 5 6 7 8 9 10
11 12 13 14 15 16 17 18 19 20
21 22 23
二、填空
24.
(1) ___________________________ _______mol
(2) _____________________________, ______________________________, ________
(3)
①_____________________________________; ________________________________ ② ________, ____________________________________________________________
(4) _________________, _________________________________________________
25.
(1) ____________, _________________ (2) _____________________
(3)
①_________________________________________________________; __________
②_____________________________________________________________________
③ ____________, ___________________________________________________
(4) ______________ (5) ____________ ml (6) __________________mol/L
三、实验题
26. (1)__________________, __________________
(2)________________________________________________________________
(3)________________________________________________________________
(4)
① ________________ ② ____________ _________________________
四、计算题
27. (1) ____________ m3 (2) ____________ ml (3)__________ mol/L
(4)
青浦高级中学2011学年第二学期期中考试
高一化学参考答案
一、单选题:(每小题2分,共46分)
1 2 3 4 5 6 7 8 9 10
B D A A C D B C D D
11 12 13 14 15 16 17 18 19 20
B C D C D B A C A C
21 22 23
A B B
二、填空
24.(共14分)
(1) S + O2 → SO2 (1分) 0.5 mol (2分)
(2) 2SO2+O2 2SO3 2H2SO3 + O2 → 2 H2SO4 C (1+1+1分)
(3)
① 瓶壁有淡黄色粉末和无色的小液滴(2分); SO2 + 2H2S →3 S↓ + 2H2O(1分)
② 溴水(合理即可) 检验溶液中有SO42—离子生成即可证明(1+2分)
(4) BaCl2(合理即可) Ba2++ SO42-→ BaSO4↓(1+1分)
25.(共20分)
(1) (1分) D (1分) (2) O2、HCl (2分)
(3)
①(NH4)2SO4+Ca(OH)2CaSO4+2NH3↑+2H2O(2分) AC(2分)
② NH3+H2O NH3 H2O (1分) NH3 H2O NH+OH-(1分)
③ A (2分) 4NH3+5O24NO+6H2O (2分)
(4) D (2分) (5) 5ml (2分) (6) 18.4mol/L(2分)
三、实验题(共10分)
26. (1)褪色(1分), 漂白性(1分)
(2) Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O(2分)
(3)吸收有毒的尾气,防止污染大气(1分)
(4)
①AD (2分) ② NaOH(合理即可) (1分) bed(2分)
四、计算题(共10分)
(1) 44.8 m3 (2分) (2) 460 ml (2分) (3)5 mol/L(2分)
(4) 7.25mol/L (4分)
水袋
水袋
固体
碎块
食物
SO2
SO3
H2SO3
H2SO4
(1)催化剂
(2)
(3)
(4)
点燃
催
△
△
1
高一化学 第1页 共8页
同课章节目录
