1.3.4 物质的量在化学方程式(鲁科版必修1)
文档属性
| 名称 | 1.3.4 物质的量在化学方程式(鲁科版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 536.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-25 15:01:15 | ||
图片预览










文档简介
(共33张PPT)
第4课时 物质的量在化学方程式
计算中的应用
一、物质的量在化学反应方程式中的应用
1.实验室用锌和盐酸制取氢气。现将65 g锌放入足量的盐酸中,请将反应物消耗的量、产物生成的量按要求填写下表:
化学反应 Zn + 2HCl===ZnCl2 + H2↑
1 ∶ 2 ∶ 1 ∶ 1
化学计量数之比
变化质量 65 g ____ _____ ____
物质的量或气体体积 ______ _______ _______ ______或
______(STP)
1mol
2 mol
1 mol
1 mol
22.4 L
136g
2g
73g
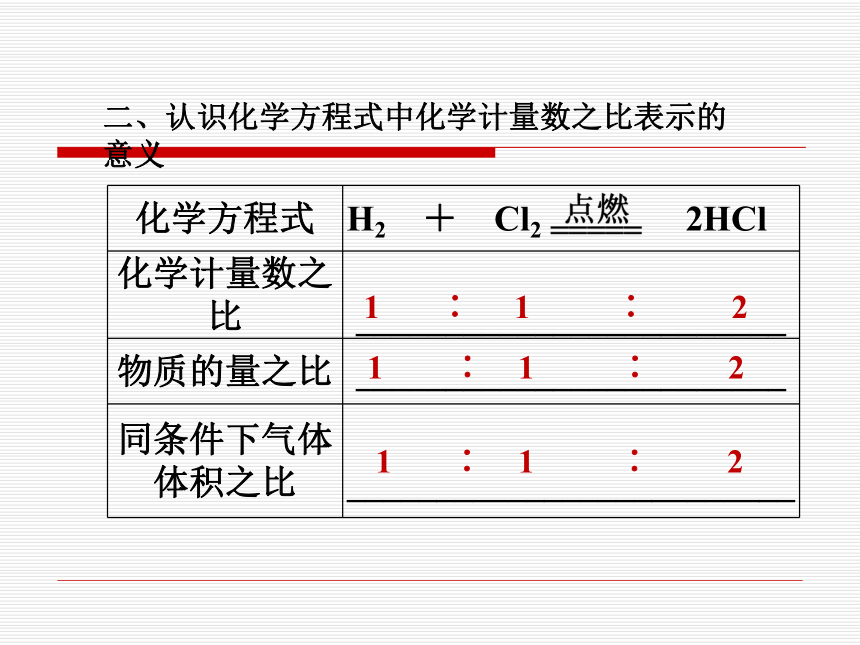
二、认识化学方程式中化学计量数之比表示的意义
化学方程式 H2 + Cl2 2HCl
化学计量数之比 ________________________
物质的量之比 ________________________
同条件下气体
体积之比 _________________________
1 ∶ 1 ∶ 2
1 ∶ 1 ∶ 2
1 ∶ 1 ∶ 2
[开放探究] (1)应用化学方程式进行计算时,不同物理量可用于同一方程式中吗?
(2)在化学反应中,反应物的总物质的量一定等于生成物的总物质的量吗?
提示: (1)可以,只要上下单位一致即可。
(2)不一定。化学反应过程中,物质的总物质的量可能不变、减小或增大,与化学方程式中的系数有关
1.将足量的铁屑放入100 mL稀硫酸中充分反应后,生成2.24 L H2(STP)。则稀硫酸的物质的量浓度为( )
A.3 mol·L-1 B.2 mol·L-1
C.1 mol·L-1 D.无法计算
答案: C
2.50 mL BaCl2溶液和20 mL 0.5 mol·L-1的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中Cl-的物质的量浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.8 mol·L-1 D.1 mol·L-1
答案: B
3.(2011·汕头高一质检)在反应A+3B===2C中,若7 g A和一定量B完全反应生成8.5 g C,则A、B、C的摩尔质量之比为( )
A.14∶3∶17 B.28∶2∶17
C.1∶3∶2 D.无法确定
答案: B
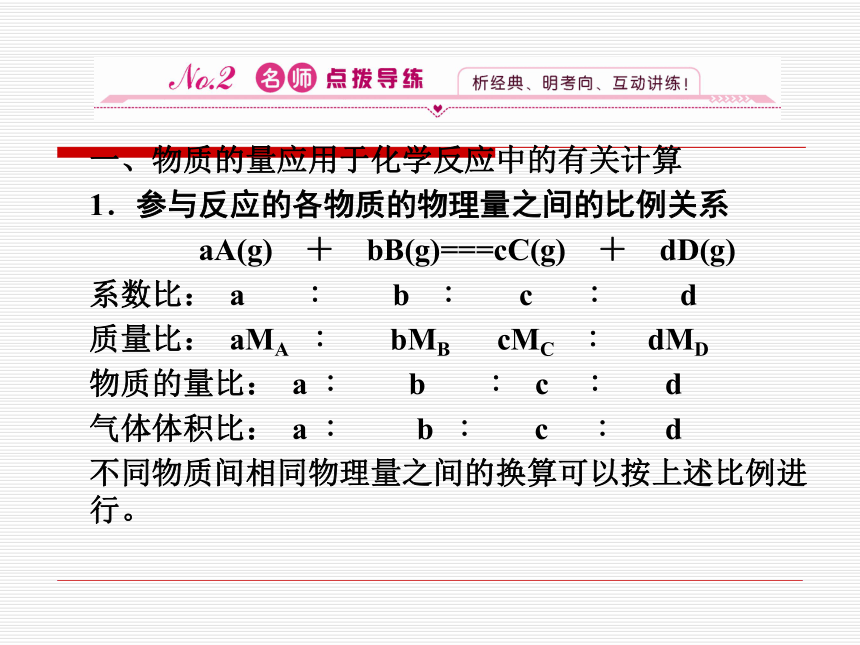
一、物质的量应用于化学反应中的有关计算
1.参与反应的各物质的物理量之间的比例关系
aA(g) + bB(g)===cC(g) + dD(g)
系数比: a ∶ b ∶ c ∶ d
质量比: aMA ∶ bMB cMC ∶ dMD
物质的量比: a ∶ b ∶ c ∶ d
气体体积比: a ∶ b ∶ c ∶ d
不同物质间相同物理量之间的换算可以按上述比例进行。
2.不同物理量间的换算方法
aA(g) + bB(g)===cC(g) + dD(g)
a× MA g b mol c× 22.4 L d mol
m(A) n(B) V(C) n(D)
在10 mL 2 mol·L-1的盐酸中加入足量的锌粒,完全反应后求:
(1)反应掉的锌粒的质量。
(2)标准状况下生成H2的体积。
盐酸中n(HCl)=0.01 L×2 mol·L-1=0.02 mol
解法一:Zn + 2HCl === ZnCl2+H2↑
1 2 1
n(Zn) 0.02 mol n(H2)
1∶2=n(Zn)∶0.02 mol n(Zn)=0.01 mol
2∶1=0.02 mol∶n(H2) n(H2)=0.01 mol
m(Zn)=n(Zn)·M(Zn)=0.01 mol×65 g·mol-1=0.65 g
V(H2)=n(H2)·Vm=0.01 mol×22.4 L·mol-1=0.224 L
解法二:Zn + 2HCl===ZnCl2+H2↑
65 g 2 mol 22.4 L
m(Zn) 0.02 mol V(H2)
65 g∶m(Zn)=2 mol∶0.02 mol,
答案: (1)0.65 g (2)0.224 L
二、过量计算
1.过量计算的原则
物质发生化学反应是按化学方程式确定的比例关系进行的,若题目给出两个或两个以上反应物的量,则应先判断反应物谁过量,然后按不足量的反应物的量进行计算。
2.反应物过量的判断方法
方法一:先求出给定反应物的物质的量之比,与化学方程式中相应反应物的系数之比作比较进行过量判断。
方法二:假设其中一种反应物不足,完全反应,求出另一反应物的量,然后把另一反应物的所求量与已知量相比较,若小于已知量,说明假设正确;若大于已知量,说明假设不正确。
将5.55 g CaCl2与6.00 g Na2CO3共同溶于足量的水中并进行充分地搅拌混匀,生成沉淀的质量是多少?
答案: 5.00 g
名师提醒: 过量计算题的解题步骤:(1)判断过量物质;(2)根据完全反应的物质利用化学方程式计算。
1.一般先将已知量转化为该物质的物质的量,再根据化学方程式计算。
2.若已知两种或两种以上反应物的数据,在利用化学方程式计算时,先判断过量问题,再用完全反应物质的数据计算。
1.在一定温度和压强下,1体积的X2(气)与3体积的Y2(气)化合生成2体积的气态化合物A,则该化合物的化学式为( )
A.XY3 B.XY
C.X3Y D.X2Y3
解析: 根据题意有:X2+3Y2===2A;根据质量守恒定律知A的化学式为XY3(或Y3X)。
答案: A
2.(2011·潍坊高一质检)在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
答案: D
答案: C
4.已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为____ 。
答案: 106 g·mol-1
5.取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66 g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
答案: (1)1.0 mol·L-1 0.40 mol·L-1 (2)1.12 L
第4课时 物质的量在化学方程式
计算中的应用
一、物质的量在化学反应方程式中的应用
1.实验室用锌和盐酸制取氢气。现将65 g锌放入足量的盐酸中,请将反应物消耗的量、产物生成的量按要求填写下表:
化学反应 Zn + 2HCl===ZnCl2 + H2↑
1 ∶ 2 ∶ 1 ∶ 1
化学计量数之比
变化质量 65 g ____ _____ ____
物质的量或气体体积 ______ _______ _______ ______或
______(STP)
1mol
2 mol
1 mol
1 mol
22.4 L
136g
2g
73g
二、认识化学方程式中化学计量数之比表示的意义
化学方程式 H2 + Cl2 2HCl
化学计量数之比 ________________________
物质的量之比 ________________________
同条件下气体
体积之比 _________________________
1 ∶ 1 ∶ 2
1 ∶ 1 ∶ 2
1 ∶ 1 ∶ 2
[开放探究] (1)应用化学方程式进行计算时,不同物理量可用于同一方程式中吗?
(2)在化学反应中,反应物的总物质的量一定等于生成物的总物质的量吗?
提示: (1)可以,只要上下单位一致即可。
(2)不一定。化学反应过程中,物质的总物质的量可能不变、减小或增大,与化学方程式中的系数有关
1.将足量的铁屑放入100 mL稀硫酸中充分反应后,生成2.24 L H2(STP)。则稀硫酸的物质的量浓度为( )
A.3 mol·L-1 B.2 mol·L-1
C.1 mol·L-1 D.无法计算
答案: C
2.50 mL BaCl2溶液和20 mL 0.5 mol·L-1的AgNO3溶液混合后,恰好完全反应,则BaCl2溶液中Cl-的物质的量浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.8 mol·L-1 D.1 mol·L-1
答案: B
3.(2011·汕头高一质检)在反应A+3B===2C中,若7 g A和一定量B完全反应生成8.5 g C,则A、B、C的摩尔质量之比为( )
A.14∶3∶17 B.28∶2∶17
C.1∶3∶2 D.无法确定
答案: B
一、物质的量应用于化学反应中的有关计算
1.参与反应的各物质的物理量之间的比例关系
aA(g) + bB(g)===cC(g) + dD(g)
系数比: a ∶ b ∶ c ∶ d
质量比: aMA ∶ bMB cMC ∶ dMD
物质的量比: a ∶ b ∶ c ∶ d
气体体积比: a ∶ b ∶ c ∶ d
不同物质间相同物理量之间的换算可以按上述比例进行。
2.不同物理量间的换算方法
aA(g) + bB(g)===cC(g) + dD(g)
a× MA g b mol c× 22.4 L d mol
m(A) n(B) V(C) n(D)
在10 mL 2 mol·L-1的盐酸中加入足量的锌粒,完全反应后求:
(1)反应掉的锌粒的质量。
(2)标准状况下生成H2的体积。
盐酸中n(HCl)=0.01 L×2 mol·L-1=0.02 mol
解法一:Zn + 2HCl === ZnCl2+H2↑
1 2 1
n(Zn) 0.02 mol n(H2)
1∶2=n(Zn)∶0.02 mol n(Zn)=0.01 mol
2∶1=0.02 mol∶n(H2) n(H2)=0.01 mol
m(Zn)=n(Zn)·M(Zn)=0.01 mol×65 g·mol-1=0.65 g
V(H2)=n(H2)·Vm=0.01 mol×22.4 L·mol-1=0.224 L
解法二:Zn + 2HCl===ZnCl2+H2↑
65 g 2 mol 22.4 L
m(Zn) 0.02 mol V(H2)
65 g∶m(Zn)=2 mol∶0.02 mol,
答案: (1)0.65 g (2)0.224 L
二、过量计算
1.过量计算的原则
物质发生化学反应是按化学方程式确定的比例关系进行的,若题目给出两个或两个以上反应物的量,则应先判断反应物谁过量,然后按不足量的反应物的量进行计算。
2.反应物过量的判断方法
方法一:先求出给定反应物的物质的量之比,与化学方程式中相应反应物的系数之比作比较进行过量判断。
方法二:假设其中一种反应物不足,完全反应,求出另一反应物的量,然后把另一反应物的所求量与已知量相比较,若小于已知量,说明假设正确;若大于已知量,说明假设不正确。
将5.55 g CaCl2与6.00 g Na2CO3共同溶于足量的水中并进行充分地搅拌混匀,生成沉淀的质量是多少?
答案: 5.00 g
名师提醒: 过量计算题的解题步骤:(1)判断过量物质;(2)根据完全反应的物质利用化学方程式计算。
1.一般先将已知量转化为该物质的物质的量,再根据化学方程式计算。
2.若已知两种或两种以上反应物的数据,在利用化学方程式计算时,先判断过量问题,再用完全反应物质的数据计算。
1.在一定温度和压强下,1体积的X2(气)与3体积的Y2(气)化合生成2体积的气态化合物A,则该化合物的化学式为( )
A.XY3 B.XY
C.X3Y D.X2Y3
解析: 根据题意有:X2+3Y2===2A;根据质量守恒定律知A的化学式为XY3(或Y3X)。
答案: A
2.(2011·潍坊高一质检)在一定条件下,使CO和O2的混合气体26 g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14 g,则原混合气体中O2和CO的质量比可能是( )
A.9∶4 B.1∶1
C.7∶6 D.6∶7
答案: D
答案: C
4.已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为____ 。
答案: 106 g·mol-1
5.取50.0 mL Na2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51 g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66 g,并有气体放出。试计算:
(1)原混合溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积。
答案: (1)1.0 mol·L-1 0.40 mol·L-1 (2)1.12 L
