2.2.2 电解质在水溶液中的反应(鲁科版必修1)
文档属性
| 名称 | 2.2.2 电解质在水溶液中的反应(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 811.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-25 00:00:00 | ||
图片预览










文档简介
(共44张PPT)
第2课时 电解质在水溶液中的反应
一、离子反应
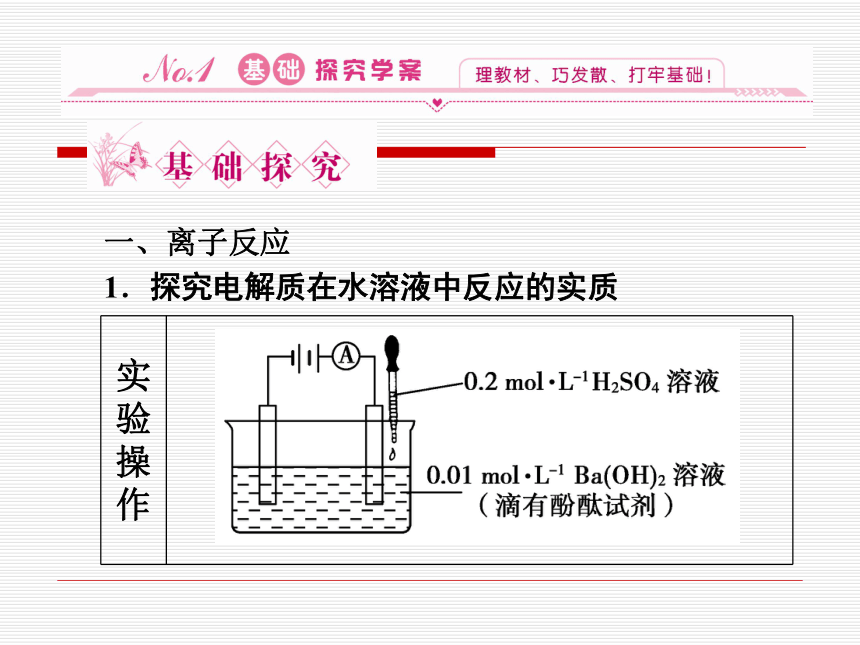
1.探究电解质在水溶液中反应的实质
实验操作
实验现象 随H2SO4溶液的滴入,电流表的指针读数 先由______后由______,溶液中同时出现 ________,颜色_________________
解释 稀H2SO4与Ba(OH)2溶液反应的实质是溶液 中的__________结合生成______的水,Ba2+ 和 结合生成BaSO4沉淀,溶液中离子的 浓度_____
大到小
小到大
白色沉淀
由红色变浅至无色
H+和OH-
难电离
降低
2.概念
在溶液中_________________的化学反应。
3.实质
某些离子浓度改变。
4.离子互换型的离子反应发生的条件
(1)_______________;
(2)_____________;
(3)_________________。
有离子参加或生成
生成挥发性物质
生成难溶物质
生成难电离的物质
[开放探究] 1.常见的难电离的物质有哪些?
提示:有弱酸(如HF、H2CO3、H2S、HClO、CH3COOH等)、弱碱(如NH3·H2O等)、水等
二、离子方程式
1.定义:用实际参加反应的_____的符号来表 示离子反应的式子。
2.意义:离子方程式更能描述化学反应的实 质,它不仅表示一定物质间的____反应,而且 表示所有_________的离子反应。
离子
某个
同一类型
3.离子方程式的书写步骤
(1)写——写出反应的_________式。
(2)拆——把易____________________的化学式 拆写成离子形式。
(3)删——删去方程式两边________________。
(4)查——检查离子方程式两边各____________、 _________是否相等。
化学方程
溶于水且易电离的物质
不参加反应的离子
元素原子个数
电荷总数
[开放探究] 2.酸、碱和盐在溶液中发生的反应属于离子反应。什么是离子反应?离子方程式与一般的化学方程式有什么区别和联系?复分解反应这类离子反应发生的条件是什么?
提示:有离子参加的化学反应称为离子反应。化学方程式和离子方程式的区别和联系在于:化学方程式只能描述化学反应,而离子方程式还可以揭示化学反应的本质,可以表示一类化学反应。复分解反应类型的离子反应发生的条件是:有难溶性物质生成,或有难电离的物质生成,或有气体生成 。
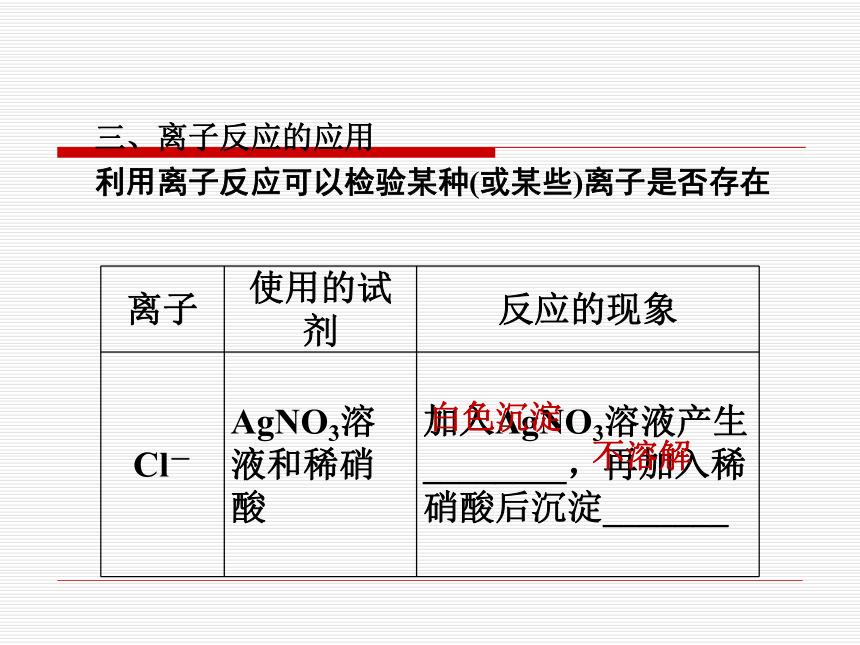
三、离子反应的应用
利用离子反应可以检验某种(或某些)离子是否存在
离子 使用的试剂 反应的现象
Cl- AgNO3溶液和稀硝酸 加入AgNO3溶液产生 ________,再加入稀 硝酸后沉淀_______
白色沉淀
不溶解
无色、无
味的气体
浑浊
白色沉淀
提示: 不能。因为此操作不能排除Ag+的干扰
1.下列两种物质混合,不能发生离子反应的是( )
A.Na2CO3溶液与足量HCl溶液
B.CuSO4溶液与KCl溶液
C.NaOH溶液与H2SO4溶液
D.BaCl2溶液与Na2SO4溶液
解析:不能发生反应是指不能生成弱电解质,不能生成气体或沉淀,A项生成H2O、CO2,C项生成H2O,D项生成BaSO4沉淀,只有B项不能反应。
答案:B
2.下列离子方程式不正确的是( )
A.氢氧化钡溶液与盐酸反应:OH-+H+===H2O
B.锌投入到稀硫酸中:Zn+2H+===Zn2++H2↑
C.碳酸钠溶液与盐酸反应:2H++Na2CO3===H2O+CO2↑+2Na+
D.金属钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
答案: C
答案: D
一、离子方程式的书写规则及正误判断
1.离子方程式的书写规则
(1)强酸、强碱和可溶性盐改写成离子形式;弱酸、弱碱、难溶性盐、气体、单质、氧化物、非电解质等都写成化学式。
2.离子方程式的正误判断
可以从以下几个方面去分析作出正误判断:
(1)看反应是否符合客观事实,不可主观臆造产物及化学反应。
(2)看表示各物质的化学式拆写是否正确。
(3)看是否漏写参加反应的离子。
(4)看原子个数、电荷总数是否守恒。
离子方程式正误判断应抓住以下三点:两易、两等、两查。“两易”即易溶且易电离的物质是否以离子形式表示。“两等”即离子方程式两边各元素原子个数和各电荷数是否相等。“两查”即检查是否漏掉反应条件、化学计量数是否相等。
A选项,碳酸氢钙为可溶性盐,应写成离子形式,硝酸为强酸,也应写成离子形式,正确;B选项,Ca(OH)2虽为微溶物,但在饱和石灰水中,仍以离子形式存在,故应写成离子形式,错误;C选项,没有配平,错误;D选项,醋酸为弱电解质,应写成化学式。
答案: A
1.能用H++OH-===H2O表示的是( )
A.Ba(OH)2溶液和稀硫酸的反应
B.NaOH溶液和盐酸的反应
C.Cu(OH)2溶液和稀硫酸的反应
D.NaOH溶液和CO2的反应
答案: B
二、离子共存问题
1.离子共存
离子间不能发生化学反应,它们在同一溶液中能大量共存;离子间能发生化学反应,它们在同一溶液中不能大量共存。
思路点拨: 分析隐含条件→分析反应情况→作出判断。
答案: C
乙厂的废水中含有另外三种离子,如果加一定量的________(选填“活性炭”、“硫酸亚铁”或“铁粉”)可以回收其中的金属________(填写金属元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______________(填写离子符号)转化为沉淀,经过滤后的废水主要含有__________,可用来浇灌农田。
答案: K+ OH- Cl- 铁粉 Ag Fe3+、Ag+、Cl-、OH- K+、NO
1.下列反应中,不属于离子反应的是( )
A.H2和O2的反应
B.铁与CuSO4溶液的反应
C.Ba(OH)2溶液和H2SO4溶液的反应
D.Na与水的反应
答案: A
2.(2011·南通高一质检)离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4
⑤CH3COOH
A.①③ B.①④⑤
C.②④⑤ D.①⑤
答案: C
解析: A项表示可溶性强酸和强碱生成可溶性盐和水的反应;B项为可溶性碳酸盐和强酸反应;C项中酸为可溶性强酸。
答案: D
解析: A项反应生成Fe2+;B项Ca(HCO3)2可溶,拆写成离子;D项H2CO3分解成CO2和水。
答案: C
5.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂:______________;离子方程式:________________________________。
(2)Cu(Fe):________________;离子方程式:________________________________。
(3)Na2SO4(Na2CO3)试剂:_____________;离子方程式:_________________________。
第2课时 电解质在水溶液中的反应
一、离子反应
1.探究电解质在水溶液中反应的实质
实验操作
实验现象 随H2SO4溶液的滴入,电流表的指针读数 先由______后由______,溶液中同时出现 ________,颜色_________________
解释 稀H2SO4与Ba(OH)2溶液反应的实质是溶液 中的__________结合生成______的水,Ba2+ 和 结合生成BaSO4沉淀,溶液中离子的 浓度_____
大到小
小到大
白色沉淀
由红色变浅至无色
H+和OH-
难电离
降低
2.概念
在溶液中_________________的化学反应。
3.实质
某些离子浓度改变。
4.离子互换型的离子反应发生的条件
(1)_______________;
(2)_____________;
(3)_________________。
有离子参加或生成
生成挥发性物质
生成难溶物质
生成难电离的物质
[开放探究] 1.常见的难电离的物质有哪些?
提示:有弱酸(如HF、H2CO3、H2S、HClO、CH3COOH等)、弱碱(如NH3·H2O等)、水等
二、离子方程式
1.定义:用实际参加反应的_____的符号来表 示离子反应的式子。
2.意义:离子方程式更能描述化学反应的实 质,它不仅表示一定物质间的____反应,而且 表示所有_________的离子反应。
离子
某个
同一类型
3.离子方程式的书写步骤
(1)写——写出反应的_________式。
(2)拆——把易____________________的化学式 拆写成离子形式。
(3)删——删去方程式两边________________。
(4)查——检查离子方程式两边各____________、 _________是否相等。
化学方程
溶于水且易电离的物质
不参加反应的离子
元素原子个数
电荷总数
[开放探究] 2.酸、碱和盐在溶液中发生的反应属于离子反应。什么是离子反应?离子方程式与一般的化学方程式有什么区别和联系?复分解反应这类离子反应发生的条件是什么?
提示:有离子参加的化学反应称为离子反应。化学方程式和离子方程式的区别和联系在于:化学方程式只能描述化学反应,而离子方程式还可以揭示化学反应的本质,可以表示一类化学反应。复分解反应类型的离子反应发生的条件是:有难溶性物质生成,或有难电离的物质生成,或有气体生成 。
三、离子反应的应用
利用离子反应可以检验某种(或某些)离子是否存在
离子 使用的试剂 反应的现象
Cl- AgNO3溶液和稀硝酸 加入AgNO3溶液产生 ________,再加入稀 硝酸后沉淀_______
白色沉淀
不溶解
无色、无
味的气体
浑浊
白色沉淀
提示: 不能。因为此操作不能排除Ag+的干扰
1.下列两种物质混合,不能发生离子反应的是( )
A.Na2CO3溶液与足量HCl溶液
B.CuSO4溶液与KCl溶液
C.NaOH溶液与H2SO4溶液
D.BaCl2溶液与Na2SO4溶液
解析:不能发生反应是指不能生成弱电解质,不能生成气体或沉淀,A项生成H2O、CO2,C项生成H2O,D项生成BaSO4沉淀,只有B项不能反应。
答案:B
2.下列离子方程式不正确的是( )
A.氢氧化钡溶液与盐酸反应:OH-+H+===H2O
B.锌投入到稀硫酸中:Zn+2H+===Zn2++H2↑
C.碳酸钠溶液与盐酸反应:2H++Na2CO3===H2O+CO2↑+2Na+
D.金属钠与水反应:2Na+2H2O===2Na++2OH-+H2↑
答案: C
答案: D
一、离子方程式的书写规则及正误判断
1.离子方程式的书写规则
(1)强酸、强碱和可溶性盐改写成离子形式;弱酸、弱碱、难溶性盐、气体、单质、氧化物、非电解质等都写成化学式。
2.离子方程式的正误判断
可以从以下几个方面去分析作出正误判断:
(1)看反应是否符合客观事实,不可主观臆造产物及化学反应。
(2)看表示各物质的化学式拆写是否正确。
(3)看是否漏写参加反应的离子。
(4)看原子个数、电荷总数是否守恒。
离子方程式正误判断应抓住以下三点:两易、两等、两查。“两易”即易溶且易电离的物质是否以离子形式表示。“两等”即离子方程式两边各元素原子个数和各电荷数是否相等。“两查”即检查是否漏掉反应条件、化学计量数是否相等。
A选项,碳酸氢钙为可溶性盐,应写成离子形式,硝酸为强酸,也应写成离子形式,正确;B选项,Ca(OH)2虽为微溶物,但在饱和石灰水中,仍以离子形式存在,故应写成离子形式,错误;C选项,没有配平,错误;D选项,醋酸为弱电解质,应写成化学式。
答案: A
1.能用H++OH-===H2O表示的是( )
A.Ba(OH)2溶液和稀硫酸的反应
B.NaOH溶液和盐酸的反应
C.Cu(OH)2溶液和稀硫酸的反应
D.NaOH溶液和CO2的反应
答案: B
二、离子共存问题
1.离子共存
离子间不能发生化学反应,它们在同一溶液中能大量共存;离子间能发生化学反应,它们在同一溶液中不能大量共存。
思路点拨: 分析隐含条件→分析反应情况→作出判断。
答案: C
乙厂的废水中含有另外三种离子,如果加一定量的________(选填“活性炭”、“硫酸亚铁”或“铁粉”)可以回收其中的金属________(填写金属元素符号)。另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______________(填写离子符号)转化为沉淀,经过滤后的废水主要含有__________,可用来浇灌农田。
答案: K+ OH- Cl- 铁粉 Ag Fe3+、Ag+、Cl-、OH- K+、NO
1.下列反应中,不属于离子反应的是( )
A.H2和O2的反应
B.铁与CuSO4溶液的反应
C.Ba(OH)2溶液和H2SO4溶液的反应
D.Na与水的反应
答案: A
2.(2011·南通高一质检)离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4
⑤CH3COOH
A.①③ B.①④⑤
C.②④⑤ D.①⑤
答案: C
解析: A项表示可溶性强酸和强碱生成可溶性盐和水的反应;B项为可溶性碳酸盐和强酸反应;C项中酸为可溶性强酸。
答案: D
解析: A项反应生成Fe2+;B项Ca(HCO3)2可溶,拆写成离子;D项H2CO3分解成CO2和水。
答案: C
5.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl)试剂:______________;离子方程式:________________________________。
(2)Cu(Fe):________________;离子方程式:________________________________。
(3)Na2SO4(Na2CO3)试剂:_____________;离子方程式:_________________________。
