2.3.3 探究铁及其化合物的氧化性和还原性(鲁科版必修1)
文档属性
| 名称 | 2.3.3 探究铁及其化合物的氧化性和还原性(鲁科版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 985.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-25 00:00:00 | ||
图片预览








文档简介
(共41张PPT)
第3课时 探究铁及其化合物的
氧化性和还原性
一、铁元素的存在
1.含量
铁元素在地壳中的含量仅次于___________三种 元素。
氧、硅、铝
2.存在形态
(1)游离态:存在于_____中。
(2)化合态:主要以________价铁的化合物存在。 如黄铁矿:_____、赤铁矿:_______、磁铁矿: ______、菱铁矿:_______等。
陨铁
+2、+3
FeS2
Fe2O3
Fe3O4
FeCO3
二、铁及其化合物的氧化性或还原性
1.预测与假设
(1)只有氧化性的微粒:Fe3+(填“Fe3+”、 “Fe2+”或“Fe”,下同)。
(2)只有还原性的微粒:___。
(3)既有氧化性又有还原性的微粒:____。
Fe
Fe2+
2.实验方案
(1)证明____只有氧化性,需加入还原剂,如 ___________等。
(2)证明____只有还原性,需加入氧化剂,如 _____________等。
(3)证明Fe2+有氧化性,需加入还原剂,如___; 证明其有还原性,需加入氧化剂,如_________ _____等。
3.实验步骤、实验现象
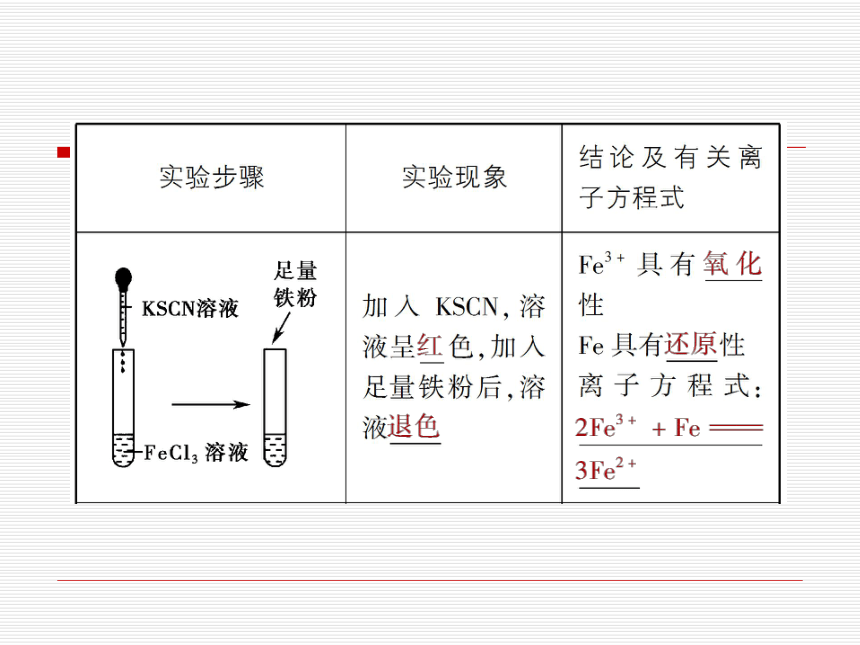
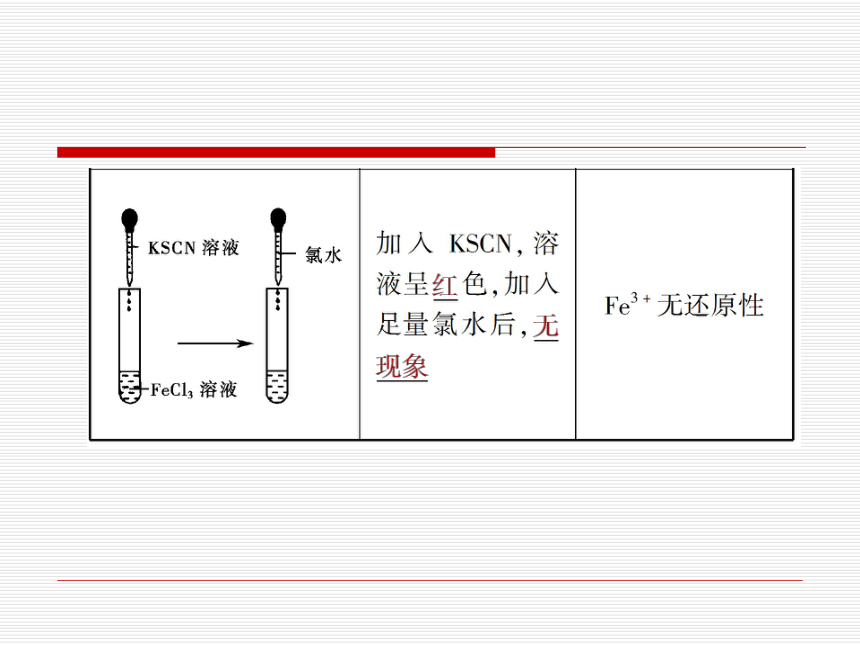
(1)Fe3+的性质探究
Fe3+
锌、铁、铜
Fe
氯水、稀硝酸
锌
氯水、稀
硝酸
(2)Fe2+的性质探究
[开放探究] (1)如何检验Fe3+?(回答三种方法)
(2)如何检验Fe2+?(回答三种方法)
提示: (1)①观察法:Fe3+的盐溶液呈棕黄色。
②加SCN-法:滴入KSCN或其他可溶性硫氰化 物溶液,若溶液呈红色,则证明原溶液中含有 Fe3+。
③加碱液法:加入碱液(如NaOH溶液、氨水等),若生成红褐色沉淀,则证明原溶液中含有Fe3+。
(2)①溶液呈浅绿色可能含Fe2+
②滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最终变为红褐色,说明有Fe2+,化学方程式为Fe2++2OH-===Fe(OH)2↓;4Fe(OH)2+O2+2H2O===4Fe(OH)3
③滴加KSCN溶液,无明显现象,再加入新制氯水,溶液立即变为红色,则说明有Fe2+存在
1.将铁片放入下列各溶液中,反应后溶液质量增加,但无气体产生的是( )
A.CuCl2溶液 B.AgNO3溶液
C.Fe2(SO4)3溶液 D.稀硫酸
解析: Fe能从CuCl2、AgNO3溶液中分别置换出Cu和Ag,而使溶液质量减轻;Fe与稀H2SO4反应后溶液质量增加,但有气体产生;Fe+Fe2(SO4)3===3FeSO4,溶液质量增加,且无气体产生。
答案: C
2.将下列物质溶于盐酸,滴加KSCN溶液颜色变红色的是( )
A.Fe B.Fe2O3
C.FeO D.FeSO4
解析: Fe2O3与盐酸反应生成Fe3+,Fe3+与SCN-反应使溶液显红色。
答案: B
3.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
答案: B
一、铁及其化合物的性质
1.铁
2.氧化物
FeO Fe2O3 Fe3O4
俗名 —— 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体
水溶性 难溶 难溶 难溶
化合价 +2 +3 +2、+3
下列叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含铁元素 ③Fe在纯氧中燃烧可得Fe2O3 ④Fe2O3不可与水反应得Fe(OH)3,所以不能通过化合反应制Fe(OH)3
⑤Fe(OH)2在空气中加热,可得FeO
A.② B.②④
C.②③④⑤ D.①②⑤
答案: B
二、Fe、Fe2+、Fe3+间的转化
1.转化示例
(2)FeFe3+ 2Fe+3Cl22FeCl3
3CO+Fe2O32Fe+3CO2
(3)Fe2+Fe3+ 2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Fe===3Fe2+ 2Fe3++Cu===2Fe2++Cu2+
在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+和Fe2+
C.Cu2+和Fe2+ D.Cu2+
思路点拨: 解答本题应抓住以下关键要点:
(1)Fe3+、Cu2+均与Fe反应
(2)铁粉过量时Fe3+、Cu2+均完全反应
在混合液中发生如下反应:
①2Fe3++Fe===3Fe2+
②Cu2++Fe===Cu+Fe2+
当铁过量时,Fe3+和Cu2+均完全反应。再由上述方程式可知,充分反应后溶液中只含Fe2+一种金属离子。
答案: A
若例2中FeCl3、CuCl2均为1 mol,当加入铁粉0.4 mol充分反应后,溶液中的金属阳离子有__________。
解析: 由于氧化性Fe3+>Cu2+,加入铁粉后可认为Fe3+先发生反应:2Fe3++Fe===3Fe2+,Fe3+完全反应需n(Fe)=0.5 mol,由于加入n(Fe)=0.4 mol<0.5 mol,所以Fe3+未完全反应,此时Cu2+尚未减少,故充分反应后溶液中存在Fe3+、Cu2+和Fe2+三种金属离子。
答案: Fe3+、Cu2+、Fe2+
1.(2011·佛山高一质检)下列化合物不能通过化合反应获得的是( )
A.FeCl2 B.FeCl3
C.Fe(OH)3 D.Fe2(SO4)3
答案: D
2.为了防止氯化亚铁溶液久置被氧化变质,常在其溶液中加入( )
A.铁粉 B.铜粉
C.氯化铁 D.盐酸
解析: Fe2+具有较强的还原性,易被空气中的O2氧化成Fe3+,而Fe3+具有较强的氧化性,故应放入铁粉:2Fe3++Fe===3Fe2+,C、D两项错误,而铜粉可与Fe3+反应:2Fe3++Cu===Cu2++2Fe2+,引进了杂质Cu2+,故B项错误。
答案: A
3.有A、B、C三种溶液,各含有Fe3+、Cu2+、Ag+中的一种。向A中加入适量铁粉,有红色固体析出,再加入C溶液,红色物质溶解,但无新固体物质析出,则A、B、C中依次含有
( )
A.Fe3+、Cu2+、Ag+
B.Cu2+、Ag+、Fe3+
C.Ag+、Fe3+、Cu2+
D.Cu2+、Fe3+、Ag+
解析:红色固体为Cu,故A溶液中含有Cu2+;使Cu溶解但无新固体物质析出,则加入的C溶液中含有Fe3+而非Ag+,故选B项。
答案:B
4.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
解析:加入NH4SCN溶液,溶液不变色,证明无Fe3+,再加氯水,如有Fe2+,则可被氧化为Fe3+,使溶液变红色。KMnO4也能氧化Fe2+,但KMnO4本身为紫色,使Fe3+和NH4SCN反应显色不易观察。
答案: C
5.A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
请填写下列空白:
(1)物质A是________,B是________,C是________。
(2)F中加入NaOH溶液,并在空气中放置的化学方程式是_____________________________
______________________________________。
解析: 由“D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色”这一信息可判断,D为FeCl3;以此为突破口,加之“其中A为固体,B为气体”的信息推出A、B分别为Fe、Cl2;再根据“B、C反应的产物易溶于水得到无色溶液E”这一信息,不难推出C为H2。
答案: (1)Fe Cl2 H2 (2)FeCl2+2NaOH===Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O===4Fe(OH)3
第3课时 探究铁及其化合物的
氧化性和还原性
一、铁元素的存在
1.含量
铁元素在地壳中的含量仅次于___________三种 元素。
氧、硅、铝
2.存在形态
(1)游离态:存在于_____中。
(2)化合态:主要以________价铁的化合物存在。 如黄铁矿:_____、赤铁矿:_______、磁铁矿: ______、菱铁矿:_______等。
陨铁
+2、+3
FeS2
Fe2O3
Fe3O4
FeCO3
二、铁及其化合物的氧化性或还原性
1.预测与假设
(1)只有氧化性的微粒:Fe3+(填“Fe3+”、 “Fe2+”或“Fe”,下同)。
(2)只有还原性的微粒:___。
(3)既有氧化性又有还原性的微粒:____。
Fe
Fe2+
2.实验方案
(1)证明____只有氧化性,需加入还原剂,如 ___________等。
(2)证明____只有还原性,需加入氧化剂,如 _____________等。
(3)证明Fe2+有氧化性,需加入还原剂,如___; 证明其有还原性,需加入氧化剂,如_________ _____等。
3.实验步骤、实验现象
(1)Fe3+的性质探究
Fe3+
锌、铁、铜
Fe
氯水、稀硝酸
锌
氯水、稀
硝酸
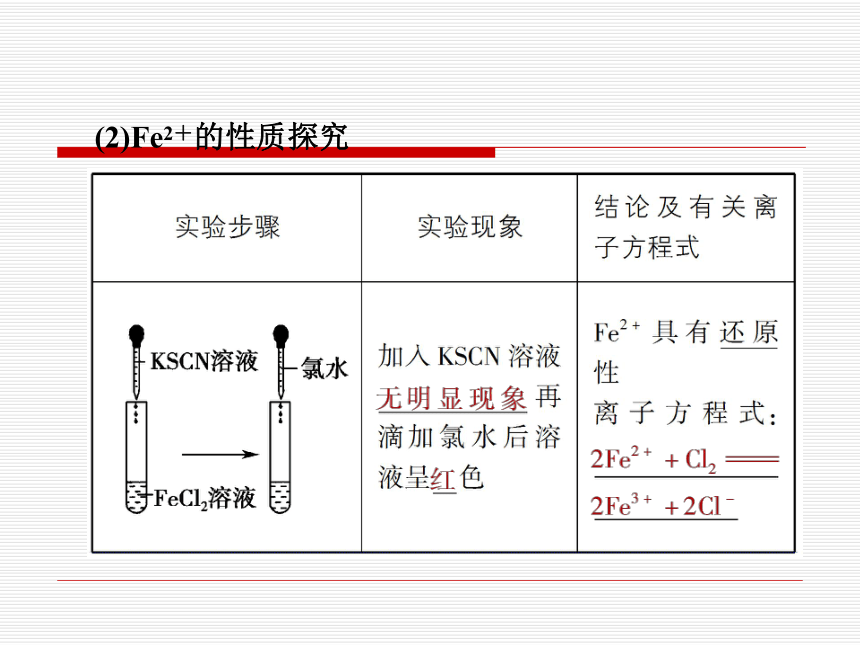
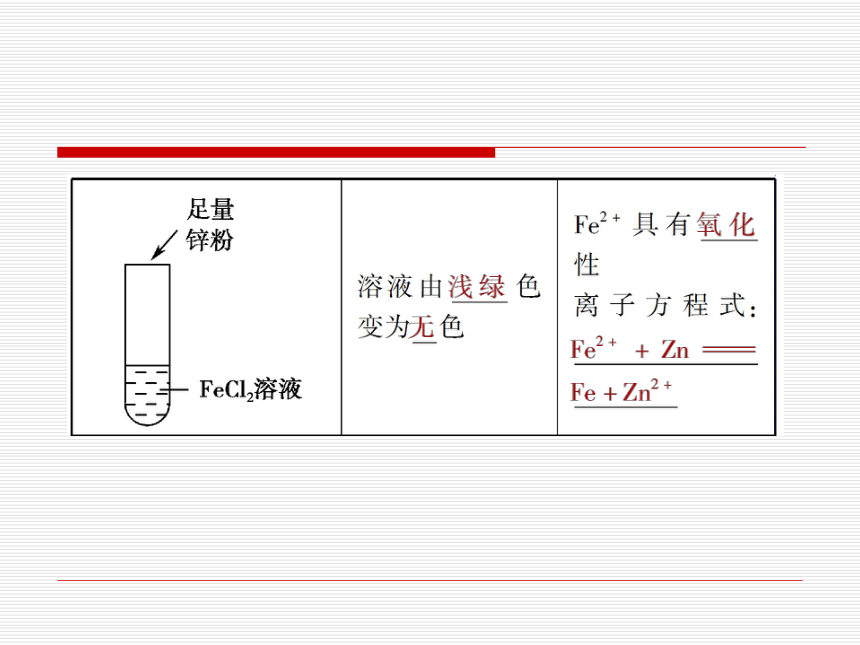
(2)Fe2+的性质探究
[开放探究] (1)如何检验Fe3+?(回答三种方法)
(2)如何检验Fe2+?(回答三种方法)
提示: (1)①观察法:Fe3+的盐溶液呈棕黄色。
②加SCN-法:滴入KSCN或其他可溶性硫氰化 物溶液,若溶液呈红色,则证明原溶液中含有 Fe3+。
③加碱液法:加入碱液(如NaOH溶液、氨水等),若生成红褐色沉淀,则证明原溶液中含有Fe3+。
(2)①溶液呈浅绿色可能含Fe2+
②滴加NaOH溶液,生成白色絮状沉淀,该沉淀迅速变为灰绿色,最终变为红褐色,说明有Fe2+,化学方程式为Fe2++2OH-===Fe(OH)2↓;4Fe(OH)2+O2+2H2O===4Fe(OH)3
③滴加KSCN溶液,无明显现象,再加入新制氯水,溶液立即变为红色,则说明有Fe2+存在
1.将铁片放入下列各溶液中,反应后溶液质量增加,但无气体产生的是( )
A.CuCl2溶液 B.AgNO3溶液
C.Fe2(SO4)3溶液 D.稀硫酸
解析: Fe能从CuCl2、AgNO3溶液中分别置换出Cu和Ag,而使溶液质量减轻;Fe与稀H2SO4反应后溶液质量增加,但有气体产生;Fe+Fe2(SO4)3===3FeSO4,溶液质量增加,且无气体产生。
答案: C
2.将下列物质溶于盐酸,滴加KSCN溶液颜色变红色的是( )
A.Fe B.Fe2O3
C.FeO D.FeSO4
解析: Fe2O3与盐酸反应生成Fe3+,Fe3+与SCN-反应使溶液显红色。
答案: B
3.下列物质能将Fe2+氧化为Fe3+,且能使单质Fe由0价变为+3价的是( )
A.氢气 B.氯气
C.浓盐酸 D.稀硫酸
答案: B
一、铁及其化合物的性质
1.铁
2.氧化物
FeO Fe2O3 Fe3O4
俗名 —— 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体
水溶性 难溶 难溶 难溶
化合价 +2 +3 +2、+3
下列叙述正确的是( )
①铁能被磁铁吸引,但纯铁易被腐蚀 ②在人体内的血红蛋白中含铁元素 ③Fe在纯氧中燃烧可得Fe2O3 ④Fe2O3不可与水反应得Fe(OH)3,所以不能通过化合反应制Fe(OH)3
⑤Fe(OH)2在空气中加热,可得FeO
A.② B.②④
C.②③④⑤ D.①②⑤
答案: B
二、Fe、Fe2+、Fe3+间的转化
1.转化示例
(2)FeFe3+ 2Fe+3Cl22FeCl3
3CO+Fe2O32Fe+3CO2
(3)Fe2+Fe3+ 2Fe2++Cl2===2Fe3++2Cl-
2Fe3++Fe===3Fe2+ 2Fe3++Cu===2Fe2++Cu2+
在FeCl3和CuCl2混合液中,加入过量的铁粉,充分反应后,溶液中的金属离子是( )
A.Fe2+ B.Fe3+和Fe2+
C.Cu2+和Fe2+ D.Cu2+
思路点拨: 解答本题应抓住以下关键要点:
(1)Fe3+、Cu2+均与Fe反应
(2)铁粉过量时Fe3+、Cu2+均完全反应
在混合液中发生如下反应:
①2Fe3++Fe===3Fe2+
②Cu2++Fe===Cu+Fe2+
当铁过量时,Fe3+和Cu2+均完全反应。再由上述方程式可知,充分反应后溶液中只含Fe2+一种金属离子。
答案: A
若例2中FeCl3、CuCl2均为1 mol,当加入铁粉0.4 mol充分反应后,溶液中的金属阳离子有__________。
解析: 由于氧化性Fe3+>Cu2+,加入铁粉后可认为Fe3+先发生反应:2Fe3++Fe===3Fe2+,Fe3+完全反应需n(Fe)=0.5 mol,由于加入n(Fe)=0.4 mol<0.5 mol,所以Fe3+未完全反应,此时Cu2+尚未减少,故充分反应后溶液中存在Fe3+、Cu2+和Fe2+三种金属离子。
答案: Fe3+、Cu2+、Fe2+
1.(2011·佛山高一质检)下列化合物不能通过化合反应获得的是( )
A.FeCl2 B.FeCl3
C.Fe(OH)3 D.Fe2(SO4)3
答案: D
2.为了防止氯化亚铁溶液久置被氧化变质,常在其溶液中加入( )
A.铁粉 B.铜粉
C.氯化铁 D.盐酸
解析: Fe2+具有较强的还原性,易被空气中的O2氧化成Fe3+,而Fe3+具有较强的氧化性,故应放入铁粉:2Fe3++Fe===3Fe2+,C、D两项错误,而铜粉可与Fe3+反应:2Fe3++Cu===Cu2++2Fe2+,引进了杂质Cu2+,故B项错误。
答案: A
3.有A、B、C三种溶液,各含有Fe3+、Cu2+、Ag+中的一种。向A中加入适量铁粉,有红色固体析出,再加入C溶液,红色物质溶解,但无新固体物质析出,则A、B、C中依次含有
( )
A.Fe3+、Cu2+、Ag+
B.Cu2+、Ag+、Fe3+
C.Ag+、Fe3+、Cu2+
D.Cu2+、Fe3+、Ag+
解析:红色固体为Cu,故A溶液中含有Cu2+;使Cu溶解但无新固体物质析出,则加入的C溶液中含有Fe3+而非Ag+,故选B项。
答案:B
4.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③②
C.③① D.①②③
解析:加入NH4SCN溶液,溶液不变色,证明无Fe3+,再加氯水,如有Fe2+,则可被氧化为Fe3+,使溶液变红色。KMnO4也能氧化Fe2+,但KMnO4本身为紫色,使Fe3+和NH4SCN反应显色不易观察。
答案: C
5.A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图:
请填写下列空白:
(1)物质A是________,B是________,C是________。
(2)F中加入NaOH溶液,并在空气中放置的化学方程式是_____________________________
______________________________________。
解析: 由“D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色”这一信息可判断,D为FeCl3;以此为突破口,加之“其中A为固体,B为气体”的信息推出A、B分别为Fe、Cl2;再根据“B、C反应的产物易溶于水得到无色溶液E”这一信息,不难推出C为H2。
答案: (1)Fe Cl2 H2 (2)FeCl2+2NaOH===Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O===4Fe(OH)3
