第 2 章末高效整合(鲁科版必修1)
图片预览

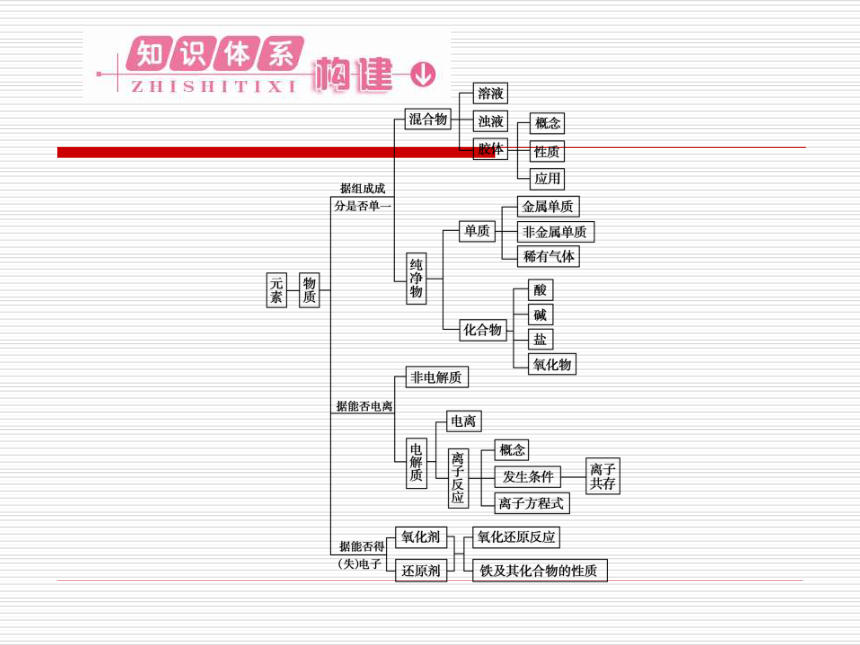





文档简介
(共17张PPT)
一、与量有关离子方程式的书写
1.反应物的相对量不同时的反应
(1)NaOH溶液与CO2的反应
分析并写出下列反应的离子方程式。
(1)向NaHCO3溶液中加入足量的澄清石灰水;
(2)向NaHCO3溶液中加入少量的澄清石灰水。
二、常用的守恒法
在化学计算中,守恒法是一种十分重要的解题方法,利用守恒法解题只要找出守恒的物理量即可,可以省略一些复杂的中间步骤,不必书写和配平化学方程式,往往可以收到事半功倍的效果。常见的守恒法有以下几种类型:
1.电子转移守恒:利用氧化还原反应中化合价的升降相等或电子得失守恒解题,这样只要正确分析变价元素即可,不用写出和配平化学反应方程式,做到简便准确。
2.电荷守恒法:①溶液不带电(溶液中阴离子所带负电荷总数等于阳离子所带正电荷总数);②离子方程式左右两边电荷相等,化学式中化合价的代数和为零。电荷守恒法多用于电解质溶液问题的处理。
3.元素守恒:包括原子、离子、原子团守恒,找出合理的关系式,可省去中间繁琐的化学反应过程。
0.3 mol Cu2S与足量浓硝酸反应,生成
Cu(NO3)2、H2SO4、NO2和H2O,则参加反应的硝酸中未被还原的硝酸的物质的量为_____ mol,被还原的硝酸的物质的量为______mol。
答案: 1.2 3
答案: C
答案: (1)RO2 (2)2 (3)0.64 mol
一、与量有关离子方程式的书写
1.反应物的相对量不同时的反应
(1)NaOH溶液与CO2的反应
分析并写出下列反应的离子方程式。
(1)向NaHCO3溶液中加入足量的澄清石灰水;
(2)向NaHCO3溶液中加入少量的澄清石灰水。
二、常用的守恒法
在化学计算中,守恒法是一种十分重要的解题方法,利用守恒法解题只要找出守恒的物理量即可,可以省略一些复杂的中间步骤,不必书写和配平化学方程式,往往可以收到事半功倍的效果。常见的守恒法有以下几种类型:
1.电子转移守恒:利用氧化还原反应中化合价的升降相等或电子得失守恒解题,这样只要正确分析变价元素即可,不用写出和配平化学反应方程式,做到简便准确。
2.电荷守恒法:①溶液不带电(溶液中阴离子所带负电荷总数等于阳离子所带正电荷总数);②离子方程式左右两边电荷相等,化学式中化合价的代数和为零。电荷守恒法多用于电解质溶液问题的处理。
3.元素守恒:包括原子、离子、原子团守恒,找出合理的关系式,可省去中间繁琐的化学反应过程。
0.3 mol Cu2S与足量浓硝酸反应,生成
Cu(NO3)2、H2SO4、NO2和H2O,则参加反应的硝酸中未被还原的硝酸的物质的量为_____ mol,被还原的硝酸的物质的量为______mol。
答案: 1.2 3
答案: C
答案: (1)RO2 (2)2 (3)0.64 mol
