浙教版科学九年级上册(二)第1章 物质及其变化(第4-5节) 练习(含答案)
文档属性
| 名称 | 浙教版科学九年级上册(二)第1章 物质及其变化(第4-5节) 练习(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 294.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-07-07 16:03:41 | ||
图片预览

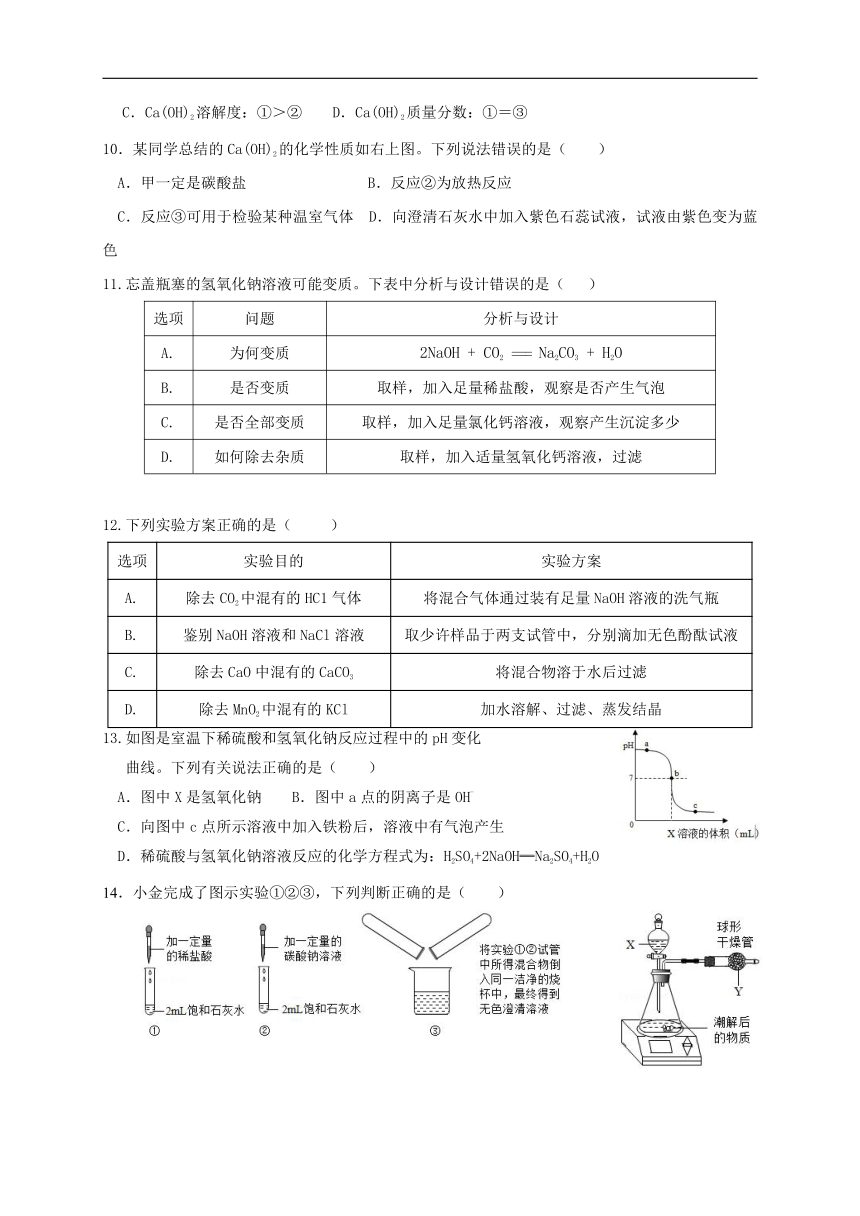

文档简介
科学九年级上册检测(二)第1章物质及其变化(第4-5节)
姓名 得分
一、选择题(每小题3分,共45分)
1. NaOH可用于造纸和印染工业,NaOH属于( )
A.单质 B.酸 C.碱 D.盐
2.下列物质不能与NaOH溶液反应的是( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
3.下列关于酸、碱的说法错误的是( )
A.苛性钠、烧碱、火碱都是氢氧化钠 B.氢氧化铁不能使紫色石蕊试液变蓝色
C.稀盐酸能够使酚酞溶液变红 D.生活中许多常见的物质(如柠檬、柑橘)中含有酸
4. 1839年虎门销烟采用的方法是:在海边挖池,放入烟土,引入海水浸泡,投入石灰,石灰遇水沸腾,烟土溶解。该过程发生的反应有CaO+H2O═Ca(OH)2。下列说法不正确的是( )
A.该反应属于化合反应 B.该反应会放出热量
C.由此反应推测氧化钙可干燥氯化氢气体 D.此反应可制备氢氧化钙
5.下列物质溶于水因发生化学反应放出热量的是( )
A.NaOH B.NH4NO3 C.NaCl D.CaO
6.下列关于Ca(OH)2的说法错误的是( )
A.微溶于水,水溶液呈碱性 B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液 D.澄清溶液可用来检验CO2
7.下列选项的应用与中和反应的原理无关的是( )
A.使用浓硫酸干燥CO2气体 B.使用熟石灰改良酸性土壤
C.服用含有Al(OH)3的药物治疗胃酸过多症 D.利用氢氧化钠溶液洗涤石油产品中的残余硫酸
8.下列物质间能够发生反应,但没有出现明显现象的是( )
A.将稀盐酸滴入盛石灰石的试管中 B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中 D.将稀硫酸滴入NaCl溶液中
9.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
10.某同学总结的Ca(OH)2的化学性质如右上图。下列说法错误的是( )
A.甲一定是碳酸盐 B.反应②为放热反应
C.反应③可用于检验某种温室气体 D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
11.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是( )
选项
问题
分析与设计
A.
为何变质
2NaOH + CO2 === Na2CO3 + H2O
B.
是否变质
取样,加入足量稀盐酸,观察是否产生气泡
C.
是否全部变质
取样,加入足量氯化钙溶液,观察产生沉淀多少
D.
如何除去杂质
取样,加入适量氢氧化钙溶液,过滤
12.下列实验方案正确的是( )
选项
实验目的
实验方案
A.
除去CO2中混有的HC1气体
将混合气体通过装有足量NaOH溶液的洗气瓶
B.
鉴别NaOH溶液和NaCl溶液
取少许样品于两支试管中,分别滴加无色酚酞试液
C.
除去CaO中混有的CaCO3
将混合物溶于水后过滤
D.
除去MnO2中混有的KCl
加水溶解、过滤、蒸发结晶
13.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化
曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠 B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
14.小金完成了图示实验①②③,下列判断正确的是( )
A.实验①中石灰水有剩余 B.实验②中有气泡产生
C.实验③中没有明显现象 D.实验③所得溶液中一定含CaCl2和NaCl
15.小余取8.0g干燥的氢氧化钠固体于敞口的锥形瓶中,观察到氢氧化钠固体发生潮解,一段时间后测得锥形瓶内物质质量为10.0g。为进一步探究上述现象的成因,小余立即用如图装置进行实验:将试剂X逐滴滴入锥形瓶中,直至不再产生气泡为止,测得装置前后质量减少了1.1g。(不考虑滴加液体体积、气体密度变化和结晶水的生成)下列推断正确的是( )
①试剂X可以是稀硫酸 ②固体Y可以是生石灰 ③滴加试剂X前锥形瓶内水的质量为0.9g
④若没有球形干燥管,测得氢氧化钠固体从空气中吸收水的质量会偏小
A.①③ B.①④ C.②③ D.②④
二、填空题和实验探究题(化学方程式方案2分,其余每空1分,共44分)
16.根据如图回答问题:
(1)加入稀盐酸至过量能观察到的现象是
。
(2)反应中,数目减少的离子是
(填离子符号)。
(3)验证反应后溶液中稀盐酸有剩余,下列操作可行的是 。
A.取样,加入CuO粉末 B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末 D.取样,滴加AgNO3溶液
17.如图表示硫元素的化合价与含硫物质类别的关系。
(1)B点表示的物质的类别是 。
(2)铁和E点物质反应生成的含铁化合物属于如图中的 (填字母)。
(3)C点所表示的物质与氢氧化钠溶液反应的化学方程式为
。
18.向160g含有H2SO4和CuSO4的混合溶液中逐滴
加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系
如图所示,请写出b点对应溶液的溶质 (填写化学式),原混合
溶液中CuSO4的质量分数是 。
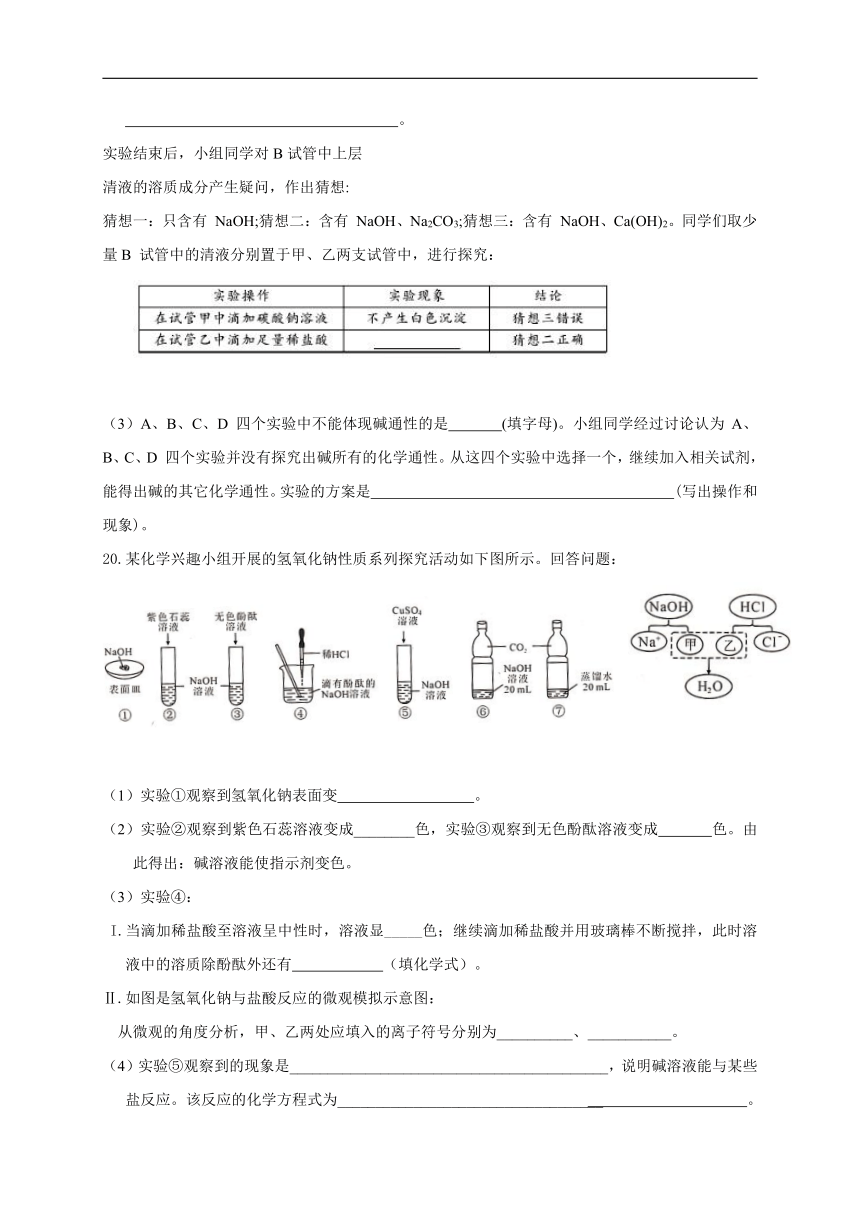
19.科学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
(1)实验A中,推入NaOH溶液后,可观察到
的现象是 。
(2)实验B 中发生反应的化学方程式为
。
实验结束后,小组同学对B试管中上层
清液的溶质成分产生疑问,作出猜想:
猜想一:只含有 NaOH;猜想二:含有 NaOH、Na2CO3;猜想三:含有 NaOH、Ca(OH)2。同学们取少量B 试管中的清液分别置于甲、乙两支试管中,进行探究:
(3)A、B、C、D 四个实验中不能体现碱通性的是 (填字母)。小组同学经过讨论认为 A、B、C、D 四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其它化学通性。实验的方案是 (写出操作和现象)。
20.某化学兴趣小组开展的氢氧化钠性质系列探究活动如下图所示。回答问题:
(1)实验①观察到氢氧化钠表面变 。
(2)实验②观察到紫色石蕊溶液变成________色,实验③观察到无色酚酞溶液变成 色。由此得出:碱溶液能使指示剂变色。
(3)实验④:
I.当滴加稀盐酸至溶液呈中性时,溶液显_____色;继续滴加稀盐酸并用玻璃棒不断搅拌,此时溶液中的溶质除酚酞外还有 (填化学式)。
Ⅱ.如图是氢氧化钠与盐酸反应的微观模拟示意图:
从微观的角度分析,甲、乙两处应填入的离子符号分别为__________、___________。
(4)实验⑤观察到的现象是__________________________________________,说明碱溶液能与某些盐反应。该反应的化学方程式为___________________________________ 。
(5)实验④⑤对应的化学反应,属于酸碱反应的是 (填数字序号)。
(6)实验⑥⑦为用软矿泉水瓶所做的对比实验,装 的软矿泉水瓶变瘪更明显,原因是_____________________________________________________________(用化学方程式表示)。
21.某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
【探究一】氢氧化钠的化学性质:如图所示,同学们用氢氧化钠溶液进行了下列实验,请回答:
(1)A试管中观察到的现象是 。
(2)B试管中发生反应的化学方程式: 。
(3)C、D试管中均无明显现象。
①为了证明D中已发生化学反应,向该试管中再加入足量的 ,观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。步骤Ⅱ中所加试剂为 。
【探究二】氢氧化钠的应用
(1)实验室中的应用: 实验室中能用氢氧化钠溶液吸收的气体是 (填字母)。
a.二氧化碳 b.水蒸气 c.氯化氢 d.氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的 不同。
(2)工业中的应用:氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9吨(H2SO4的质量分数为20%),可以处理的废水质量是 吨。
22.某化学兴趣小组在进行酸碱中和反应的实验时,先向烧杯中加入适量稀盐酸,并滴加几滴酚酞溶液,然后用滴管慢慢滴入稀氢氧化钠溶液,并不断搅拌,一会儿后停止滴加氢氧化钠溶液,观察到烧杯中溶液为无色。同学们对反应后的溶液M的成分进行如下探究:
【猜想假设】猜想Ⅰ:氢氧化钠过量,溶液M呈碱性。
猜想Ⅱ:氢氧化钠与盐酸恰好完全中和,溶液M呈中性。
猜想Ⅲ: 。
同学们经过讨论后认为猜想Ⅰ不正确,其理由是 。
【实验探究】(1)为了验证自己的猜想,小明设计了实验方案一:
实验步骤
实验现象
实验结论
取少量溶液M于试管中,滴加紫色石蕊溶液
溶液显 色
猜想Ⅱ正确
(2)小强设计了实验方案二:
实验步骤
实验现象
实验结论
取少量溶液M于试管中,滴加硝酸银溶液和稀硝酸
产生白色沉淀
猜想Ⅲ正确
【分析评价】同学们对小强的实验方案进行了分析,认为他的实验结论不正确。如果猜想Ⅱ正确,按照方案二的实验操作,也会生成白色沉淀,此时发生反应的化学方程式为
。
【再次探究】如果要验证猜想Ⅲ正确,可以设计实验方案三:取少量溶液M于试管中。然后分别加入下列物质进行实验,能观察到明显现象并得出正确结论的是 (填序号)。
①锌粒 ②铜丝 ③二氧化碳 ④氧化铁 ⑤氢氧化钾 ⑥硫酸铜 ⑦碳酸钙 ⑧硝酸铵
【拓展应用】若将等质量、等质量分数的氢氧化钾溶液与硝酸溶液混合。充分反应,则所得溶液中含有的溶质是 。
三、解答题(本题共11分)
23.现有盛88.4g Na2CO3和NaOH混合溶液的大烧杯,向其中滴加质量分数为9.8%的H2SO4溶液,充分搅拌,烧杯中溶液的质量与滴加H2SO4溶液的质量关系如图所示,求:
(1)写出AB段发生反应的化学方程式 。
(2)BC段可以观察到大烧杯的溶液中有气泡产生,则生成气体的质量为 g。
(3)C点时,大烧杯中的溶液pH 7(选填“>”、“=”或“<”)。
(4)C点时,所得溶液为不饱和溶液。求溶液中溶质的质量分数。
一、选择题(每小题3分,共45分)
CDCCD BABBA CCCDB
二、填空题和实验探究题(化学方程式方案2分,其余每空1分,共44分)
16.(1)溶液由红色变为无色;
(2)H+、OH﹣;
(3)ABC。
19.(1)气球胀大。(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,先无明显现象,一段时间后产生气泡。(3)B,在D试管中继续滴加稀盐酸,溶液由红色变为无色。
21.【探究一】(1)溶液由无色变为红色;(2)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)①稀盐酸(或稀硫酸等);②酚酞试液(或硫酸铜溶液或氯化铁溶液);
【探究二】(1)ac;溶解性;(2)50
22.(1)取少量溶液M于试管中,滴加紫色石蕊溶液,溶液显紫色,说明溶液显中性,猜想Ⅱ正确。
故填:紫。
(2)【分析评价】
如果猜想Ⅱ正确,按照方案二的实验操作,也会生成白色沉淀,是因为氯化钠能和硝酸银反应生成白色沉淀氯化银和硝酸钠,此时发生反应的化学方程式为:NaCl+AgNO3═AgCl↓+NaNO3。
故填:NaCl+AgNO3═AgCl↓+NaNO3。
【再次探究】
①锌粒能和稀盐酸反应生成氯化锌和氢气,过程中产生气泡,能够说明猜想Ⅲ正确;
②铜丝不能和稀盐酸反应,不能说明猜想Ⅲ正确;
③二氧化碳不能和盐酸反应,不能说明猜想Ⅲ正确;
④氧化铁和盐酸反应生成氯化铁和水,过程中溶液由无色变黄色,能够说明猜想Ⅲ正确;
⑤氢氧化钾和稀盐酸反应生成氯化钾和水,过程中无明显现象,不能说明猜想Ⅲ正确;
⑥硫酸铜不能和盐酸反应,不能说明猜想Ⅲ正确;
⑦碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,过程中产生气泡,能够说明猜想Ⅲ正确;
⑧硝酸铵不能和盐酸反应,不能说明猜想Ⅲ正确。
故填:①④⑦。
【拓展应用】
氢氧化钾和硝酸反应生成硝酸钾和水,反应的化学方程式及其质量关系:
KOH++HNO3═KNO3+H2O,
56?????????63
由以上质量关系可知,将等质量、等质量分数的氢氧化钾溶液与硝酸溶液混合,完全反应后氢氧化钾过量,则所得溶液中含有的溶质是反应生成的硝酸钾和过量的氢氧化钾。
故填:硝酸钾、氢氧化钾。
姓名 得分
一、选择题(每小题3分,共45分)
1. NaOH可用于造纸和印染工业,NaOH属于( )
A.单质 B.酸 C.碱 D.盐
2.下列物质不能与NaOH溶液反应的是( )
A.二氧化碳 B.硝酸 C.硫酸铜 D.氢氧化铁
3.下列关于酸、碱的说法错误的是( )
A.苛性钠、烧碱、火碱都是氢氧化钠 B.氢氧化铁不能使紫色石蕊试液变蓝色
C.稀盐酸能够使酚酞溶液变红 D.生活中许多常见的物质(如柠檬、柑橘)中含有酸
4. 1839年虎门销烟采用的方法是:在海边挖池,放入烟土,引入海水浸泡,投入石灰,石灰遇水沸腾,烟土溶解。该过程发生的反应有CaO+H2O═Ca(OH)2。下列说法不正确的是( )
A.该反应属于化合反应 B.该反应会放出热量
C.由此反应推测氧化钙可干燥氯化氢气体 D.此反应可制备氢氧化钙
5.下列物质溶于水因发生化学反应放出热量的是( )
A.NaOH B.NH4NO3 C.NaCl D.CaO
6.下列关于Ca(OH)2的说法错误的是( )
A.微溶于水,水溶液呈碱性 B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液 D.澄清溶液可用来检验CO2
7.下列选项的应用与中和反应的原理无关的是( )
A.使用浓硫酸干燥CO2气体 B.使用熟石灰改良酸性土壤
C.服用含有Al(OH)3的药物治疗胃酸过多症 D.利用氢氧化钠溶液洗涤石油产品中的残余硫酸
8.下列物质间能够发生反应,但没有出现明显现象的是( )
A.将稀盐酸滴入盛石灰石的试管中 B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中 D.将稀硫酸滴入NaCl溶液中
9.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
10.某同学总结的Ca(OH)2的化学性质如右上图。下列说法错误的是( )
A.甲一定是碳酸盐 B.反应②为放热反应
C.反应③可用于检验某种温室气体 D.向澄清石灰水中加入紫色石蕊试液,试液由紫色变为蓝色
11.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是( )
选项
问题
分析与设计
A.
为何变质
2NaOH + CO2 === Na2CO3 + H2O
B.
是否变质
取样,加入足量稀盐酸,观察是否产生气泡
C.
是否全部变质
取样,加入足量氯化钙溶液,观察产生沉淀多少
D.
如何除去杂质
取样,加入适量氢氧化钙溶液,过滤
12.下列实验方案正确的是( )
选项
实验目的
实验方案
A.
除去CO2中混有的HC1气体
将混合气体通过装有足量NaOH溶液的洗气瓶
B.
鉴别NaOH溶液和NaCl溶液
取少许样品于两支试管中,分别滴加无色酚酞试液
C.
除去CaO中混有的CaCO3
将混合物溶于水后过滤
D.
除去MnO2中混有的KCl
加水溶解、过滤、蒸发结晶
13.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化
曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠 B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
14.小金完成了图示实验①②③,下列判断正确的是( )
A.实验①中石灰水有剩余 B.实验②中有气泡产生
C.实验③中没有明显现象 D.实验③所得溶液中一定含CaCl2和NaCl
15.小余取8.0g干燥的氢氧化钠固体于敞口的锥形瓶中,观察到氢氧化钠固体发生潮解,一段时间后测得锥形瓶内物质质量为10.0g。为进一步探究上述现象的成因,小余立即用如图装置进行实验:将试剂X逐滴滴入锥形瓶中,直至不再产生气泡为止,测得装置前后质量减少了1.1g。(不考虑滴加液体体积、气体密度变化和结晶水的生成)下列推断正确的是( )
①试剂X可以是稀硫酸 ②固体Y可以是生石灰 ③滴加试剂X前锥形瓶内水的质量为0.9g
④若没有球形干燥管,测得氢氧化钠固体从空气中吸收水的质量会偏小
A.①③ B.①④ C.②③ D.②④
二、填空题和实验探究题(化学方程式方案2分,其余每空1分,共44分)
16.根据如图回答问题:
(1)加入稀盐酸至过量能观察到的现象是
。
(2)反应中,数目减少的离子是
(填离子符号)。
(3)验证反应后溶液中稀盐酸有剩余,下列操作可行的是 。
A.取样,加入CuO粉末 B.取样,滴加NaOH溶液
C.取样,加入CaCO3粉末 D.取样,滴加AgNO3溶液
17.如图表示硫元素的化合价与含硫物质类别的关系。
(1)B点表示的物质的类别是 。
(2)铁和E点物质反应生成的含铁化合物属于如图中的 (填字母)。
(3)C点所表示的物质与氢氧化钠溶液反应的化学方程式为
。
18.向160g含有H2SO4和CuSO4的混合溶液中逐滴
加入NaOH溶液至过量,产生的沉淀质量与加入NaOH溶液质量的关系
如图所示,请写出b点对应溶液的溶质 (填写化学式),原混合
溶液中CuSO4的质量分数是 。
19.科学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
(1)实验A中,推入NaOH溶液后,可观察到
的现象是 。
(2)实验B 中发生反应的化学方程式为
。
实验结束后,小组同学对B试管中上层
清液的溶质成分产生疑问,作出猜想:
猜想一:只含有 NaOH;猜想二:含有 NaOH、Na2CO3;猜想三:含有 NaOH、Ca(OH)2。同学们取少量B 试管中的清液分别置于甲、乙两支试管中,进行探究:
(3)A、B、C、D 四个实验中不能体现碱通性的是 (填字母)。小组同学经过讨论认为 A、B、C、D 四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其它化学通性。实验的方案是 (写出操作和现象)。
20.某化学兴趣小组开展的氢氧化钠性质系列探究活动如下图所示。回答问题:
(1)实验①观察到氢氧化钠表面变 。
(2)实验②观察到紫色石蕊溶液变成________色,实验③观察到无色酚酞溶液变成 色。由此得出:碱溶液能使指示剂变色。
(3)实验④:
I.当滴加稀盐酸至溶液呈中性时,溶液显_____色;继续滴加稀盐酸并用玻璃棒不断搅拌,此时溶液中的溶质除酚酞外还有 (填化学式)。
Ⅱ.如图是氢氧化钠与盐酸反应的微观模拟示意图:
从微观的角度分析,甲、乙两处应填入的离子符号分别为__________、___________。
(4)实验⑤观察到的现象是__________________________________________,说明碱溶液能与某些盐反应。该反应的化学方程式为___________________________________ 。
(5)实验④⑤对应的化学反应,属于酸碱反应的是 (填数字序号)。
(6)实验⑥⑦为用软矿泉水瓶所做的对比实验,装 的软矿泉水瓶变瘪更明显,原因是_____________________________________________________________(用化学方程式表示)。
21.某实验小组的同学对氢氧化钠的性质及应用进行了如下的探究。
【探究一】氢氧化钠的化学性质:如图所示,同学们用氢氧化钠溶液进行了下列实验,请回答:
(1)A试管中观察到的现象是 。
(2)B试管中发生反应的化学方程式: 。
(3)C、D试管中均无明显现象。
①为了证明D中已发生化学反应,向该试管中再加入足量的 ,观察到有气泡产生。
②为了证明氢氧化钠溶液和稀盐酸能发生化学反应,同学们设计并进行了如下实验:(所用稀盐酸经估算确保过量)整个实验过程中无明显现象,证明氢氧化钠溶液和稀盐酸能发生化学反应。步骤Ⅱ中所加试剂为 。
【探究二】氢氧化钠的应用
(1)实验室中的应用: 实验室中能用氢氧化钠溶液吸收的气体是 (填字母)。
a.二氧化碳 b.水蒸气 c.氯化氢 d.氧气
吸收上述所选气体,一般不用氢氧化钙溶液,主要是因为氢氧化钠和氢氧化钙的 不同。
(2)工业中的应用:氢氧化钠常用于制造人造丝、造纸、炼油、纺织、印染与橡胶工业。某造纸厂废水中NaOH的质量分数为1.6%,现有废硫酸4.9吨(H2SO4的质量分数为20%),可以处理的废水质量是 吨。
22.某化学兴趣小组在进行酸碱中和反应的实验时,先向烧杯中加入适量稀盐酸,并滴加几滴酚酞溶液,然后用滴管慢慢滴入稀氢氧化钠溶液,并不断搅拌,一会儿后停止滴加氢氧化钠溶液,观察到烧杯中溶液为无色。同学们对反应后的溶液M的成分进行如下探究:
【猜想假设】猜想Ⅰ:氢氧化钠过量,溶液M呈碱性。
猜想Ⅱ:氢氧化钠与盐酸恰好完全中和,溶液M呈中性。
猜想Ⅲ: 。
同学们经过讨论后认为猜想Ⅰ不正确,其理由是 。
【实验探究】(1)为了验证自己的猜想,小明设计了实验方案一:
实验步骤
实验现象
实验结论
取少量溶液M于试管中,滴加紫色石蕊溶液
溶液显 色
猜想Ⅱ正确
(2)小强设计了实验方案二:
实验步骤
实验现象
实验结论
取少量溶液M于试管中,滴加硝酸银溶液和稀硝酸
产生白色沉淀
猜想Ⅲ正确
【分析评价】同学们对小强的实验方案进行了分析,认为他的实验结论不正确。如果猜想Ⅱ正确,按照方案二的实验操作,也会生成白色沉淀,此时发生反应的化学方程式为
。
【再次探究】如果要验证猜想Ⅲ正确,可以设计实验方案三:取少量溶液M于试管中。然后分别加入下列物质进行实验,能观察到明显现象并得出正确结论的是 (填序号)。
①锌粒 ②铜丝 ③二氧化碳 ④氧化铁 ⑤氢氧化钾 ⑥硫酸铜 ⑦碳酸钙 ⑧硝酸铵
【拓展应用】若将等质量、等质量分数的氢氧化钾溶液与硝酸溶液混合。充分反应,则所得溶液中含有的溶质是 。
三、解答题(本题共11分)
23.现有盛88.4g Na2CO3和NaOH混合溶液的大烧杯,向其中滴加质量分数为9.8%的H2SO4溶液,充分搅拌,烧杯中溶液的质量与滴加H2SO4溶液的质量关系如图所示,求:
(1)写出AB段发生反应的化学方程式 。
(2)BC段可以观察到大烧杯的溶液中有气泡产生,则生成气体的质量为 g。
(3)C点时,大烧杯中的溶液pH 7(选填“>”、“=”或“<”)。
(4)C点时,所得溶液为不饱和溶液。求溶液中溶质的质量分数。
一、选择题(每小题3分,共45分)
CDCCD BABBA CCCDB
二、填空题和实验探究题(化学方程式方案2分,其余每空1分,共44分)
16.(1)溶液由红色变为无色;
(2)H+、OH﹣;
(3)ABC。
19.(1)气球胀大。(2)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,先无明显现象,一段时间后产生气泡。(3)B,在D试管中继续滴加稀盐酸,溶液由红色变为无色。
21.【探究一】(1)溶液由无色变为红色;(2)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(3)①稀盐酸(或稀硫酸等);②酚酞试液(或硫酸铜溶液或氯化铁溶液);
【探究二】(1)ac;溶解性;(2)50
22.(1)取少量溶液M于试管中,滴加紫色石蕊溶液,溶液显紫色,说明溶液显中性,猜想Ⅱ正确。
故填:紫。
(2)【分析评价】
如果猜想Ⅱ正确,按照方案二的实验操作,也会生成白色沉淀,是因为氯化钠能和硝酸银反应生成白色沉淀氯化银和硝酸钠,此时发生反应的化学方程式为:NaCl+AgNO3═AgCl↓+NaNO3。
故填:NaCl+AgNO3═AgCl↓+NaNO3。
【再次探究】
①锌粒能和稀盐酸反应生成氯化锌和氢气,过程中产生气泡,能够说明猜想Ⅲ正确;
②铜丝不能和稀盐酸反应,不能说明猜想Ⅲ正确;
③二氧化碳不能和盐酸反应,不能说明猜想Ⅲ正确;
④氧化铁和盐酸反应生成氯化铁和水,过程中溶液由无色变黄色,能够说明猜想Ⅲ正确;
⑤氢氧化钾和稀盐酸反应生成氯化钾和水,过程中无明显现象,不能说明猜想Ⅲ正确;
⑥硫酸铜不能和盐酸反应,不能说明猜想Ⅲ正确;
⑦碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,过程中产生气泡,能够说明猜想Ⅲ正确;
⑧硝酸铵不能和盐酸反应,不能说明猜想Ⅲ正确。
故填:①④⑦。
【拓展应用】
氢氧化钾和硝酸反应生成硝酸钾和水,反应的化学方程式及其质量关系:
KOH++HNO3═KNO3+H2O,
56?????????63
由以上质量关系可知,将等质量、等质量分数的氢氧化钾溶液与硝酸溶液混合,完全反应后氢氧化钾过量,则所得溶液中含有的溶质是反应生成的硝酸钾和过量的氢氧化钾。
故填:硝酸钾、氢氧化钾。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
