安徽省六安市舒城县2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 安徽省六安市舒城县2020-2021学年高一下学期期末考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-08 08:53:10 | ||
图片预览




文档简介
舒城县2020-2021学年度第二学期期末质检
高一化学试卷
温馨提示:
1.答卷前,考生务必将自己的姓名、班级、学号填写在答题卡上。
2.所有答案必须写在答题卡各题目指定区域内相应位置上。
3.考试时间:100分钟 试卷总分100分。
4.本卷部分试题分为市示范、省示范高中做,请按要求答题。
可能用到的相对原子质量H-1 C-12 N-14 O-16 -23 S-32 -27 -35.5 -56 -64
第Ⅰ卷选择题(共48分)
一、选择题(每题只有一个选项符合题意,第15、16题为选做题,分为市或省示范高中做)
1.化学与环境密切相关,下列有关说法不正确的是( )
A.属于大气污染物
B.酸雨是小于5.6的雨水
C.或都会导致酸雨的形成
D.大气中含量的增加会导致温室效应加剧
2.如图是研究二氧化硫性质的微型实验装置。现用60%硫酸和亚硫酸钠晶体反应制取气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
A.品红溶液褪色
B.紫色石蕊溶液变蓝色
C.新制氯水黄绿色褪去
D.含酚酞的溶液红色变浅或褪色
3.一氧化氮对SARS病毒的抑制作用明显。下列关于的说法正确的是( )
A.是酸性氧化物
B.只能通过人工合成
C.是大气污染物,会形成酸雨
D.可以用向下排空气法收集
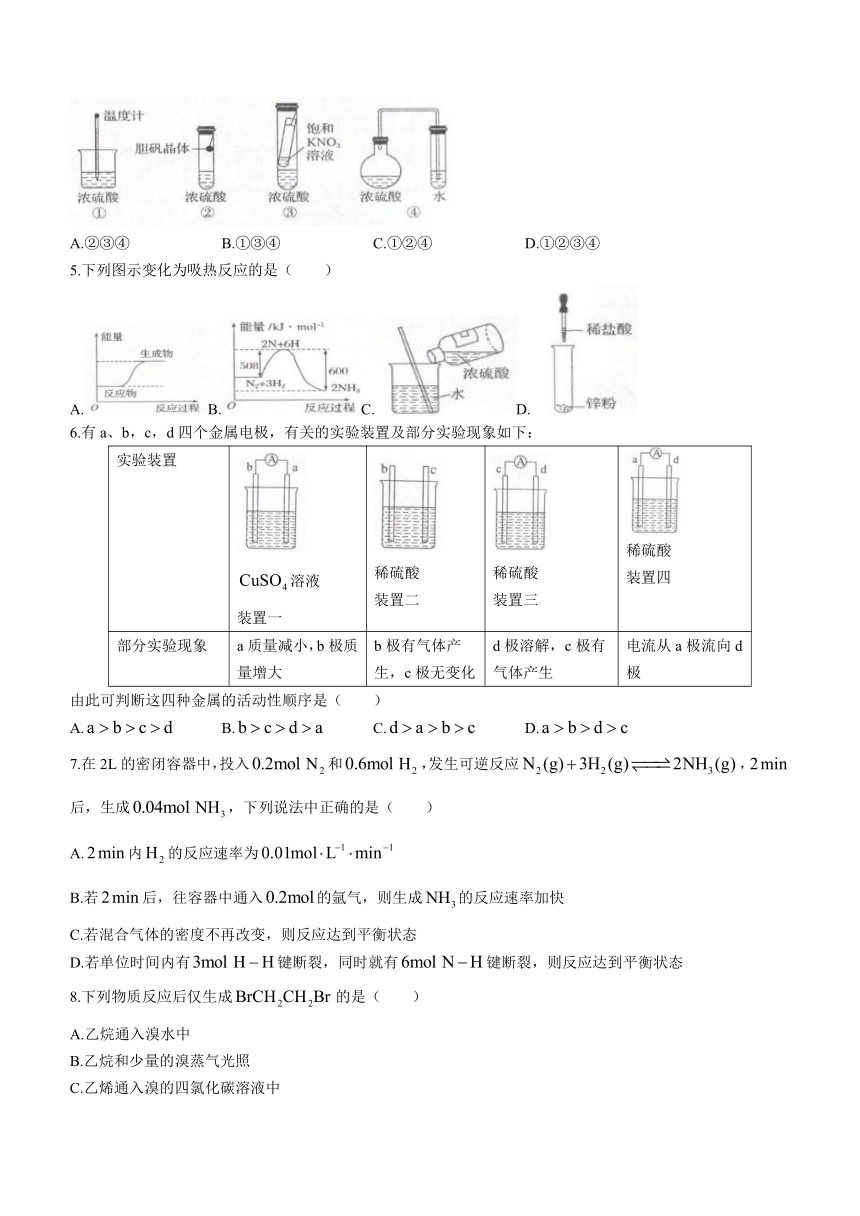
4.在实验探究课上,同学们积极思考,设计出如下图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是( )
A.②③④ B.①③④ C.①②④ D.①②③④
5.下列图示变化为吸热反应的是( )
A.B.C.D.
6.有a、b,c,d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
溶液
装置一
稀硫酸
装置二
稀硫酸
装置三
稀硫酸
装置四
部分实验现象 a质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A. B. C. D.
7.在2L的密闭容器中,投入和,发生可逆反应,后,生成,下列说法中正确的是( )
A.内的反应速率为
B.若后,往容器中通入的氩气,则生成的反应速率加快
C.若混合气体的密度不再改变,则反应达到平衡状态
D.若单位时间内有键断裂,同时就有键断裂,则反应达到平衡状态
8.下列物质反应后仅生成的是( )
A.乙烷通入溴水中
B.乙烷和少量的溴蒸气光照
C.乙烯通入溴的四氯化碳溶液中
D.乙烯和溴化氢加成
9.若将转化为,可使用的试剂是( )
A. B. C. D.
10,某有机物的结构简式为,下列关于该有机物的叙述中,不正确的是( )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与发生加成反应
C.不能使酸性溶液褪色
D.在铜作催化剂的条件下能发生催化氧化反应生成醛
11.糖类、脂肪、蛋白质是维持人体生命活动的三大营养物质。以下叙述正确的是( )
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应
D.蚕丝、羊毛、棉花的主要成分都是蛋白质
12.我国积极启动的“蓝天工程”和“绿水工程”是保护生态环境、提高全体人民生活质量的重要举措。下列措施不利于以上工程实施的是( )
A.推广使用燃煤脱硫技术防治污染,减少重金属、农药和难分解有机物的排放
B.实施绿色化学,即利用化学原理从源头上减少或消除工业生产对环境的污染
C.加大石油、煤炭的开采速度,增加化石燃料的供应量
D.开发新能源和新制冷剂,减少和氟氯烃等物质的大量排放
13.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是( )
A.①、②、③中除加试剂外,还需要进行过滤操作
B.a,b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
14.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应制备硫酸铜
D.用反应制备环氧乙烷
15.(本题市示范高中做)香菇是日常生活中常用的一种食用真菌,香菇中的烟酸的含量较高烟酸分子中六元环的结构与苯环相似。下列有关烟酸的说法错误的是( )
A.所有的碳原子均处于同一平面上
B.分子式为
C.六元环上的一氯代物有5种
D.烟酸能和氢氧化钠发生中和反应
15.(本题省示范高中做)大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质。后经研究,凡具有如方框内结构,且R不是氢原子的有机物,就可能是一种高效、低毒,对昆虫有强烈杀伤作用的杀虫剂。对此杀虫剂的下列叙述错误的是( )
A.能发生加氢反应,但其生成物无杀虫作用
B.只含有碳碳双键和酯基两种官能团
C.此类杀虫剂密封保存在碱性溶液中,其杀虫作用不变
D.左端的甲基()可被取代,其产物仍有杀虫作用
16.(本题市示范高中做)如图表示与稀硝酸反应的量的关系,a、b、c、d四点中表示铜与稀硝酸反应中被还原的与的量的关系的是( )
A.a B.b C.c D.d
16.(本题省示范高中做)足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和,的混合气体2.24L(标准状况),这些气体与一定体积的(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入溶液,则恰好完全沉淀。下列说法正确的是( )
A.此反应过程中转移的电子为
B.混合气体中含(标准状况)1.12L
C.参加反应的是
D.消耗氧气(标准状况)的体积为1.68L
第Ⅱ卷 非选择题(共52分)
二、综合解答题(第20,21题为选做题,分为市或省示范高中做)
17.(10分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验。实验中他们取64 g铜片和浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组同学认为还有一定量的硫酸剩余。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:__________。实验中若有mg铜参加了反应,则有______被还原,转移电子数目为______(设为阿伏加德罗常数的值)。
(2)下列试剂能证明反应停止后烧瓶中有硫酸剩余的是______(填字母)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
(3)为什么有一定量的硫酸剩余但未能使铜片完全溶解?原因是________________。
18.(8分)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
起始物质的量浓度/ 1.5 1 0
末物质的量浓度/ 0.9 0.8 0.4
请回答下列问题。
(1)该可逆反应的化学方程式可表示为__________________。
(2)用物质B来表示0~2s的平均反应速率为_____________。
(3)从反应开始到2s末,A的转化率为_________________。
(4)下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是______(填字母)。
A.(消耗)(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.
E.容器内气体C的物质的量分数保持不变
19.(10分)工业生产硫酸的黄铁矿烧渣(主要成分为及少量的、、、、等)是工业三废之一,其综合利用是一条变废为宝的重要途径。
Ⅰ.以黄铁矿烧渣为原料制备颜料铁红()和回收的生产工艺流程如图。
请回答下列问题:
(1)能提高“废渣溶解”速率的措施有___________(写出一条即可),“氧化”的目的是一价。
(2)中的化合价是______价。
(3)该工艺流程图中,第二次加入氨水后,反应的离子方程式为_________________。
Ⅱ.下图是以黄铁矿烧渣为原料制备颜料铁红的另外一种生产工艺流程。
(4)在滤液Ⅰ中加入熟石灰,反应的化学方程式是_____________。
(5)“氧化”反应较多,其中可以看作被水溶液中的氧化,氧化后的溶液中滴加溶液有不溶于盐酸的白色沉淀生成,则水溶液中与Cl2,反应的离子方程式为___________________。
(6)试剂X为过量铁粉,其作用是_____________。
20.(12分)(本题市示范高中做)某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图所示:
已知:石油裂解已成为生产H的主要方法,E的溶液能发生银镜反应,G是具有香味的液体,试回答下列问题:
(1)B的名称为__________。
(2)D的结构简式为___________;H的电子式为______________。
(3)写出H发生加聚反应的化学方程式:_____________________。
(4)D→E的化学方程式:___________________。
(5)F→G的化学方程式:______________。
20.(12分)(本题省示范高中做)乙醇分子中的羟基在一定条件下可以被氧化为基(),为验证此性质,有关实验如下:
Ⅰ.把一端弯成螺旋状的光亮铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约乙醇的试管里,反复操作几次。变黑后的铜丝插入乙醇里,铜丝表面的现象是黑色变成红色,上述过程中发生反应的总化学方程式为____________________。
Ⅱ.某实验小组用下列装置进行乙醇催化氧化的实验。已知乙醇的沸点为78.5℃。
①加入药品后,点燃洒精灯给铜网加热,打开止水夹,鼓入空气。
②实验过程中铜网出现红色和黑色交替的现象。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_________反应。
③甲和乙两个水浴的作用不相同。甲的作用是_________;乙的作用是_________。
④反应进行一段时间后,试管a中能收集到不同的混和物,若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_________。要除去该物质,可在混合液中加入碳酸氢钠溶液然后,再通过________(填实验操作名称)即可。
(2)在停止鼓入空气的条件下进行实验。
①关闭止水夹,为使乙醇持续进入反应管中,需要进行的操作是_________。
②乙醇蒸气进入反应管后,在铜作催化剂及250~350℃的条件下发生可逆反应,在试管中收集到与实验1相同的产物,并有可燃性气体单质放出。该实验揭示了乙醇催化氧化的本质。写出实验Ⅱ中反应的化学方程式:_____________。
(3)该小组通过以上实验探究提出了下列问题,你认为正确的是_____(填字母)。
a.将铜丝换成铜粉,得到乙醛的时间缩短
b.乙醇催化氧化生成乙醛时,乙醇分子中只有键发生断裂
c.表面被氧化为黑色的铜丝在酒精灯上灼烧,可闻到刺激性气味
d.利用金属钠能检验实验Ⅱ右侧试管中有没有乙醇
21.(12分)(本题市示范高中做),如图是某同学设计的一个简易的原电池装置,请回答下列问题。
(1)若a电极材料为碳、b溶液为溶液,则正极的电极反应式为当有1.6g负极材料溶解时,转移的电子为______。
(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→________(填电极材料,下同),溶液中的向______极移动。
(3)氢氧燃料电池已用于航天飞机。这种电池以30%溶液为电解质溶液,供电时总反应为____________,则负极的电极反应式为______________。
21.(12分)(本题省示范高中做),如图是某同学设计的一个简易的原电池装置,请回答下列问题。
(1)若a电极材料为碳、b溶液为溶液,则正极的电极反应式为当有1.6g负极材料溶解时,转移的电子为______。
(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为____→_____填电极材料,下同),溶液中的向_____极移动。
(3)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如上,则该燃料电池工作时,负极的电极反应式为________________,电池的总反应方程式为___________________。
舒城县2020-2021学年度第二学期期末质检
高一化学参考答案
温馨提示:
1.答卷前,考生务必将自己的姓名、班级、学号填写在答题卡上。
2.所有答案必须写在答题卡各题目指定区域内相应位置上。
3.考试时间:100分钟 试卷总分100分。
4.本卷部分试题分为市示范、省示范高中做,请按要求答题。
可能用到的相对原子质量H-1 C-12 N-14 O-16 -23 S-32 -27 -35.5 -56 -64
第Ⅰ卷 选择题(共48分)
一、选择题(每题只有一个选项符合题意,第15、16题为选做题,分为市或省示范高中做)
1-5:ABCDA,6-10:CDCDC,11-15:BCCCC,16.A(市)/B(省)
第Ⅱ卷 非选择题 (共52分)
二、综合解答题(第20、21题为选做题,分为市或省示范高中做)
17.(共10分,每空2分)
(1)
(2)D
(3)随着反应的进行,浓硫酸变为稀硫酸,稀硫酸不与铜反应
18.(共8分,每空2分)
(1)
(2)
(3)40%
(4)BE.
19.(10分)
(1)将废渣粉碎、提高溶解温度等 将价铁氧化为价铁(每空1分)
(2)(1分)
(3)(2分)
(4)(2分)
(5)(2分)
(6)把还原为,还可以把还原为(1分)
20.(12分,每空2分)(本题市示范高中做)
(1)葡萄糖
(2);。
(3)。
(4)
(5)
20.(12分)(本题省示范高中做)
Ⅰ.(2分)
Ⅱ.(1)②放热(1分)
③加热 冷凝(各1分)
④乙酸 蒸馏(各1分)
(2)①加热甲烧杯(1分)
②(2分)
(3)ac(2分)
21.(12分)(本题市示范高中做)
(1)(2分)
。(2分)
(2)铜(或)→铁(或)(各1分),铜(或)(2分)
(3)(2分)
(3)(2分)
21.(12分)(本题省示范高中做)
(1)(2分)
。(2分)
(2)铜(或)→铁(或)(各1分),铜(或)(2分)
(3)(2分)(2分)
高一化学试卷
温馨提示:
1.答卷前,考生务必将自己的姓名、班级、学号填写在答题卡上。
2.所有答案必须写在答题卡各题目指定区域内相应位置上。
3.考试时间:100分钟 试卷总分100分。
4.本卷部分试题分为市示范、省示范高中做,请按要求答题。
可能用到的相对原子质量H-1 C-12 N-14 O-16 -23 S-32 -27 -35.5 -56 -64
第Ⅰ卷选择题(共48分)
一、选择题(每题只有一个选项符合题意,第15、16题为选做题,分为市或省示范高中做)
1.化学与环境密切相关,下列有关说法不正确的是( )
A.属于大气污染物
B.酸雨是小于5.6的雨水
C.或都会导致酸雨的形成
D.大气中含量的增加会导致温室效应加剧
2.如图是研究二氧化硫性质的微型实验装置。现用60%硫酸和亚硫酸钠晶体反应制取气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
A.品红溶液褪色
B.紫色石蕊溶液变蓝色
C.新制氯水黄绿色褪去
D.含酚酞的溶液红色变浅或褪色
3.一氧化氮对SARS病毒的抑制作用明显。下列关于的说法正确的是( )
A.是酸性氧化物
B.只能通过人工合成
C.是大气污染物,会形成酸雨
D.可以用向下排空气法收集
4.在实验探究课上,同学们积极思考,设计出如下图所示的四种实验装置用以验证浓硫酸的吸水性,其中在理论上可行的是( )
A.②③④ B.①③④ C.①②④ D.①②③④
5.下列图示变化为吸热反应的是( )
A.B.C.D.
6.有a、b,c,d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
溶液
装置一
稀硫酸
装置二
稀硫酸
装置三
稀硫酸
装置四
部分实验现象 a质量减小,b极质量增大 b极有气体产生,c极无变化 d极溶解,c极有气体产生 电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A. B. C. D.
7.在2L的密闭容器中,投入和,发生可逆反应,后,生成,下列说法中正确的是( )
A.内的反应速率为
B.若后,往容器中通入的氩气,则生成的反应速率加快
C.若混合气体的密度不再改变,则反应达到平衡状态
D.若单位时间内有键断裂,同时就有键断裂,则反应达到平衡状态
8.下列物质反应后仅生成的是( )
A.乙烷通入溴水中
B.乙烷和少量的溴蒸气光照
C.乙烯通入溴的四氯化碳溶液中
D.乙烯和溴化氢加成
9.若将转化为,可使用的试剂是( )
A. B. C. D.
10,某有机物的结构简式为,下列关于该有机物的叙述中,不正确的是( )
A.能与金属钠发生反应并放出氢气
B.能在催化剂作用下与发生加成反应
C.不能使酸性溶液褪色
D.在铜作催化剂的条件下能发生催化氧化反应生成醛
11.糖类、脂肪、蛋白质是维持人体生命活动的三大营养物质。以下叙述正确的是( )
A.植物油不能使溴的四氯化碳溶液褪色
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应
D.蚕丝、羊毛、棉花的主要成分都是蛋白质
12.我国积极启动的“蓝天工程”和“绿水工程”是保护生态环境、提高全体人民生活质量的重要举措。下列措施不利于以上工程实施的是( )
A.推广使用燃煤脱硫技术防治污染,减少重金属、农药和难分解有机物的排放
B.实施绿色化学,即利用化学原理从源头上减少或消除工业生产对环境的污染
C.加大石油、煤炭的开采速度,增加化石燃料的供应量
D.开发新能源和新制冷剂,减少和氟氯烃等物质的大量排放
13.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝。下列说法不正确的是( )
A.①、②、③中除加试剂外,还需要进行过滤操作
B.a,b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
14.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应制备硫酸铜
D.用反应制备环氧乙烷
15.(本题市示范高中做)香菇是日常生活中常用的一种食用真菌,香菇中的烟酸的含量较高烟酸分子中六元环的结构与苯环相似。下列有关烟酸的说法错误的是( )
A.所有的碳原子均处于同一平面上
B.分子式为
C.六元环上的一氯代物有5种
D.烟酸能和氢氧化钠发生中和反应
15.(本题省示范高中做)大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质。后经研究,凡具有如方框内结构,且R不是氢原子的有机物,就可能是一种高效、低毒,对昆虫有强烈杀伤作用的杀虫剂。对此杀虫剂的下列叙述错误的是( )
A.能发生加氢反应,但其生成物无杀虫作用
B.只含有碳碳双键和酯基两种官能团
C.此类杀虫剂密封保存在碱性溶液中,其杀虫作用不变
D.左端的甲基()可被取代,其产物仍有杀虫作用
16.(本题市示范高中做)如图表示与稀硝酸反应的量的关系,a、b、c、d四点中表示铜与稀硝酸反应中被还原的与的量的关系的是( )
A.a B.b C.c D.d
16.(本题省示范高中做)足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和,的混合气体2.24L(标准状况),这些气体与一定体积的(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入溶液,则恰好完全沉淀。下列说法正确的是( )
A.此反应过程中转移的电子为
B.混合气体中含(标准状况)1.12L
C.参加反应的是
D.消耗氧气(标准状况)的体积为1.68L
第Ⅱ卷 非选择题(共52分)
二、综合解答题(第20,21题为选做题,分为市或省示范高中做)
17.(10分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验。实验中他们取64 g铜片和浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组同学认为还有一定量的硫酸剩余。
请回答下列问题:
(1)写出铜与浓硫酸反应的化学方程式:__________。实验中若有mg铜参加了反应,则有______被还原,转移电子数目为______(设为阿伏加德罗常数的值)。
(2)下列试剂能证明反应停止后烧瓶中有硫酸剩余的是______(填字母)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
(3)为什么有一定量的硫酸剩余但未能使铜片完全溶解?原因是________________。
18.(8分)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
起始物质的量浓度/ 1.5 1 0
末物质的量浓度/ 0.9 0.8 0.4
请回答下列问题。
(1)该可逆反应的化学方程式可表示为__________________。
(2)用物质B来表示0~2s的平均反应速率为_____________。
(3)从反应开始到2s末,A的转化率为_________________。
(4)下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是______(填字母)。
A.(消耗)(生成) B.容器内气体的总压强保持不变
C.容器内气体的密度不变 D.
E.容器内气体C的物质的量分数保持不变
19.(10分)工业生产硫酸的黄铁矿烧渣(主要成分为及少量的、、、、等)是工业三废之一,其综合利用是一条变废为宝的重要途径。
Ⅰ.以黄铁矿烧渣为原料制备颜料铁红()和回收的生产工艺流程如图。
请回答下列问题:
(1)能提高“废渣溶解”速率的措施有___________(写出一条即可),“氧化”的目的是一价。
(2)中的化合价是______价。
(3)该工艺流程图中,第二次加入氨水后,反应的离子方程式为_________________。
Ⅱ.下图是以黄铁矿烧渣为原料制备颜料铁红的另外一种生产工艺流程。
(4)在滤液Ⅰ中加入熟石灰,反应的化学方程式是_____________。
(5)“氧化”反应较多,其中可以看作被水溶液中的氧化,氧化后的溶液中滴加溶液有不溶于盐酸的白色沉淀生成,则水溶液中与Cl2,反应的离子方程式为___________________。
(6)试剂X为过量铁粉,其作用是_____________。
20.(12分)(本题市示范高中做)某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图所示:
已知:石油裂解已成为生产H的主要方法,E的溶液能发生银镜反应,G是具有香味的液体,试回答下列问题:
(1)B的名称为__________。
(2)D的结构简式为___________;H的电子式为______________。
(3)写出H发生加聚反应的化学方程式:_____________________。
(4)D→E的化学方程式:___________________。
(5)F→G的化学方程式:______________。
20.(12分)(本题省示范高中做)乙醇分子中的羟基在一定条件下可以被氧化为基(),为验证此性质,有关实验如下:
Ⅰ.把一端弯成螺旋状的光亮铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约乙醇的试管里,反复操作几次。变黑后的铜丝插入乙醇里,铜丝表面的现象是黑色变成红色,上述过程中发生反应的总化学方程式为____________________。
Ⅱ.某实验小组用下列装置进行乙醇催化氧化的实验。已知乙醇的沸点为78.5℃。
①加入药品后,点燃洒精灯给铜网加热,打开止水夹,鼓入空气。
②实验过程中铜网出现红色和黑色交替的现象。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是_________反应。
③甲和乙两个水浴的作用不相同。甲的作用是_________;乙的作用是_________。
④反应进行一段时间后,试管a中能收集到不同的混和物,若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有_________。要除去该物质,可在混合液中加入碳酸氢钠溶液然后,再通过________(填实验操作名称)即可。
(2)在停止鼓入空气的条件下进行实验。
①关闭止水夹,为使乙醇持续进入反应管中,需要进行的操作是_________。
②乙醇蒸气进入反应管后,在铜作催化剂及250~350℃的条件下发生可逆反应,在试管中收集到与实验1相同的产物,并有可燃性气体单质放出。该实验揭示了乙醇催化氧化的本质。写出实验Ⅱ中反应的化学方程式:_____________。
(3)该小组通过以上实验探究提出了下列问题,你认为正确的是_____(填字母)。
a.将铜丝换成铜粉,得到乙醛的时间缩短
b.乙醇催化氧化生成乙醛时,乙醇分子中只有键发生断裂
c.表面被氧化为黑色的铜丝在酒精灯上灼烧,可闻到刺激性气味
d.利用金属钠能检验实验Ⅱ右侧试管中有没有乙醇
21.(12分)(本题市示范高中做),如图是某同学设计的一个简易的原电池装置,请回答下列问题。
(1)若a电极材料为碳、b溶液为溶液,则正极的电极反应式为当有1.6g负极材料溶解时,转移的电子为______。
(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→________(填电极材料,下同),溶液中的向______极移动。
(3)氢氧燃料电池已用于航天飞机。这种电池以30%溶液为电解质溶液,供电时总反应为____________,则负极的电极反应式为______________。
21.(12分)(本题省示范高中做),如图是某同学设计的一个简易的原电池装置,请回答下列问题。
(1)若a电极材料为碳、b溶液为溶液,则正极的电极反应式为当有1.6g负极材料溶解时,转移的电子为______。
(2)若a电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为____→_____填电极材料,下同),溶液中的向_____极移动。
(3)瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如上,则该燃料电池工作时,负极的电极反应式为________________,电池的总反应方程式为___________________。
舒城县2020-2021学年度第二学期期末质检
高一化学参考答案
温馨提示:
1.答卷前,考生务必将自己的姓名、班级、学号填写在答题卡上。
2.所有答案必须写在答题卡各题目指定区域内相应位置上。
3.考试时间:100分钟 试卷总分100分。
4.本卷部分试题分为市示范、省示范高中做,请按要求答题。
可能用到的相对原子质量H-1 C-12 N-14 O-16 -23 S-32 -27 -35.5 -56 -64
第Ⅰ卷 选择题(共48分)
一、选择题(每题只有一个选项符合题意,第15、16题为选做题,分为市或省示范高中做)
1-5:ABCDA,6-10:CDCDC,11-15:BCCCC,16.A(市)/B(省)
第Ⅱ卷 非选择题 (共52分)
二、综合解答题(第20、21题为选做题,分为市或省示范高中做)
17.(共10分,每空2分)
(1)
(2)D
(3)随着反应的进行,浓硫酸变为稀硫酸,稀硫酸不与铜反应
18.(共8分,每空2分)
(1)
(2)
(3)40%
(4)BE.
19.(10分)
(1)将废渣粉碎、提高溶解温度等 将价铁氧化为价铁(每空1分)
(2)(1分)
(3)(2分)
(4)(2分)
(5)(2分)
(6)把还原为,还可以把还原为(1分)
20.(12分,每空2分)(本题市示范高中做)
(1)葡萄糖
(2);。
(3)。
(4)
(5)
20.(12分)(本题省示范高中做)
Ⅰ.(2分)
Ⅱ.(1)②放热(1分)
③加热 冷凝(各1分)
④乙酸 蒸馏(各1分)
(2)①加热甲烧杯(1分)
②(2分)
(3)ac(2分)
21.(12分)(本题市示范高中做)
(1)(2分)
。(2分)
(2)铜(或)→铁(或)(各1分),铜(或)(2分)
(3)(2分)
(3)(2分)
21.(12分)(本题省示范高中做)
(1)(2分)
。(2分)
(2)铜(或)→铁(或)(各1分),铜(或)(2分)
(3)(2分)(2分)
同课章节目录
