2021-2022学年九年级化学人教版上册3.2-原子的构成课件(45张PPT+内嵌视频)
文档属性
| 名称 | 2021-2022学年九年级化学人教版上册3.2-原子的构成课件(45张PPT+内嵌视频) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-08 16:34:30 | ||
图片预览






文档简介
第三单元 构成物质的奥秘
课题2 原子的构成
1.分子: 。
2.原子: 。
3.分子与原子的区别:
。
4.用分子和原子知识解释化学变化的实质:
。
保持物质化学性质的最小粒子
化学变化中最小的粒子
在化学变化中,分子可分,原子不可分
在化学变化中,分子分裂成原子,
原子重新组合成新的分子和物质。
知识回顾
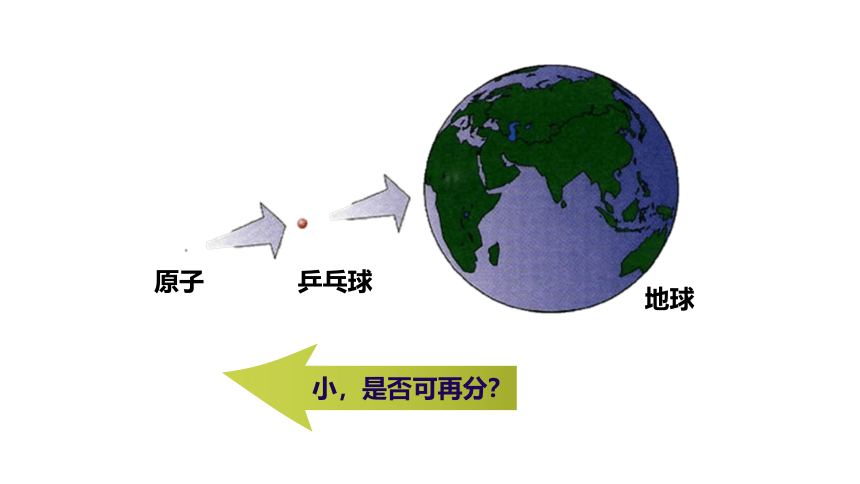
你知道原子弹吗?原子弹为什么有这么大的威力?
地球
原子
乒乓球
小,是否可再分?
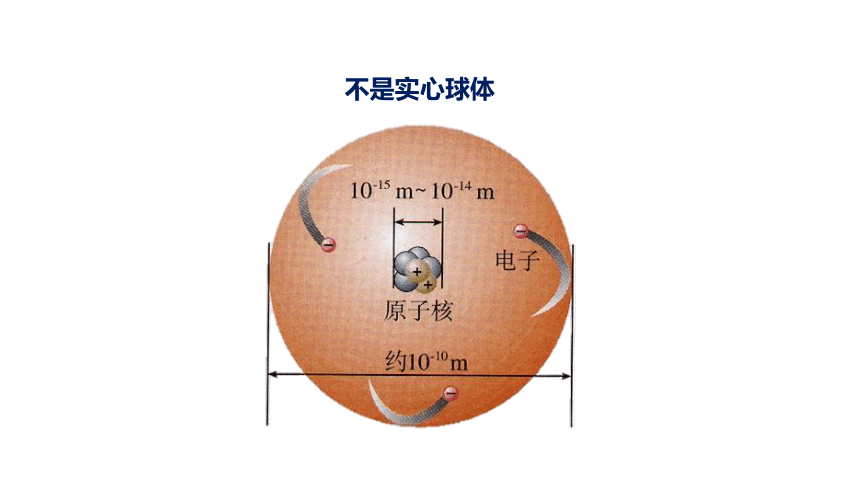
不是实心球体
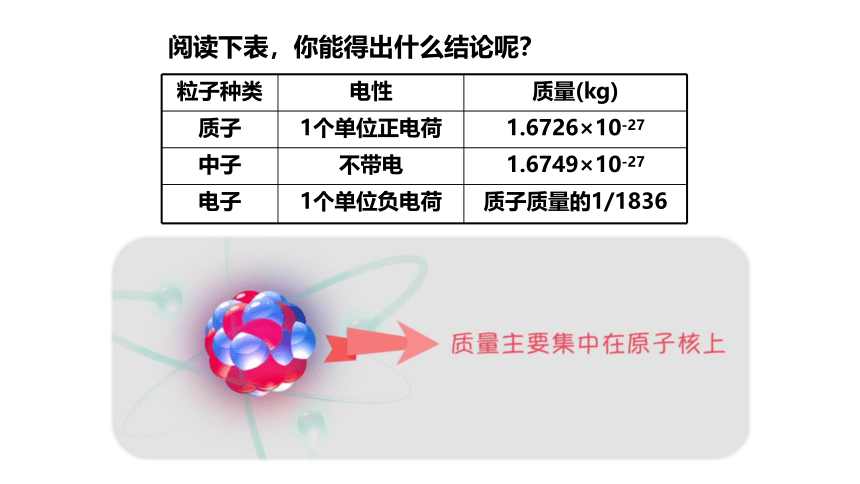
一个质子和一个电子所带的电量相等,电性相反。
一个质子和一个中子的质量约相等。
原子的质量主要集中在原子核上。
粒子种类
电性
质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷
质子质量的1/1836
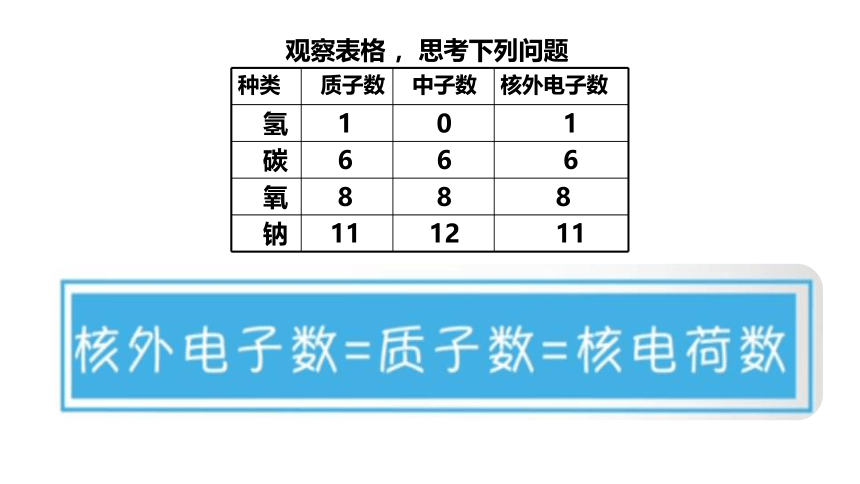
阅读下表,你能得出什么结论呢?
1
知识点
原子的构成
质子和电子的所带电荷相等,电性相反,因此原子不显电性。
思考
原子中存在着带电的粒子,
为什么整个原子不显电性?
种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
1、所有原子都是由质子、中子、电子构成的吗?
2、质子、中子、电子在数量上有什么关系?
3、不同种原子之间有哪些区别?
观察表格 ,思考下列问题
质子数=核外电子数=核电荷数=原子序数
不是所有的原子都含有中子。
质子数不一定等于中子数,不同种原子质子数不同。
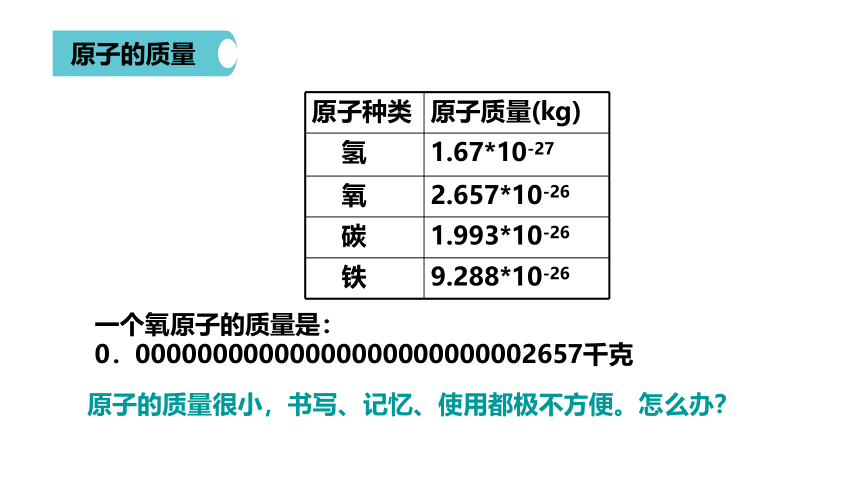
原子种类
原子质量(kg)
氢
1.67*10-27
氧
2.657*10-26
碳
1.993*10-26
铁
9.288*10-26
原子的质量很小,书写、记忆、使用都极不方便。怎么办?
一个氧原子的质量是:
0.00000000000000000000000002657千克
原子的质量
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号Ar)
(2)计算公式:
碳原子质量 × 1/12
=——————————
某原子的实际质量
相对原子质量
(1)概念:
2
知识点
相对原子质量
已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?
解:
氧原子的相对原子质量=
1.993×10-26Kg×1/12
2.657×10-26Kg
=16
答:氧原子的相对原子质量是16。
相对原子质量是个比值,不是原子的实际质量。
国际规定相对原子质量的单位是1
原子实际质量越大,它的相对原子质量数值越大。
相对原子质量与原子实际质量的关系
根据P153附录Ⅱ查得相对原子质量:
氮_______
氯________
钠_______
14.01
35.45
22.99
相对原子质量与质子数和中子数的关系:
相对原子质量=质子数+中子数
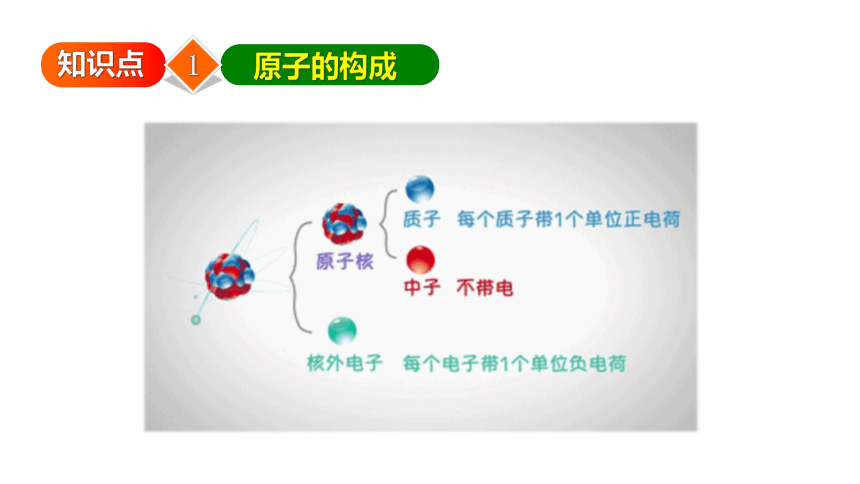
一、原子的构成
原子
原子核
核外电子
质子
中子
(+)
(不带电)
(-)
核电荷数=质子数=核外电子数=原子序数
二、相对原子质量
Ar=质子数+中子数
碳原子质量 × 1/12
=——————————
某原子的实际质量
我们都学了什么?
1 .铁原子的相对原子质量是( )
A. 56克 B. 56
C. 9.288*10-26 Kg D. 1/56
2. 组成一切原子必不可少的粒子是( )
A.质子 B. 质子 电子
C. 质子 中子 电子 D. 质子 中子
B
B
随堂检测
3.铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成.整个原子不显电性的原因是: .
13
14
13
质子和电子所带电量相等,电性相反
随堂检测
1.(2016·钦州中考)中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。已知一种鉝原子的中子数为173,下列关于该原子的说法错误的是( )
A.质子数为116 B.核电荷数为116
C.核外电子数为173 D.相对原子质量为289
广西近5年中考真题精选
C
寄语
勤学如春起之苗,不见其曾,日有所长;
辍学如磨刀之石,不见其损,日有所亏。
原子的结构:
原子
核外电子(-)
原子核(+)
质子(+)
中子
知识回顾
电子在核外做高速运动。它们会相互碰撞打架吗?电子在核外的排布会有什么特点?
原子的核外电子运动的模拟动画
氢原子的结构
(1个电子)
行星绕太阳运动
3
知识点
原子的核外电子排布
第一层
第二层
第三层
钠原子的结构(11个电子)
核外电子的排布规律
1 2 3 4 5 6 7
能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
近 远
低 高
电子层:
离 核:
能 量:
原子核
电子层
排布特点1:电子在核外是分层排布的。
排布特点2:
①每个电子层上最多容纳2n2,(n为电子层数)。
即第1层最多排2个电子,第2层最多排8个电子。
②最外层最多不超过8个电子(He为2个)。
电子总是先排在能量最低的电子层里
(即第一层排满了才排第二层,依次下去)
+11
原子结构示意图
电子层
原子核
质子数
各电子层上的电子数
最外层电子数
2 8 1
第一层
第二层
第三层(最外层)
硫 S
氟
F
+16
2
8
6
+12
2 8 2
镁
Mg
+9
2 7
氯
Cl
+17
2 8 7
写出下列元素的符号,画出其原子结构示意图。
硫(16 ) 镁(12) 氯(17) 氟(9)
+1
1
氢原子
硼原子 碳原子 氮原子 氧原子 氟原子
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅原子 磷原子 硫原子 氯原子
2
2
+3
1
2
+4
2
锂原子 铍原子
钠原子 镁原子 铝原子
8
+11
1
8
+12
2
8
+13
3
2
2
2
+2
2
氦原子
氖原子
2
+10
8
8
+18
8
氩原子
1-18号元素的原子结构示意图
【思考】分析下列原子核外电子排布有什么特点?
非金属原子: 最外层电子数≥4个,易得到电子
稀有气体: 最外层电子数=8个(He为2个)
是稳定结构
金属原子: 最外层电子数<4个,易失去电子
最外层电子数决定了元素的化学性质
1.电子在核外是分层排布的
2. 原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个
3.元素化学性质与原子最外层电子数相关
我们都学了什么?
由于金属元素、非金属元素的原子核外最外层没有达到稳定结构,在化学反应中容易得失电子,从而达到稳定结构,那么,得失电子的结果怎样呢?
形成离子
钠+氯气 氯化钠
点燃
4
知识点
离子的形成
2
1
8
+11
2
8
8
+17
2
8
+11
2
7
8
+17
失去e-
Na
Cl
Na+
Cl-
NaCl
阳离子
阴离子
氯化钠的形成
氯化钠由________________构成.
氯离子和钠离子
得到e-
最外层电子数决定了元素的化学性质
1.在下列空格里,用“分子、原子或离子”填空:
(1)保持氧气化学性质最小的粒子是氧 ;
(2)氯化钠是由 构成 ;
(3)铁是由铁 构成 ;
2.构成物质的微粒种类由 、 、 。分别指出构成下列物质的微粒的具体名称:
铁由 构成,氧气由 构成,
氯化钠由 构成。
随堂检测
分子
离子
原子
分子 原子 离子
铁原子
氧分子
钠离子和氯离子
离子与原子的区别和联系
原子
离子
结构
阳离子
阴离子
电性
联系
失电子 得电子
阳离子 原子 阴离子
质子数=电子数
质子数>电子数
质子数<电子数
不带电
带正电
带负电
离子:带电荷的原子(或原子团)
离子所带电荷数由原子的最外层电子数决定
阳离子:带正电荷的原子,如Na+ 、Ca2+
阴离子:带负电荷的原子 , 如Cl-、SO42-
离子的概念
离子的分类
离子的形成
在化学变化中,原子得失电子
有以下五种微粒结构示意图:
A. B. C. D.
其中表示原子的是 ,
表示阳离子的是 ,
表示阴离子的是 ,
属于同一种元素的是 (用序号表示)。
AD
B
C
BD
随堂检测
离子的表示方法
离子符号
离子结构示意图
离子符号:
Mg2+
+12
2
8
离子符号的意义
Mg2+
表示2个镁离子
表示一个镁离子带2个单位的正电荷
一个镁离子
2
说出下列符号中数值“2”的含义。
2H _____________________________
Ca2+ _____________________________
2Cl- _____________________________
2CO32- ___________________________
_________________________________
2个氢原子
一个钙离子带2个单位的正电荷
2个氯离子
2个碳酸根离子;
每个碳酸根离子带2个单位的负电荷
随堂检测
1.在①分子、②原子、③质子、④中子、⑤电子、⑥离子这些微粒中:
(1)能构成物质的微粒有 ;
(2)显电中性等等微粒有 ;
(3)质量最小的微粒是 ;
(4)一定带正电的微粒是 ;
(5)一定带负电的微粒是 ;
(6)可能正电也可能带负电的微粒是 ;
①②⑥
随堂检测
①②③
⑤
③
⑤
⑥
1.(2014·南宁)下列化学符号中,表示2个氢分子的是( )
A.H2 B.2H C.2H2 D.2H+
广西近5年中考真题精选
2.(2015·南宁中考)某粒子结构示意图如图所示,下列说法错误的是 ( )
A.该粒子是阴离子
B.该粒子达到相对稳定的结构
C.该粒子属于金属元素
D.该粒子原子核内有16个质子
C
C
4.(2018.北部湾四市同城)下列粒子结构示意图,表示阴离子的是( )
3.(2017·北部湾四市同城)下列微观粒子的结构示意图中,表示阳离子的是( )
B
D
5. (2019.北部湾四市同城)下列粒子可以通过得到电子变成原子的是( )
A.F B.S2- C. D.
6. (2019.北部湾四市同城)“宏观辨识与微观辨析”是化学的核心素养之一。
(1)构成物质的粒子有分子、原子和______。能保持氧气化学性质的最小粒子是______。
(2)人们常用模型来进行认知,如图是
碳在氧气中充分燃烧的微观模拟图,
请在图B方框中画出相应的粒子图形。
D
离子
分子
我们都学了什么?
1、原子核外电子的排布
——原子结构示意图
2、元素的化学性质与最外层电子数的关系
3、离子形成、书写、意义
课题2 原子的构成
1.分子: 。
2.原子: 。
3.分子与原子的区别:
。
4.用分子和原子知识解释化学变化的实质:
。
保持物质化学性质的最小粒子
化学变化中最小的粒子
在化学变化中,分子可分,原子不可分
在化学变化中,分子分裂成原子,
原子重新组合成新的分子和物质。
知识回顾
你知道原子弹吗?原子弹为什么有这么大的威力?
地球
原子
乒乓球
小,是否可再分?
不是实心球体
一个质子和一个电子所带的电量相等,电性相反。
一个质子和一个中子的质量约相等。
原子的质量主要集中在原子核上。
粒子种类
电性
质量(kg)
质子
1个单位正电荷
1.6726×10-27
中子
不带电
1.6749×10-27
电子
1个单位负电荷
质子质量的1/1836
阅读下表,你能得出什么结论呢?
1
知识点
原子的构成
质子和电子的所带电荷相等,电性相反,因此原子不显电性。
思考
原子中存在着带电的粒子,
为什么整个原子不显电性?
种类
质子数
中子数
核外电子数
氢
1
0
1
碳
6
6
6
氧
8
8
8
钠
11
12
11
1、所有原子都是由质子、中子、电子构成的吗?
2、质子、中子、电子在数量上有什么关系?
3、不同种原子之间有哪些区别?
观察表格 ,思考下列问题
质子数=核外电子数=核电荷数=原子序数
不是所有的原子都含有中子。
质子数不一定等于中子数,不同种原子质子数不同。
原子种类
原子质量(kg)
氢
1.67*10-27
氧
2.657*10-26
碳
1.993*10-26
铁
9.288*10-26
原子的质量很小,书写、记忆、使用都极不方便。怎么办?
一个氧原子的质量是:
0.00000000000000000000000002657千克
原子的质量
以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量(符号Ar)
(2)计算公式:
碳原子质量 × 1/12
=——————————
某原子的实际质量
相对原子质量
(1)概念:
2
知识点
相对原子质量
已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg,求氧原子的相对原子质量?
解:
氧原子的相对原子质量=
1.993×10-26Kg×1/12
2.657×10-26Kg
=16
答:氧原子的相对原子质量是16。
相对原子质量是个比值,不是原子的实际质量。
国际规定相对原子质量的单位是1
原子实际质量越大,它的相对原子质量数值越大。
相对原子质量与原子实际质量的关系
根据P153附录Ⅱ查得相对原子质量:
氮_______
氯________
钠_______
14.01
35.45
22.99
相对原子质量与质子数和中子数的关系:
相对原子质量=质子数+中子数
一、原子的构成
原子
原子核
核外电子
质子
中子
(+)
(不带电)
(-)
核电荷数=质子数=核外电子数=原子序数
二、相对原子质量
Ar=质子数+中子数
碳原子质量 × 1/12
=——————————
某原子的实际质量
我们都学了什么?
1 .铁原子的相对原子质量是( )
A. 56克 B. 56
C. 9.288*10-26 Kg D. 1/56
2. 组成一切原子必不可少的粒子是( )
A.质子 B. 质子 电子
C. 质子 中子 电子 D. 质子 中子
B
B
随堂检测
3.铝原子的相对原子质量为27,核电荷数为13,则铝原子由( )个质子和( )个中子构成一个原子核,核外有( )个电子作高速运动而构成.整个原子不显电性的原因是: .
13
14
13
质子和电子所带电量相等,电性相反
随堂检测
1.(2016·钦州中考)中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。已知一种鉝原子的中子数为173,下列关于该原子的说法错误的是( )
A.质子数为116 B.核电荷数为116
C.核外电子数为173 D.相对原子质量为289
广西近5年中考真题精选
C
寄语
勤学如春起之苗,不见其曾,日有所长;
辍学如磨刀之石,不见其损,日有所亏。
原子的结构:
原子
核外电子(-)
原子核(+)
质子(+)
中子
知识回顾
电子在核外做高速运动。它们会相互碰撞打架吗?电子在核外的排布会有什么特点?
原子的核外电子运动的模拟动画
氢原子的结构
(1个电子)
行星绕太阳运动
3
知识点
原子的核外电子排布
第一层
第二层
第三层
钠原子的结构(11个电子)
核外电子的排布规律
1 2 3 4 5 6 7
能量低的在离核近的区域运动,
能量高的在离核远的区域运动。
近 远
低 高
电子层:
离 核:
能 量:
原子核
电子层
排布特点1:电子在核外是分层排布的。
排布特点2:
①每个电子层上最多容纳2n2,(n为电子层数)。
即第1层最多排2个电子,第2层最多排8个电子。
②最外层最多不超过8个电子(He为2个)。
电子总是先排在能量最低的电子层里
(即第一层排满了才排第二层,依次下去)
+11
原子结构示意图
电子层
原子核
质子数
各电子层上的电子数
最外层电子数
2 8 1
第一层
第二层
第三层(最外层)
硫 S
氟
F
+16
2
8
6
+12
2 8 2
镁
Mg
+9
2 7
氯
Cl
+17
2 8 7
写出下列元素的符号,画出其原子结构示意图。
硫(16 ) 镁(12) 氯(17) 氟(9)
+1
1
氢原子
硼原子 碳原子 氮原子 氧原子 氟原子
2
+5
3
2
+6
4
2
+7
5
2
+8
6
2
+9
7
8
+14
4
8
+15
5
8
+16
6
8
+17
7
2
2
2
2
硅原子 磷原子 硫原子 氯原子
2
2
+3
1
2
+4
2
锂原子 铍原子
钠原子 镁原子 铝原子
8
+11
1
8
+12
2
8
+13
3
2
2
2
+2
2
氦原子
氖原子
2
+10
8
8
+18
8
氩原子
1-18号元素的原子结构示意图
【思考】分析下列原子核外电子排布有什么特点?
非金属原子: 最外层电子数≥4个,易得到电子
稀有气体: 最外层电子数=8个(He为2个)
是稳定结构
金属原子: 最外层电子数<4个,易失去电子
最外层电子数决定了元素的化学性质
1.电子在核外是分层排布的
2. 原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个
3.元素化学性质与原子最外层电子数相关
我们都学了什么?
由于金属元素、非金属元素的原子核外最外层没有达到稳定结构,在化学反应中容易得失电子,从而达到稳定结构,那么,得失电子的结果怎样呢?
形成离子
钠+氯气 氯化钠
点燃
4
知识点
离子的形成
2
1
8
+11
2
8
8
+17
2
8
+11
2
7
8
+17
失去e-
Na
Cl
Na+
Cl-
NaCl
阳离子
阴离子
氯化钠的形成
氯化钠由________________构成.
氯离子和钠离子
得到e-
最外层电子数决定了元素的化学性质
1.在下列空格里,用“分子、原子或离子”填空:
(1)保持氧气化学性质最小的粒子是氧 ;
(2)氯化钠是由 构成 ;
(3)铁是由铁 构成 ;
2.构成物质的微粒种类由 、 、 。分别指出构成下列物质的微粒的具体名称:
铁由 构成,氧气由 构成,
氯化钠由 构成。
随堂检测
分子
离子
原子
分子 原子 离子
铁原子
氧分子
钠离子和氯离子
离子与原子的区别和联系
原子
离子
结构
阳离子
阴离子
电性
联系
失电子 得电子
阳离子 原子 阴离子
质子数=电子数
质子数>电子数
质子数<电子数
不带电
带正电
带负电
离子:带电荷的原子(或原子团)
离子所带电荷数由原子的最外层电子数决定
阳离子:带正电荷的原子,如Na+ 、Ca2+
阴离子:带负电荷的原子 , 如Cl-、SO42-
离子的概念
离子的分类
离子的形成
在化学变化中,原子得失电子
有以下五种微粒结构示意图:
A. B. C. D.
其中表示原子的是 ,
表示阳离子的是 ,
表示阴离子的是 ,
属于同一种元素的是 (用序号表示)。
AD
B
C
BD
随堂检测
离子的表示方法
离子符号
离子结构示意图
离子符号:
Mg2+
+12
2
8
离子符号的意义
Mg2+
表示2个镁离子
表示一个镁离子带2个单位的正电荷
一个镁离子
2
说出下列符号中数值“2”的含义。
2H _____________________________
Ca2+ _____________________________
2Cl- _____________________________
2CO32- ___________________________
_________________________________
2个氢原子
一个钙离子带2个单位的正电荷
2个氯离子
2个碳酸根离子;
每个碳酸根离子带2个单位的负电荷
随堂检测
1.在①分子、②原子、③质子、④中子、⑤电子、⑥离子这些微粒中:
(1)能构成物质的微粒有 ;
(2)显电中性等等微粒有 ;
(3)质量最小的微粒是 ;
(4)一定带正电的微粒是 ;
(5)一定带负电的微粒是 ;
(6)可能正电也可能带负电的微粒是 ;
①②⑥
随堂检测
①②③
⑤
③
⑤
⑥
1.(2014·南宁)下列化学符号中,表示2个氢分子的是( )
A.H2 B.2H C.2H2 D.2H+
广西近5年中考真题精选
2.(2015·南宁中考)某粒子结构示意图如图所示,下列说法错误的是 ( )
A.该粒子是阴离子
B.该粒子达到相对稳定的结构
C.该粒子属于金属元素
D.该粒子原子核内有16个质子
C
C
4.(2018.北部湾四市同城)下列粒子结构示意图,表示阴离子的是( )
3.(2017·北部湾四市同城)下列微观粒子的结构示意图中,表示阳离子的是( )
B
D
5. (2019.北部湾四市同城)下列粒子可以通过得到电子变成原子的是( )
A.F B.S2- C. D.
6. (2019.北部湾四市同城)“宏观辨识与微观辨析”是化学的核心素养之一。
(1)构成物质的粒子有分子、原子和______。能保持氧气化学性质的最小粒子是______。
(2)人们常用模型来进行认知,如图是
碳在氧气中充分燃烧的微观模拟图,
请在图B方框中画出相应的粒子图形。
D
离子
分子
我们都学了什么?
1、原子核外电子的排布
——原子结构示意图
2、元素的化学性质与最外层电子数的关系
3、离子形成、书写、意义
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
