1.6 几种重要的盐 第1课时 课件(共19张PPT)
文档属性
| 名称 | 1.6 几种重要的盐 第1课时 课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-07-08 00:00:00 | ||
图片预览






文档简介
1.6 几种重要的盐
(第一课时)
练一练
写出下列反应的化学方程式
NaOH + HCl =
Cu(OH)2+H2SO4=
2KOH+H2CO3 =
Ca(OH)2+2HNO3=
NaCl +H2O
CuSO4 +H2O
K2CO3 +2H2O
Ca(NO3)2 +2H2O
盐是酸与碱反应的产物
NaOH 与 HCl Cu(OH)2 与 H2SO4
KOH 与 H2CO3 Ca(OH)2 与 HNO3
碱
酸
盐
水
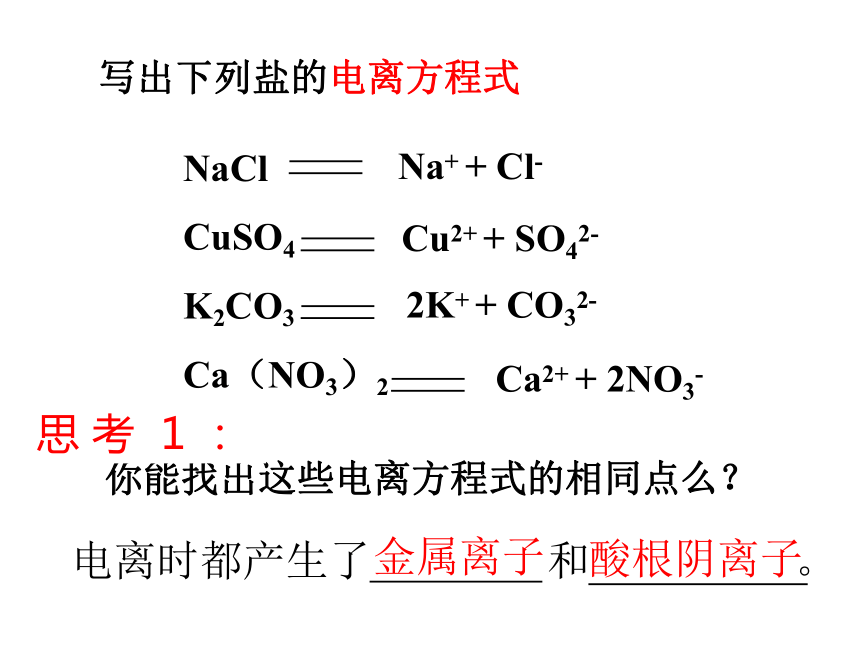
写出下列盐的电离方程式
NaCl
CuSO4
K2CO3
Ca(NO3)2
Na+ + Cl-
Cu2+ + SO42-
2K+ + CO32-
Ca2+ + 2NO3-
你能找出这些电离方程式的相同点么?
电离时都产生了 和 。
金属离子
酸根阴离子
思 考 1 :
盐一定能电离出金属离子和酸根阴离子吗?
盐是能够电离出金属离子或铵根离子和酸根阴离子的化合物。
NH4Cl是盐吗?它能电离出什么离子?
盐是能够电离出金属离子和酸根阴离子的化合物
判断下列说法是否正确,若错误,请说明理由
A.只能电离出金属阳离子和酸根阴离子的化合物叫盐
B.能电离出金属阳离子和酸根阴离子的化合物叫盐
C.盐是组成上一定有金属元素
D.电解质电离时,能产生H+的化合物是酸
E.盐一定没有氢元素
√
×
×
×
×
NaHSO4属于哪一类别?
请书写其电离方程式。
NaHSO4 Na+ +H++SO42-
思 考 2:
硫酸氢钠电离出了H+,属于酸吗?
酸:电离时产生的阳离子只有H+的化合物
碱:电离时产生的阴离子只有OH-的化合物
盐:电离时能产生金属离子或铵根离子和酸根阴离子的化合物
概念辨析
俗称
食盐
纯碱\苏打
烧碱\火碱
双氧水
盐酸
化学式
分类
俗称
熟石灰
大理石
胆矾\蓝矾
小苏打
生石灰
化学式
分类
NaCl
NaOH
H2O2
HCl
Ca(OH)2
CaCO3
CuSO4·5H2O
NaHCO3
CaO
盐
碱
氧化物
碱
盐
盐
盐
氧化物
写出下列物质的化学式,并指出它们各属于哪一类?
盐
酸
Na2CO3
你能写出几种制备NaCl的方法?
制备盐的方法
酸+碱
酸+活泼金属
酸+金属氧化物
酸+部分盐
碱溶液+部分盐溶液
碱溶液+非金属氧化物
思 考 3:
食盐是盐,盐就是食盐。你认为是否正确?请说明理由。
食盐是盐,是正确的。因为食盐是由Na+ 和Cl- 组成的化合物。
盐就是食盐,这种说法是错误的。因为盐是由金属离子(或铵根离子)和酸根离子组成的一类化合物。例如:Na2CO3、KCl等都是盐。
思 考 4:
盐的分类
根据盐中的阴、阳离子不同将盐分类:
根据阳离子不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。
根据阴离子不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等
常见的盐:
Na Cl
Na2SO4
Fe Cl3
Ca CO3
Na2 CO3
Ag Cl
Ag NO3
Ba CO3
Cu SO4
Ba Cl2
BaSO4
Cu Cl2
NH4 Cl
FeSO4
Cu(NO3)2
Na NO3
盐酸盐
硫酸盐
硝酸盐
碳酸盐
NH4 NO3
CaSO4
根据酸根命名
常见的盐:
NaCl
Na2SO4
CaCO3
Na2 CO3
AgCl
AgNO3
BaCO3
CuSO4
BaCl2
BaSO4
CuCl2
NH4Cl
Cu(NO3)2
NaNO3
NH4NO3
CaSO4
钠盐:
铜盐:
钡盐:
铵盐:
银盐:
钙盐:
根据阳离子命名
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
不
Ag+
——
溶
不
微
不
酸、碱、盐的溶解性(20℃)
KMnO4
CuSO4 ·5H2O
Cu2(OH)2CO3
K2Cr2O7
明矾
硝酸钾
盐晶体有各种颜色,还有规则的几何外形。
2.盐的水溶液的颜色
Cu2+ —— 蓝色
Fe3+——黄色
Fe2+——浅绿色
MnO4-——紫红色
其它——无色
1.固体的颜色
KMnO4
CuSO4·5H2O
Cu2(OH)2CO3
其它为白色
盐(固体)及盐溶液的颜色
练习:写出下列物质颜色
Cu CuO Fe
Fe2O3 Cu(OH)2 Fe(OH)3
CuSO4粉末 CuSO4溶液 FeCl2溶液
FeCl3溶液 CaCO3 Mg(OH)2
Al(OH)3 AgCl BaSO4
BaCO3
盐溶液都是中性的吗?
酸 性
NaHSO4
FeCl3
NH4NO3
......
中 性
NaCl
KNO3
CaCl2
......
碱 性
Na2CO3
NaHCO3
K2CO3
......
思 考 5:
(第一课时)
练一练
写出下列反应的化学方程式
NaOH + HCl =
Cu(OH)2+H2SO4=
2KOH+H2CO3 =
Ca(OH)2+2HNO3=
NaCl +H2O
CuSO4 +H2O
K2CO3 +2H2O
Ca(NO3)2 +2H2O
盐是酸与碱反应的产物
NaOH 与 HCl Cu(OH)2 与 H2SO4
KOH 与 H2CO3 Ca(OH)2 与 HNO3
碱
酸
盐
水
写出下列盐的电离方程式
NaCl
CuSO4
K2CO3
Ca(NO3)2
Na+ + Cl-
Cu2+ + SO42-
2K+ + CO32-
Ca2+ + 2NO3-
你能找出这些电离方程式的相同点么?
电离时都产生了 和 。
金属离子
酸根阴离子
思 考 1 :
盐一定能电离出金属离子和酸根阴离子吗?
盐是能够电离出金属离子或铵根离子和酸根阴离子的化合物。
NH4Cl是盐吗?它能电离出什么离子?
盐是能够电离出金属离子和酸根阴离子的化合物
判断下列说法是否正确,若错误,请说明理由
A.只能电离出金属阳离子和酸根阴离子的化合物叫盐
B.能电离出金属阳离子和酸根阴离子的化合物叫盐
C.盐是组成上一定有金属元素
D.电解质电离时,能产生H+的化合物是酸
E.盐一定没有氢元素
√
×
×
×
×
NaHSO4属于哪一类别?
请书写其电离方程式。
NaHSO4 Na+ +H++SO42-
思 考 2:
硫酸氢钠电离出了H+,属于酸吗?
酸:电离时产生的阳离子只有H+的化合物
碱:电离时产生的阴离子只有OH-的化合物
盐:电离时能产生金属离子或铵根离子和酸根阴离子的化合物
概念辨析
俗称
食盐
纯碱\苏打
烧碱\火碱
双氧水
盐酸
化学式
分类
俗称
熟石灰
大理石
胆矾\蓝矾
小苏打
生石灰
化学式
分类
NaCl
NaOH
H2O2
HCl
Ca(OH)2
CaCO3
CuSO4·5H2O
NaHCO3
CaO
盐
碱
氧化物
碱
盐
盐
盐
氧化物
写出下列物质的化学式,并指出它们各属于哪一类?
盐
酸
Na2CO3
你能写出几种制备NaCl的方法?
制备盐的方法
酸+碱
酸+活泼金属
酸+金属氧化物
酸+部分盐
碱溶液+部分盐溶液
碱溶液+非金属氧化物
思 考 3:
食盐是盐,盐就是食盐。你认为是否正确?请说明理由。
食盐是盐,是正确的。因为食盐是由Na+ 和Cl- 组成的化合物。
盐就是食盐,这种说法是错误的。因为盐是由金属离子(或铵根离子)和酸根离子组成的一类化合物。例如:Na2CO3、KCl等都是盐。
思 考 4:
盐的分类
根据盐中的阴、阳离子不同将盐分类:
根据阳离子不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。
根据阴离子不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等
常见的盐:
Na Cl
Na2SO4
Fe Cl3
Ca CO3
Na2 CO3
Ag Cl
Ag NO3
Ba CO3
Cu SO4
Ba Cl2
BaSO4
Cu Cl2
NH4 Cl
FeSO4
Cu(NO3)2
Na NO3
盐酸盐
硫酸盐
硝酸盐
碳酸盐
NH4 NO3
CaSO4
根据酸根命名
常见的盐:
NaCl
Na2SO4
CaCO3
Na2 CO3
AgCl
AgNO3
BaCO3
CuSO4
BaCl2
BaSO4
CuCl2
NH4Cl
Cu(NO3)2
NaNO3
NH4NO3
CaSO4
钠盐:
铜盐:
钡盐:
铵盐:
银盐:
钙盐:
根据阳离子命名
OH-
NO3-
Cl-
SO42-
CO32-
H+
溶、挥
溶、挥
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Na+
溶
溶
溶
溶
溶
Ba2+
溶
溶
溶
不
不
Ca2+
微
溶
溶
微
不
Mg2+
不
溶
溶
溶
微
Al3+
不
溶
溶
溶
——
Mn2+
不
溶
溶
溶
不
Zn2+
不
溶
溶
溶
不
Fe2+
不
溶
溶
溶
不
Fe3+
不
溶
溶
溶
——
Cu2+
不
溶
溶
溶
不
Ag+
——
溶
不
微
不
酸、碱、盐的溶解性(20℃)
KMnO4
CuSO4 ·5H2O
Cu2(OH)2CO3
K2Cr2O7
明矾
硝酸钾
盐晶体有各种颜色,还有规则的几何外形。
2.盐的水溶液的颜色
Cu2+ —— 蓝色
Fe3+——黄色
Fe2+——浅绿色
MnO4-——紫红色
其它——无色
1.固体的颜色
KMnO4
CuSO4·5H2O
Cu2(OH)2CO3
其它为白色
盐(固体)及盐溶液的颜色
练习:写出下列物质颜色
Cu CuO Fe
Fe2O3 Cu(OH)2 Fe(OH)3
CuSO4粉末 CuSO4溶液 FeCl2溶液
FeCl3溶液 CaCO3 Mg(OH)2
Al(OH)3 AgCl BaSO4
BaCO3
盐溶液都是中性的吗?
酸 性
NaHSO4
FeCl3
NH4NO3
......
中 性
NaCl
KNO3
CaCl2
......
碱 性
Na2CO3
NaHCO3
K2CO3
......
思 考 5:
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
