人教版化学九下同步精讲课件 9.2.2溶解度(17张ppt)
文档属性
| 名称 | 人教版化学九下同步精讲课件 9.2.2溶解度(17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 700.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-08 00:00:00 | ||
图片预览






文档简介
溶解度
氯化钠和硝酸钾都可以溶解于水,谁的溶解性更强呢?
一、激趣导入
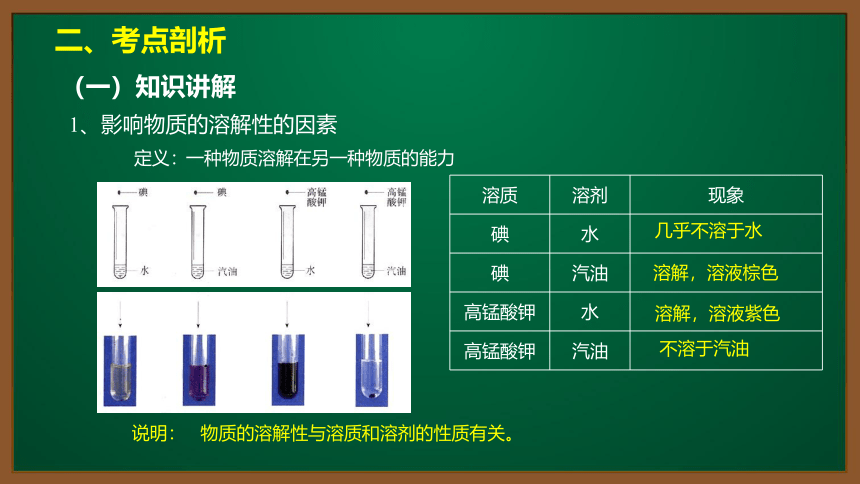
溶质
溶剂
现象
碘
水
碘
汽油
高锰酸钾
水
高锰酸钾
汽油
二、考点剖析
(一)知识讲解
1、影响物质的溶解性的因素
物质的溶解性与溶质和溶剂的性质有关。
说明:
定义:
一种物质溶解在另一种物质的能力
几乎不溶于水
溶解,溶液棕色
溶解,溶液紫色
不溶于汽油
二、考点剖析
(一)知识讲解
加热硝酸钾未完全溶解的饱和溶液,
一段时间后,固体完全消失
物质的溶解性与温度有关。
说明:
1、影响物质的溶解性的因素
二、考点剖析
(一)知识讲解
2、溶解度
——定量表示物质溶解能力大小
思考:食盐和硝酸钾都可以溶解在水中,那么,到底谁溶得更多呢?
溶解度:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
说明:通常所说的溶解度是指物质在水里的溶解度。
比较的标准
相同温度
相同量的水
比较溶解物质的最大值
按质量
二、考点剖析
(一)知识讲解
四大要素:①一定温度
②100g溶剂
③饱和状态
④指的是溶质的质量(单位:g)
如:在20℃时,100g水中溶解36g氯化钠达到饱和,我们就说20℃时,氯化钠的溶解度是36g。
在60℃时,硝酸钾的溶解度是110g,说明在60℃时,100g水里最多能溶解110g硝酸钾。
溶解度的定义:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
2、溶解度
二、考点剖析
(一)知识讲解
3、溶解度与溶解性的关系
溶解性
易溶
可溶
微溶
难溶
溶解度/g (20℃)
>10g
1g-10g
1g-0.01g
<0.01g
二、考点剖析
(一)知识讲解
4、溶解度的表示方法
1)列表法
2)曲线法
温度范围比较宽
直观形象
曲线上查得的溶解度会有误差 。
数据准确,
无法表示任意温度下的溶解度,有一定的局限性。
二、考点剖析
(一)知识讲解
5、溶解度曲线
以温度为横坐标,
溶解度为纵坐标,
描绘出的物质的溶解度随温度变化情况的曲线。
A
1)曲线表示某物质在不同温度下的溶解度不同及溶解度随温度的变化情况。
2)曲线上的点表示溶质在该温度下的溶解度。
此时的溶液为饱和溶液。
3)曲线上方的点表示加入溶质后形成饱和溶液,并有固体剩余。
曲线下方的点表示形成不饱和溶液。
二、考点剖析
(一)知识讲解
5、溶解度曲线
意义:
4)曲线的交点表示这两种物质在该温度下的溶解度相同
5)曲线越陡,该物质的溶解度受温度影响越大
二、考点剖析
(一)知识讲解
5、溶解度曲线
Cl
二、考点剖析
(一)知识讲解
5、溶解度曲线
大多数固体物质的溶解度随温度的升高而增大,如KNO3。
少数固体物质的溶解度随温度的升 高变化不大 ,如NaCl。
极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2 。
在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。
气体的溶解度随温度的升高而减小(随温度的降低而增大);
随压强的增大而增大(随压强的减小而减小)。
二、考点剖析
(一)知识讲解
6、气体的溶解度
对“20℃时,硝酸钾溶解度为31.6g”这句话解释正确的是( )
A.20℃时,100g硝酸钾溶液中含有31.6g硝酸钾
B.在100g水中溶解31.6g硝酸钾就达到饱和状态
C.20℃时,100g水中最多能溶解31.6g硝酸钾
D.20℃时,溶解31.6g硝酸钾最多需要100g水
C
二、考点剖析
(二) 典例分析
二、考点剖析
(三) 技巧点拨
1、牢记溶解度的概念和要素。
2、理解溶解度曲线的意义。
溶解度
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度
②100克溶剂
③溶液饱和
④单位是g
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
列表法
曲线法
定义
三、归纳小结
谢谢观看
氯化钠和硝酸钾都可以溶解于水,谁的溶解性更强呢?
一、激趣导入
溶质
溶剂
现象
碘
水
碘
汽油
高锰酸钾
水
高锰酸钾
汽油
二、考点剖析
(一)知识讲解
1、影响物质的溶解性的因素
物质的溶解性与溶质和溶剂的性质有关。
说明:
定义:
一种物质溶解在另一种物质的能力
几乎不溶于水
溶解,溶液棕色
溶解,溶液紫色
不溶于汽油
二、考点剖析
(一)知识讲解
加热硝酸钾未完全溶解的饱和溶液,
一段时间后,固体完全消失
物质的溶解性与温度有关。
说明:
1、影响物质的溶解性的因素
二、考点剖析
(一)知识讲解
2、溶解度
——定量表示物质溶解能力大小
思考:食盐和硝酸钾都可以溶解在水中,那么,到底谁溶得更多呢?
溶解度:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
说明:通常所说的溶解度是指物质在水里的溶解度。
比较的标准
相同温度
相同量的水
比较溶解物质的最大值
按质量
二、考点剖析
(一)知识讲解
四大要素:①一定温度
②100g溶剂
③饱和状态
④指的是溶质的质量(单位:g)
如:在20℃时,100g水中溶解36g氯化钠达到饱和,我们就说20℃时,氯化钠的溶解度是36g。
在60℃时,硝酸钾的溶解度是110g,说明在60℃时,100g水里最多能溶解110g硝酸钾。
溶解度的定义:在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量。
2、溶解度
二、考点剖析
(一)知识讲解
3、溶解度与溶解性的关系
溶解性
易溶
可溶
微溶
难溶
溶解度/g (20℃)
>10g
1g-10g
1g-0.01g
<0.01g
二、考点剖析
(一)知识讲解
4、溶解度的表示方法
1)列表法
2)曲线法
温度范围比较宽
直观形象
曲线上查得的溶解度会有误差 。
数据准确,
无法表示任意温度下的溶解度,有一定的局限性。
二、考点剖析
(一)知识讲解
5、溶解度曲线
以温度为横坐标,
溶解度为纵坐标,
描绘出的物质的溶解度随温度变化情况的曲线。
A
1)曲线表示某物质在不同温度下的溶解度不同及溶解度随温度的变化情况。
2)曲线上的点表示溶质在该温度下的溶解度。
此时的溶液为饱和溶液。
3)曲线上方的点表示加入溶质后形成饱和溶液,并有固体剩余。
曲线下方的点表示形成不饱和溶液。
二、考点剖析
(一)知识讲解
5、溶解度曲线
意义:
4)曲线的交点表示这两种物质在该温度下的溶解度相同
5)曲线越陡,该物质的溶解度受温度影响越大
二、考点剖析
(一)知识讲解
5、溶解度曲线
Cl
二、考点剖析
(一)知识讲解
5、溶解度曲线
大多数固体物质的溶解度随温度的升高而增大,如KNO3。
少数固体物质的溶解度随温度的升 高变化不大 ,如NaCl。
极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2 。
在压强为101kPa和一定温度时,气体溶解在1体积水里达饱和状态时的气体体积。
气体的溶解度随温度的升高而减小(随温度的降低而增大);
随压强的增大而增大(随压强的减小而减小)。
二、考点剖析
(一)知识讲解
6、气体的溶解度
对“20℃时,硝酸钾溶解度为31.6g”这句话解释正确的是( )
A.20℃时,100g硝酸钾溶液中含有31.6g硝酸钾
B.在100g水中溶解31.6g硝酸钾就达到饱和状态
C.20℃时,100g水中最多能溶解31.6g硝酸钾
D.20℃时,溶解31.6g硝酸钾最多需要100g水
C
二、考点剖析
(二) 典例分析
二、考点剖析
(三) 技巧点拨
1、牢记溶解度的概念和要素。
2、理解溶解度曲线的意义。
溶解度
同种溶质在不同的溶 剂中的溶解能力不同
不同的溶质在同种溶 剂中的溶解能力不同
溶解性
物质的溶解度
定量描述
①一定温度
②100克溶剂
③溶液饱和
④单位是g
易溶 、可溶 、 微溶 、 难(不)溶
固体的溶解度
气体的溶解度
影响因素(温度)
影响因素 (温度、压强)
表示方法
列表法
曲线法
定义
三、归纳小结
谢谢观看
同课章节目录
