人教版化学九下同步精讲课件 9.2.3溶解度曲线的应用(13张ppt)
文档属性
| 名称 | 人教版化学九下同步精讲课件 9.2.3溶解度曲线的应用(13张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 217.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-08 14:30:26 | ||
图片预览



文档简介
溶解度曲线的应用
溶解度曲线有哪些应用呢?
一、激趣导入
二、考点剖析
(一)知识讲解
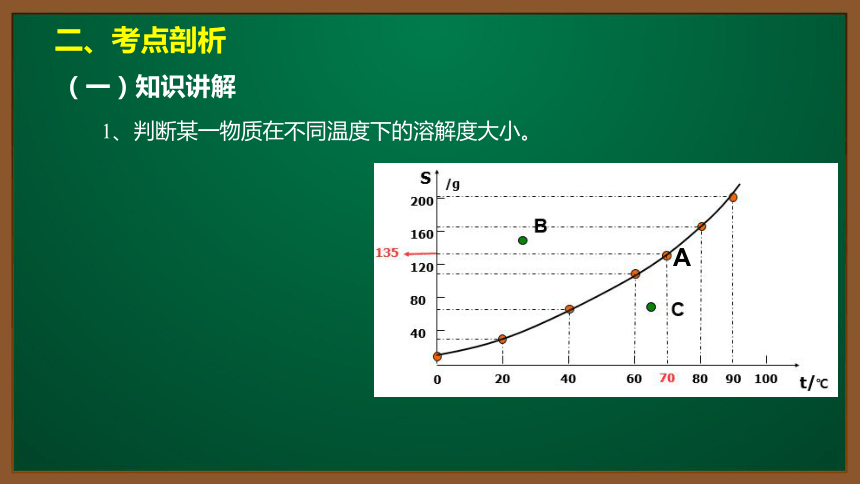
1、判断某一物质在不同温度下的溶解度大小。
A
二、考点剖析
(一)知识讲解
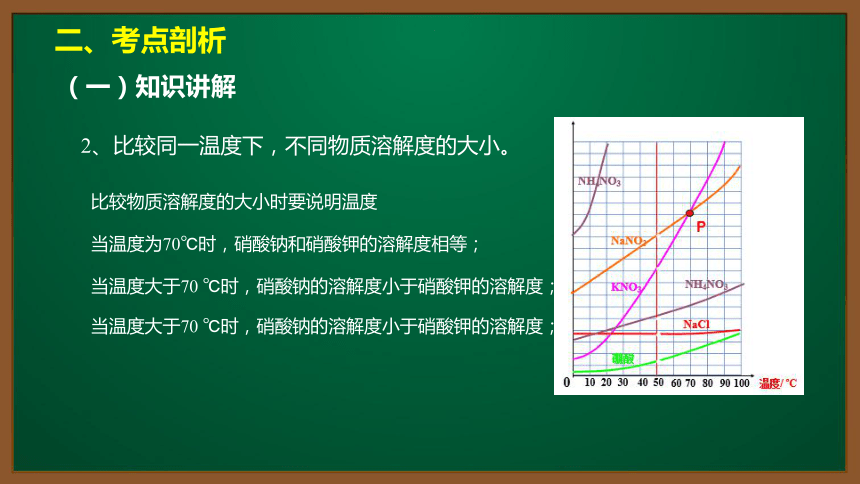
2、比较同一温度下,不同物质溶解度的大小。
比较物质溶解度的大小时要说明温度
当温度为70℃时,硝酸钠和硝酸钾的溶解度相等;
当温度大于70 ℃时,硝酸钠的溶解度小于硝酸钾的溶解度;
当温度大于70 ℃时,硝酸钠的溶解度小于硝酸钾的溶解度;
二、考点剖析
(一)知识讲解
3、判断不同物质溶解度受温度影响的变化趋势。
大多数固体物质的溶解度随温度的升高而增大,如KNO3。
少数固体物质的溶解度随温度的升 高变化不大 ,如NaCl。
极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2 。
二、考点剖析
(一)知识讲解
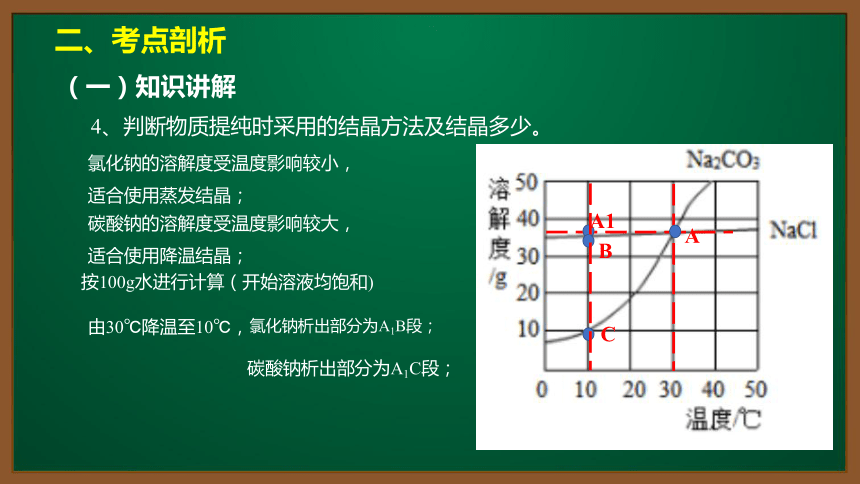
4、判断物质提纯时采用的结晶方法及结晶多少。
A
A1
B
C
由30℃降温至10℃,
按100g水进行计算(开始溶液均饱和)
碳酸钠析出部分为A1C段;
氯化钠的溶解度受温度影响较小,
适合使用蒸发结晶;
碳酸钠的溶解度受温度影响较大,
适合使用降温结晶;
氯化钠析出部分为A1B段;
二、考点剖析
(一)知识讲解
4、判断物质提纯时采用的结晶方法及结晶多少。
A
A1
B
C
结晶的方法:
一种是蒸发溶剂法(蒸发结晶)
适用于温度对溶解度影响不大的物质。
另一种是冷却热饱和溶液法(降温结晶)
适用于温度对溶解度影响大的物质。
二、考点剖析
(一)知识讲解
5、判断物质的饱和溶液和不饱和溶液相互转化的方法。
A
C
B
不饱和溶液变为饱和溶液
甲适合降温
乙适合升温
a、b两种物质的溶解度曲线如图所示.下列说法不正确的是( )
A. 15℃时,a、b 的溶解度均为20g
B. 加水或升温均可使b的饱和溶液变为不饱和溶液
C. 将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D. 分别向100g水中加入20g a和b,升温至30℃,所得溶液均为饱和溶液
D
二、考点剖析
(二) 典例分析
a、b两种物质的溶解度曲线如图所示.下列说法不正确的是( )
A. 15℃时,a、b 的溶解度均为20g
B. 加水或升温均可使b的饱和溶液变为不饱和溶液
C. 将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D. 分别向100g水中加入20g a和b,升温至30℃,所得溶液均为饱和溶液
D
二、考点剖析
(二) 典例分析
二、考点剖析
(三) 技巧点拨
1、正确理解溶解度曲线的意义。
2、掌握溶解度曲线的应用。
溶解度曲线的应用
三、归纳小结
判断某一物质在不同温度下的溶解度大小
比较同一温度下,不同物质溶解度的大小
判断不同物质溶解度受温度影响的变化趋势
判断物质提纯时采用的结晶方法及结晶多少
判断物质的饱和溶液和不饱和溶液相互转化的方法
谢谢观看
溶解度曲线有哪些应用呢?
一、激趣导入
二、考点剖析
(一)知识讲解
1、判断某一物质在不同温度下的溶解度大小。
A
二、考点剖析
(一)知识讲解
2、比较同一温度下,不同物质溶解度的大小。
比较物质溶解度的大小时要说明温度
当温度为70℃时,硝酸钠和硝酸钾的溶解度相等;
当温度大于70 ℃时,硝酸钠的溶解度小于硝酸钾的溶解度;
当温度大于70 ℃时,硝酸钠的溶解度小于硝酸钾的溶解度;
二、考点剖析
(一)知识讲解
3、判断不同物质溶解度受温度影响的变化趋势。
大多数固体物质的溶解度随温度的升高而增大,如KNO3。
少数固体物质的溶解度随温度的升 高变化不大 ,如NaCl。
极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2 。
二、考点剖析
(一)知识讲解
4、判断物质提纯时采用的结晶方法及结晶多少。
A
A1
B
C
由30℃降温至10℃,
按100g水进行计算(开始溶液均饱和)
碳酸钠析出部分为A1C段;
氯化钠的溶解度受温度影响较小,
适合使用蒸发结晶;
碳酸钠的溶解度受温度影响较大,
适合使用降温结晶;
氯化钠析出部分为A1B段;
二、考点剖析
(一)知识讲解
4、判断物质提纯时采用的结晶方法及结晶多少。
A
A1
B
C
结晶的方法:
一种是蒸发溶剂法(蒸发结晶)
适用于温度对溶解度影响不大的物质。
另一种是冷却热饱和溶液法(降温结晶)
适用于温度对溶解度影响大的物质。
二、考点剖析
(一)知识讲解
5、判断物质的饱和溶液和不饱和溶液相互转化的方法。
A
C
B
不饱和溶液变为饱和溶液
甲适合降温
乙适合升温
a、b两种物质的溶解度曲线如图所示.下列说法不正确的是( )
A. 15℃时,a、b 的溶解度均为20g
B. 加水或升温均可使b的饱和溶液变为不饱和溶液
C. 将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D. 分别向100g水中加入20g a和b,升温至30℃,所得溶液均为饱和溶液
D
二、考点剖析
(二) 典例分析
a、b两种物质的溶解度曲线如图所示.下列说法不正确的是( )
A. 15℃时,a、b 的溶解度均为20g
B. 加水或升温均可使b的饱和溶液变为不饱和溶液
C. 将30℃时a的饱和溶液降温至15℃,溶质的质量分数不变
D. 分别向100g水中加入20g a和b,升温至30℃,所得溶液均为饱和溶液
D
二、考点剖析
(二) 典例分析
二、考点剖析
(三) 技巧点拨
1、正确理解溶解度曲线的意义。
2、掌握溶解度曲线的应用。
溶解度曲线的应用
三、归纳小结
判断某一物质在不同温度下的溶解度大小
比较同一温度下,不同物质溶解度的大小
判断不同物质溶解度受温度影响的变化趋势
判断物质提纯时采用的结晶方法及结晶多少
判断物质的饱和溶液和不饱和溶液相互转化的方法
谢谢观看
同课章节目录
