人教版化学九下同步精讲课件 11.1.2复分解反应发生的条件(14张ppt)
文档属性
| 名称 | 人教版化学九下同步精讲课件 11.1.2复分解反应发生的条件(14张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 211.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-08 14:49:30 | ||
图片预览




文档简介
复分解反应发生的条件
一、激趣导入
碱和某些盐溶液会发生化学反应,什么样的盐才会和碱发生反应呢?
1、复分解反应
二、考点剖析
(一)知识讲解
复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。
表达式:AB + CD→
AD
+ CB
特 点:双交换,价不变
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
2NaOH + CuSO4== Na2SO4 + Cu(OH)2↓
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,
复分解反应才能发生。
6HCl+2Fe2O3===2FeCl3+3H2O
Ca(OH)2+Na2CO3===2NaCl+CaCO3↓
Na2CO3+2HCl===2NaCl+ CO2 ↑ +H2O
Na2CO3+2HCl==2NaCl+H2CO3
H2CO3==CO2 ↑ +H2O
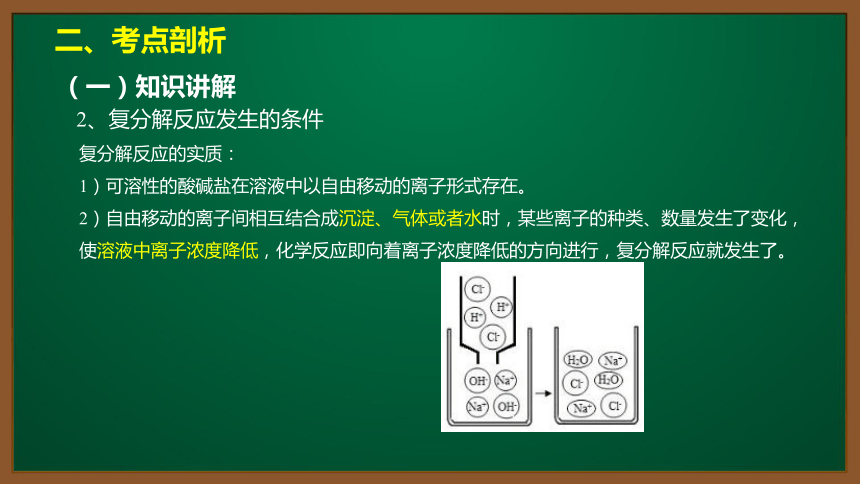
复分解反应的实质:
1)可溶性的酸碱盐在溶液中以自由移动的离子形式存在。
2)自由移动的离子间相互结合成沉淀、气体或者水时,某些离子的种类、数量发生了变化,
使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行,复分解反应就发生了。
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
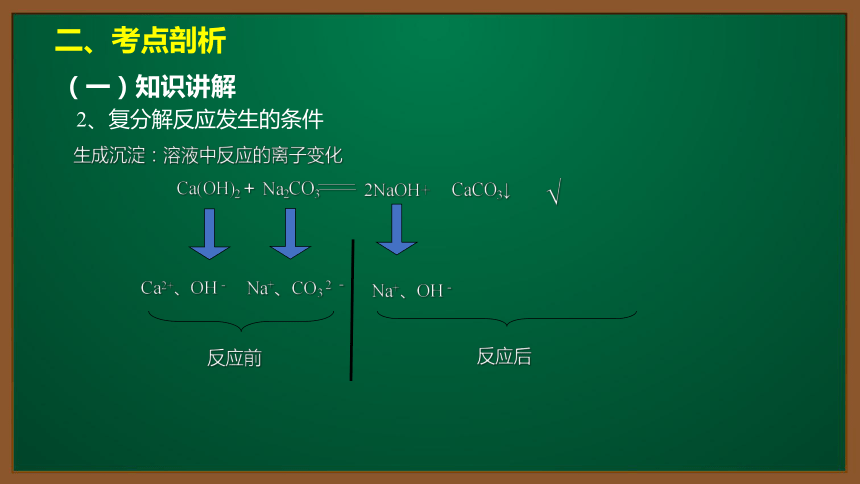
生成沉淀:溶液中反应的离子变化
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
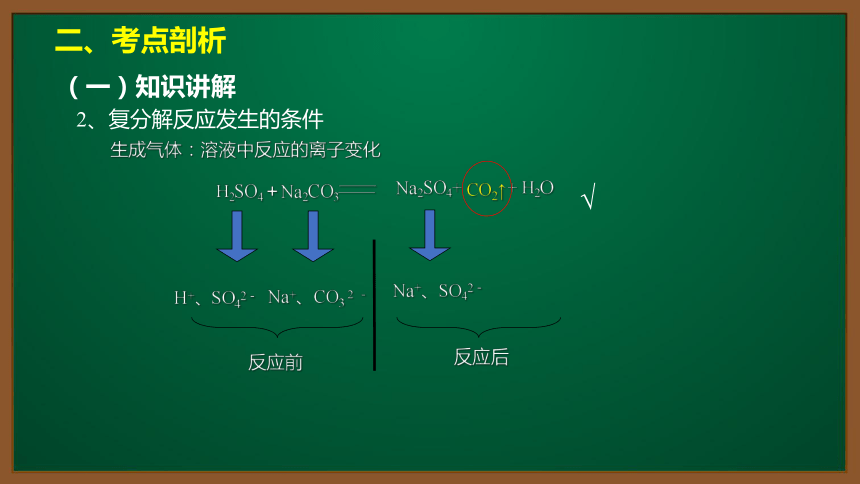
生成气体:溶液中反应的离子变化
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
H2SO4+Na2CO3——
Na2SO4+ + H2O
——
CO2↑
√
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
生成水:溶液中反应的离子变化
Ca2+、OH-
H+、Cl-
Ca2+、 Cl -
Ca(OH)2+ 2HCl ——
CaCl2+2H2O
——
√
反应前
反应后
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
×
K2SO4 + NaNO3
Na+、SO42-
K+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4 + KNO3 ——
Na+、NO3-
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
3、酸、碱、盐的溶解性
二、考点剖析
(一)知识讲解
物质溶解性口诀:
1、酸都溶:
2、钾 钠 铵 硝都可溶。
K_ Na_ NH4_ _NO3
3、盐酸盐(— Cl)不溶氯化银AgCl
4、硫酸盐(—SO4)不溶硫酸钡BaSO4。
5、碳酸盐(—CO3)只溶钾钠铵
下列各组物质相互混合后,不能发生反应的是( )
A.AgNO3溶液与NaCl溶液
B.烧碱溶液与稀硫酸
C.KNO3溶液与ZnSO4溶液
D.CaCl2溶液与Na2CO3溶液
C
二、考点剖析
(二) 典例分析
二、考点剖析
(三) 技巧点拨
1、理解和熟记复分解反应的特征。
2、理解和正确运用复分解反应发生的条件来判断反应是否发生。
三、归纳小结
复分解反应的条件
复分解反应的特征
复分解反应的条件:有沉淀或气体或水中的最少一个生成
常见的酸、碱、盐的溶解性
谢谢观看
一、激趣导入
碱和某些盐溶液会发生化学反应,什么样的盐才会和碱发生反应呢?
1、复分解反应
二、考点剖析
(一)知识讲解
复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应。
表达式:AB + CD→
AD
+ CB
特 点:双交换,价不变
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
2NaOH + CuSO4== Na2SO4 + Cu(OH)2↓
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,
复分解反应才能发生。
6HCl+2Fe2O3===2FeCl3+3H2O
Ca(OH)2+Na2CO3===2NaCl+CaCO3↓
Na2CO3+2HCl===2NaCl+ CO2 ↑ +H2O
Na2CO3+2HCl==2NaCl+H2CO3
H2CO3==CO2 ↑ +H2O
复分解反应的实质:
1)可溶性的酸碱盐在溶液中以自由移动的离子形式存在。
2)自由移动的离子间相互结合成沉淀、气体或者水时,某些离子的种类、数量发生了变化,
使溶液中离子浓度降低,化学反应即向着离子浓度降低的方向进行,复分解反应就发生了。
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
生成沉淀:溶液中反应的离子变化
Ca2+、OH-
Na+、CO3 2 -
Na+、OH-
反应前
反应后
Ca(OH)2+ Na2CO3——
2NaOH+
——
CaCO3↓
√
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
生成气体:溶液中反应的离子变化
H+、SO42-
Na+、CO3 2 -
Na+、SO42-
反应前
反应后
H2SO4+Na2CO3——
Na2SO4+ + H2O
——
CO2↑
√
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
生成水:溶液中反应的离子变化
Ca2+、OH-
H+、Cl-
Ca2+、 Cl -
Ca(OH)2+ 2HCl ——
CaCl2+2H2O
——
√
反应前
反应后
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
×
K2SO4 + NaNO3
Na+、SO42-
K+、NO3-
K+、SO42-
反应前
反应后
溶液中离子种类没有改变
Na2SO4 + KNO3 ——
Na+、NO3-
2、复分解反应发生的条件
二、考点剖析
(一)知识讲解
3、酸、碱、盐的溶解性
二、考点剖析
(一)知识讲解
物质溶解性口诀:
1、酸都溶:
2、钾 钠 铵 硝都可溶。
K_ Na_ NH4_ _NO3
3、盐酸盐(— Cl)不溶氯化银AgCl
4、硫酸盐(—SO4)不溶硫酸钡BaSO4。
5、碳酸盐(—CO3)只溶钾钠铵
下列各组物质相互混合后,不能发生反应的是( )
A.AgNO3溶液与NaCl溶液
B.烧碱溶液与稀硫酸
C.KNO3溶液与ZnSO4溶液
D.CaCl2溶液与Na2CO3溶液
C
二、考点剖析
(二) 典例分析
二、考点剖析
(三) 技巧点拨
1、理解和熟记复分解反应的特征。
2、理解和正确运用复分解反应发生的条件来判断反应是否发生。
三、归纳小结
复分解反应的条件
复分解反应的特征
复分解反应的条件:有沉淀或气体或水中的最少一个生成
常见的酸、碱、盐的溶解性
谢谢观看
同课章节目录
