浙江省温州市啸秋中学2011-2012学年高一化学 离子键2(课件)
文档属性
| 名称 | 浙江省温州市啸秋中学2011-2012学年高一化学 离子键2(课件) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-28 13:59:40 | ||
图片预览




文档简介
(共12张PPT)
微粒之间的相互作用力
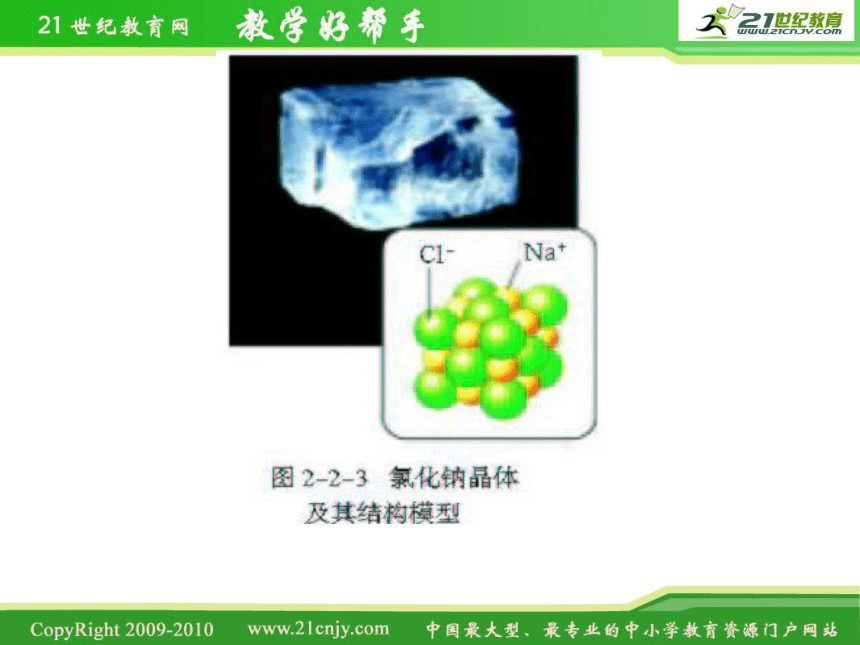
※食盐是由什么微粒构成的?食盐晶体能否导电?
※食盐在什么情况下可以导电呢?为什么?
※这些事实揭示了什么呢?
思考
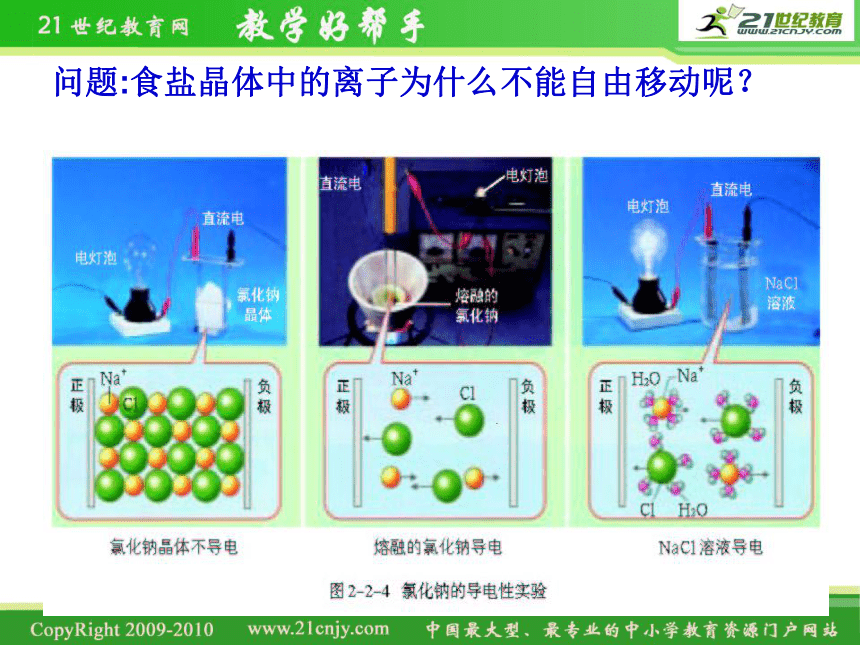
问题:食盐晶体中的离子为什么不能自由移动呢?
※阴阳离子之间的这种强烈的相互作用是怎样形成的呢?
※请大家回顾氯化钠的形成过程。
思考
还有哪些元素的原子能以离子键的方式结合呢?
Na Mg
K Ca
Ba
O F
S CI
Br
I
易形成阳离子的原子
易形成阴离子的原子
这些元素的原子结构有什么特点
原子 Na Mg Ca O S F CI
阳离子 Na+ Mg2+ Ca2+
阴离子 F- CI- O2- S2-
离子化合物 NaF、 CaO、 MgCI2、 Na2O 、 K2S
请用电子式表示下列微粒:
※氯气和水是由什么微粒构成的?
※是不是它们的组成微粒间也存在着作用力呢?
※你能想出哪些事实可以说明微粒间存在着这种作用力?
1.判断正误:
(1)原子或离子之间的相互作用叫做化学键
(2)阴、阳离子间通过静电引力而形成的化学键叫做离子键
(3)只有金属元素和非金属元素化合时才能形成离子键
(4)大多数的盐、碱和低价金属氧化物中含有离子键
应指直接相邻的原子或离子之间的强烈的相互作用
静电引力应改为静电作用,它包括引力和斥力。
铵离子和非金属离子,酸根离子和金属离子等也可形 成离子键。
正确
2、下列说法正确的是
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
( D )
3、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是
A.10与12 B.8与17 C.19与17 D.6与14
( C )
思考题:
1.认识了氯化钠的形成过程,试分析氯化氢、氧气的形成。
2.结合本课知识,查阅资料阐述物质多样性的原因。
微粒之间的相互作用力
※食盐是由什么微粒构成的?食盐晶体能否导电?
※食盐在什么情况下可以导电呢?为什么?
※这些事实揭示了什么呢?
思考
问题:食盐晶体中的离子为什么不能自由移动呢?
※阴阳离子之间的这种强烈的相互作用是怎样形成的呢?
※请大家回顾氯化钠的形成过程。
思考
还有哪些元素的原子能以离子键的方式结合呢?
Na Mg
K Ca
Ba
O F
S CI
Br
I
易形成阳离子的原子
易形成阴离子的原子
这些元素的原子结构有什么特点
原子 Na Mg Ca O S F CI
阳离子 Na+ Mg2+ Ca2+
阴离子 F- CI- O2- S2-
离子化合物 NaF、 CaO、 MgCI2、 Na2O 、 K2S
请用电子式表示下列微粒:
※氯气和水是由什么微粒构成的?
※是不是它们的组成微粒间也存在着作用力呢?
※你能想出哪些事实可以说明微粒间存在着这种作用力?
1.判断正误:
(1)原子或离子之间的相互作用叫做化学键
(2)阴、阳离子间通过静电引力而形成的化学键叫做离子键
(3)只有金属元素和非金属元素化合时才能形成离子键
(4)大多数的盐、碱和低价金属氧化物中含有离子键
应指直接相邻的原子或离子之间的强烈的相互作用
静电引力应改为静电作用,它包括引力和斥力。
铵离子和非金属离子,酸根离子和金属离子等也可形 成离子键。
正确
2、下列说法正确的是
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
( D )
3、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是
A.10与12 B.8与17 C.19与17 D.6与14
( C )
思考题:
1.认识了氯化钠的形成过程,试分析氯化氢、氧气的形成。
2.结合本课知识,查阅资料阐述物质多样性的原因。
