浙江省温州市啸秋中学2011-2012学年高一化学 离子键1(课件)
文档属性
| 名称 | 浙江省温州市啸秋中学2011-2012学年高一化学 离子键1(课件) |

|
|
| 格式 | zip | ||
| 文件大小 | 579.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-28 00:00:00 | ||
图片预览






文档简介
(共25张PPT)
第二单元 微粒之间的相互作用力
离子键
议一议:构成物质的基本微粒有哪几种?分别举例说明。
想一想:不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?
金刚石: 食盐: 干冰: 。
原子
离子
分子
化学键:
物质中直接相邻的原子或离子之间存在的强烈的相互作用。
注意:1、直接相邻
2、强烈的相互作用---作用的强度大
3、化学键只存在于原子或离子间而
不存在于分子间
4、化学键的分类:
离子键
共价键
金属键
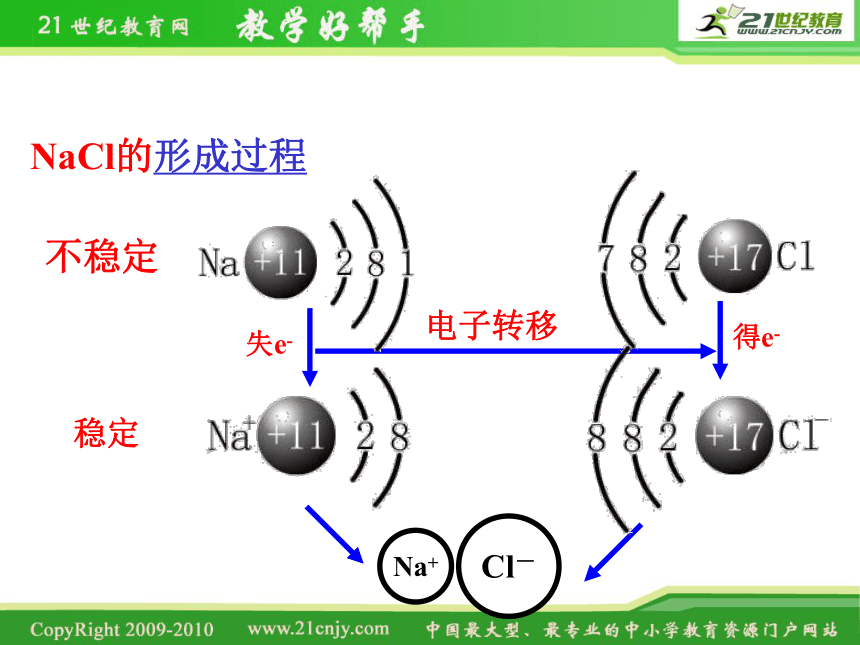
Na+
Cl-
电子转移
不稳定
稳定
NaCl的形成过程
失e-
得e-
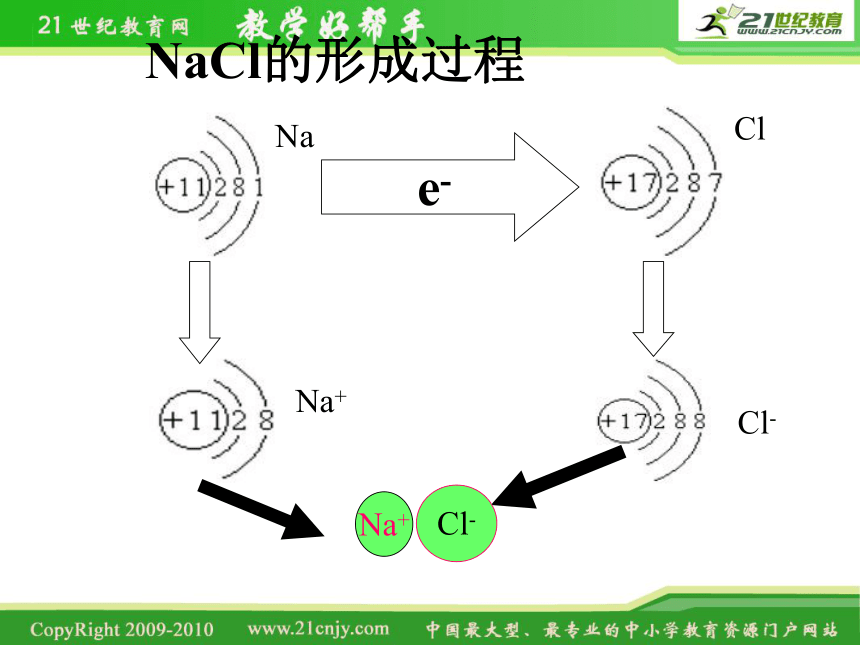
NaCl的形成过程
e-
Na
Na+
Cl
Cl-
Na+
Cl-
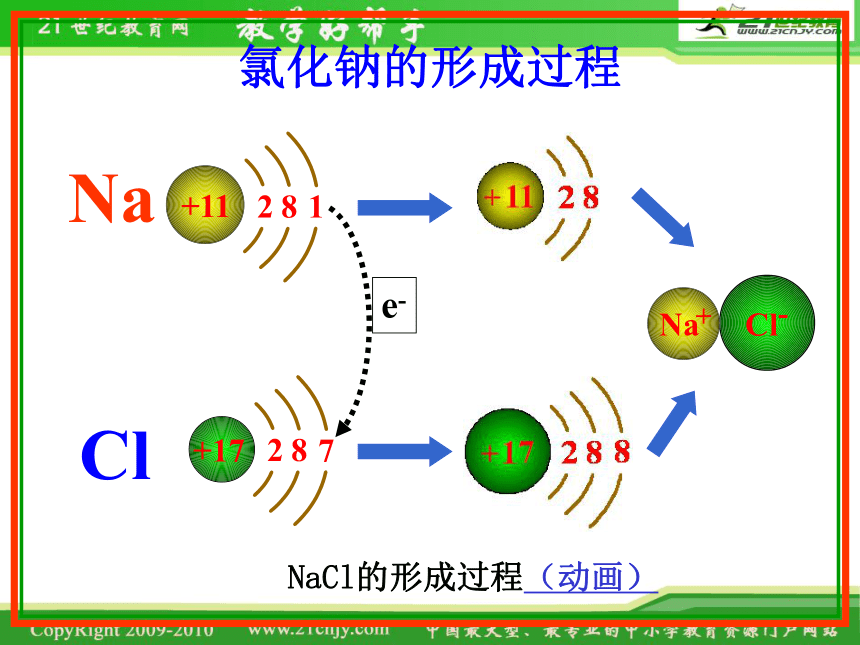
氯化钠的形成过程
NaCl的形成过程(动画)
e-
Na
Cl
1、在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键——离子键。
2、阴阳离子结合在一起,彼此电荷是否会抵消呢?
阴阳离子间、电子与电子、原子核与原子核间的相互排斥作用
1、定义:
⑴成键微粒:阴阳离子
⑵成键本质:静电作用(静电引力和斥力)
⑶成键过程:阴阳离子接近到某一定距离时,吸引
和排斥达到平衡,就形成了离子键。
含有离子键的化合物就是离子化合物。
一、离子键
使带相反电荷的阴、阳离子结合成化合物的静电作用,叫做离子键。
判断形成离子键的方法:
(1)活泼金属与活泼非金属之间,
例如:大部分的IA、IIA族和VIA、VIIA族
(2)大部分含活泼金属阳离子的强碱、盐、金属氧化物、过氧化物等
(3)含NH4+的盐
判断下列的物质中哪些有离子键?
CaO、CaCl2、H2O、Fe、
Na2O、Mg3N2、Na2O2、CO2、NH3、CH4
NH4Cl、
Ca(OH)2
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
⑴原子的电子式:
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
3、电子式:
⑴成键离子的半径:
2、离子键的强弱判断:
半径越小,离子键越强。
如:NaCl MgCl2
⑵成键离子所带电荷数:
如:NaCl NaBr
电荷数越多,离子键越强。
3、电子式:
>
<
⑵离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
简单阳离子:金属阳离子的电子式就是其离子符号
原子团形成的阳离子:元素符号周围标出最外层电子,再标 [ ] 及“ 电荷数 ”
阴离子的电子式:元素符号周围标出最外层电子,再标 [ ] 及“ 电荷数 ”
⑶离子化合物的电子式:将阳离子 和阴离子的电子式组合在一起,阴、阳离子相间写,相同离子不合并。
Na+
[ Cl ]-
··
··
:
:
2-
原子 离子 离子化合物
Cl
Na
Br
Mg
2
Mg
2
Na
Mg
Cl
Na
Cl
Br
Br
Br
观察以下示例,归纳 电子式的书写规则
电子式的书写:
1.在元素符号周围用小点(或× )来表示原子最外层电子的式子就是该原子的电子式。
3.阴离子要加方括号,并注明所带电荷数。
Br
2.简单阳离子的电子式就是其离子符号。
Mg
2
4.离子化合物的电子式中,相同离子不能合并,一般分布在两侧。
Mg
2
Br
Br
2、试写以下物质的电子式:
KCl 、Na2S 、MgF2、
NaOH、Ba(OH)2 、
Na2O 、MgO、Na2O2
1、写出下列微粒的电子式 S Br Br- S2- K+
:S: :Br: [:Br:]- [:S:]2- K+
. .
: .
: :
: :
1、下列电子式中正确的是( )
C
2、下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
D
3、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是 ( )
A.10与12 B.8与17 C. 19与17 D.6与14
C
4、请根据离子化合物的定义,判断下列哪些化合物属于离子化合物?
NaCl MgO CO2 CaF2 NH3 NO2
3、写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
氟原子, 铝原子, 氟离子, 铝离子
*
随堂练习:
3、用电子式表示下列离子化合物的形成过程:
BaCl2 NaF MgS K2O
*
微粒之间的相互作用力
*
:Cl. + .Ba. + .Cl: [:Cl:]-Ba2+[:Cl:]-
Na. + .F: Na+[:F:]-
.Mg. + .S. Mg2+[:S:]2-
K. + .O. + .K K+[:O:]2-K+
: :
: :
: :
: :
: :
: :
: :
: :
: :
: :
直接相邻的原子、离子之间强烈的相互
作用,叫做化学键。
阴阳离子间通过静电作用所形成的化学
键叫做离子键。
含有离子键的化合物一定是离子化合物
阴离子Nn-
阳离子Mm+
用电子式表示
离子化合物
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
静电作用
离 子 键
Cl
Mg
Cl
Mg
2
Cl
Cl
例
阴离子Nn-
阳离子Mm+
用电子式表示
离子化合物
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
静电作用
离 子 键
第二单元 微粒之间的相互作用力
离子键
议一议:构成物质的基本微粒有哪几种?分别举例说明。
想一想:不同的物质含有不同的微粒,这些微粒是如何彼此结合而构成物质的?
金刚石: 食盐: 干冰: 。
原子
离子
分子
化学键:
物质中直接相邻的原子或离子之间存在的强烈的相互作用。
注意:1、直接相邻
2、强烈的相互作用---作用的强度大
3、化学键只存在于原子或离子间而
不存在于分子间
4、化学键的分类:
离子键
共价键
金属键
Na+
Cl-
电子转移
不稳定
稳定
NaCl的形成过程
失e-
得e-
NaCl的形成过程
e-
Na
Na+
Cl
Cl-
Na+
Cl-
氯化钠的形成过程
NaCl的形成过程(动画)
e-
Na
Cl
1、在氯化钠晶体中,Na+和Cl- 间存在哪些力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引
和排斥作用达到平衡,阴阳离子间形成稳定的化
学键——离子键。
2、阴阳离子结合在一起,彼此电荷是否会抵消呢?
阴阳离子间、电子与电子、原子核与原子核间的相互排斥作用
1、定义:
⑴成键微粒:阴阳离子
⑵成键本质:静电作用(静电引力和斥力)
⑶成键过程:阴阳离子接近到某一定距离时,吸引
和排斥达到平衡,就形成了离子键。
含有离子键的化合物就是离子化合物。
一、离子键
使带相反电荷的阴、阳离子结合成化合物的静电作用,叫做离子键。
判断形成离子键的方法:
(1)活泼金属与活泼非金属之间,
例如:大部分的IA、IIA族和VIA、VIIA族
(2)大部分含活泼金属阳离子的强碱、盐、金属氧化物、过氧化物等
(3)含NH4+的盐
判断下列的物质中哪些有离子键?
CaO、CaCl2、H2O、Fe、
Na2O、Mg3N2、Na2O2、CO2、NH3、CH4
NH4Cl、
Ca(OH)2
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
⑴原子的电子式:
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
3、电子式:
⑴成键离子的半径:
2、离子键的强弱判断:
半径越小,离子键越强。
如:NaCl MgCl2
⑵成键离子所带电荷数:
如:NaCl NaBr
电荷数越多,离子键越强。
3、电子式:
>
<
⑵离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
简单阳离子:金属阳离子的电子式就是其离子符号
原子团形成的阳离子:元素符号周围标出最外层电子,再标 [ ] 及“ 电荷数 ”
阴离子的电子式:元素符号周围标出最外层电子,再标 [ ] 及“ 电荷数 ”
⑶离子化合物的电子式:将阳离子 和阴离子的电子式组合在一起,阴、阳离子相间写,相同离子不合并。
Na+
[ Cl ]-
··
··
:
:
2-
原子 离子 离子化合物
Cl
Na
Br
Mg
2
Mg
2
Na
Mg
Cl
Na
Cl
Br
Br
Br
观察以下示例,归纳 电子式的书写规则
电子式的书写:
1.在元素符号周围用小点(或× )来表示原子最外层电子的式子就是该原子的电子式。
3.阴离子要加方括号,并注明所带电荷数。
Br
2.简单阳离子的电子式就是其离子符号。
Mg
2
4.离子化合物的电子式中,相同离子不能合并,一般分布在两侧。
Mg
2
Br
Br
2、试写以下物质的电子式:
KCl 、Na2S 、MgF2、
NaOH、Ba(OH)2 、
Na2O 、MgO、Na2O2
1、写出下列微粒的电子式 S Br Br- S2- K+
:S: :Br: [:Br:]- [:S:]2- K+
. .
: .
: :
: :
1、下列电子式中正确的是( )
C
2、下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.含有离子键的化合物一定是离子化合物
D
3、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是 ( )
A.10与12 B.8与17 C. 19与17 D.6与14
C
4、请根据离子化合物的定义,判断下列哪些化合物属于离子化合物?
NaCl MgO CO2 CaF2 NH3 NO2
3、写出下列微粒的电子式:
硫原子, 溴原子, 硫离子, 溴离子
氟原子, 铝原子, 氟离子, 铝离子
*
随堂练习:
3、用电子式表示下列离子化合物的形成过程:
BaCl2 NaF MgS K2O
*
微粒之间的相互作用力
*
:Cl. + .Ba. + .Cl: [:Cl:]-Ba2+[:Cl:]-
Na. + .F: Na+[:F:]-
.Mg. + .S. Mg2+[:S:]2-
K. + .O. + .K K+[:O:]2-K+
: :
: :
: :
: :
: :
: :
: :
: :
: :
: :
直接相邻的原子、离子之间强烈的相互
作用,叫做化学键。
阴阳离子间通过静电作用所形成的化学
键叫做离子键。
含有离子键的化合物一定是离子化合物
阴离子Nn-
阳离子Mm+
用电子式表示
离子化合物
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
静电作用
离 子 键
Cl
Mg
Cl
Mg
2
Cl
Cl
例
阴离子Nn-
阳离子Mm+
用电子式表示
离子化合物
活泼金属原子M
活泼非金属原子N
失去电子
得到电子
静电作用
离 子 键
