浙江省温州市啸秋中学2011-2012学年高一化学 不同类型的晶体(课件)
文档属性
| 名称 | 浙江省温州市啸秋中学2011-2012学年高一化学 不同类型的晶体(课件) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-28 13:59:40 | ||
图片预览








文档简介
(共22张PPT)
(三 )不同类型的晶体
氯化钠
金刚石
明矾
水晶
雪花
干冰
几种晶体
几种晶体
1、这些晶体在外观上有什么特点?
2、这些晶体为什么会有规则的几何外形?
1、金刚石、氯化钠、雪花这三种晶体的物理性质(硬度、熔沸点)上有什么特点(区别)?
2、小组讨论它们性质差异的原因可能是什么?
根据构成晶体的粒子种类及粒子之间的相互作用不同,可将晶体分为:
①离子晶体 ②分子晶体 ③原子晶体 ④金属晶体
晶体的类型:
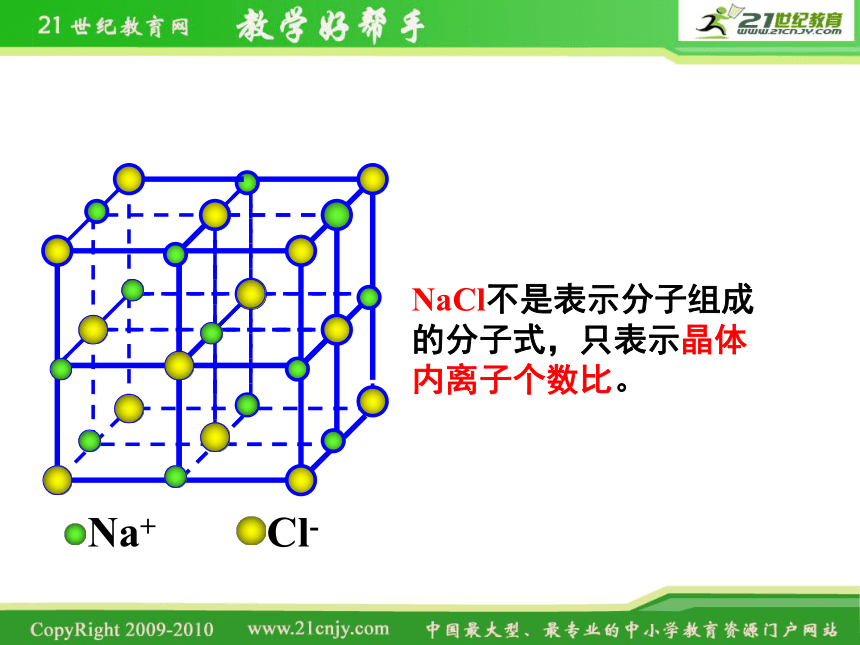
1、NaCl晶体中离子的排列方式
在该晶体中有没有氯化钠分子?
Na+
Cl-
NaCl不是表示分子组成的分子式,只表示晶体内离子个数比。
1、干冰及其二氧化碳分子的排列方式
该晶体微粒之间有哪些作用力?
O
C
分子间作用力
共价键
1、石英晶体中的硅、氧原子的排列方式
SiO2平面结构
180
109 28
Si
O
共价键
四、金属晶体
1、金属晶体的结构
小结:(判断晶体类型的依据)
(1)看构成晶体的微粒种类及相互作用。
(2)看物理性质(熔沸点、硬度、导电性等)。
2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、冰醋酸、 尿素、 水晶、 Na2O
C
课 堂 练 习
3、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
原子晶体
分子晶体
分子晶体
离子晶体
小结
1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
结构
构成晶体的粒子
微粒间的相互作用
性质
硬度
熔点
导电性
阴、阳离子
分子
原子
离子键
分子间
作用力
共价键
差距大
大
小
较大
较大
小
高
差距大
导电
不导电
不导电
熔融状态导电
-------
-------
4、下列属于分子晶体的一组物质是 ( )
A 、CaO、NO、CO
B、 CCl4、H2O2、He
C、 CO2、SO2、NaCl
D 、CH4、O2、Na2O
5、下列性质符合分子晶体的是 ( )
A、 熔点1070℃,易熔于水,水溶液能导电
B、 熔点是10.31℃,液体不导电,水溶液能导电
C、 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D、 熔点807℃ ,熔化时能导电,水溶液也能导电
B
B
6、下列的晶体中,化学键种类相同,晶体类型也相同的是 ( )
A、SO2与SiO2 B、CO2与H2O
C、C与HCl D、CCl4与SiC
7、碳化硅SiC的一种具有类似金刚石结构的晶体,其中C原子和S原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是 ( )
A、①③② B、②③①
C、③①② D、②①③
B
A
8、下列含有共价键的离子晶体是:①硫酸钠 ②氢氧化钾 ③金刚石 ④乙醇 ⑤氯化钙 ( )
A、①②⑤ B、①②
C、①④⑤ D、①⑤
B
巩固练习:
1、下列物质的晶体中,化学键类型相同,熔化时所
克服的作用力也完全相同的是( )
A、CO2和SiO2 B、NaCl和HCl
C、( NH4 )2 CO3和H2SO4 D、Na2S和KCl
2、以下性质适合分子晶体的是( )
A、熔点1070℃,易溶于水,水溶液能导电
B、熔点10.31℃,液态不导电,水溶液能导电
C、能溶于CS2 ,熔点112.8℃,沸点是444.6℃
D、熔点3550℃,沸点4827℃硬度大
D
BC
单质硼有无定形和晶体两种,参考下表数据回答:
(1)晶体硼的晶体类型属于__________晶体,理由是_________________________。
(2)已知晶体的结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由_____个硼原子构成的,其中B—B键的键角为____ ,共含有____个B—B键。
原子
熔沸点很高,硬度很大
12
60°
30
3、P在空气中充分燃烧后,生成如下图所示的空间结构的分子,图中“〇”表示原子,线条表示化学键,键角为109.28'。
①请在图中找出P原子(将其涂黑)。
②由图可见,所形成的化合物分子式是 ,而P2O5是它的 式。
③分子内的P原子排列成 空间构型。
④每个P原子处于 的中心。
P4O10
最简
正四面体网状
正四面体
(三 )不同类型的晶体
氯化钠
金刚石
明矾
水晶
雪花
干冰
几种晶体
几种晶体
1、这些晶体在外观上有什么特点?
2、这些晶体为什么会有规则的几何外形?
1、金刚石、氯化钠、雪花这三种晶体的物理性质(硬度、熔沸点)上有什么特点(区别)?
2、小组讨论它们性质差异的原因可能是什么?
根据构成晶体的粒子种类及粒子之间的相互作用不同,可将晶体分为:
①离子晶体 ②分子晶体 ③原子晶体 ④金属晶体
晶体的类型:
1、NaCl晶体中离子的排列方式
在该晶体中有没有氯化钠分子?
Na+
Cl-
NaCl不是表示分子组成的分子式,只表示晶体内离子个数比。
1、干冰及其二氧化碳分子的排列方式
该晶体微粒之间有哪些作用力?
O
C
分子间作用力
共价键
1、石英晶体中的硅、氧原子的排列方式
SiO2平面结构
180
109 28
Si
O
共价键
四、金属晶体
1、金属晶体的结构
小结:(判断晶体类型的依据)
(1)看构成晶体的微粒种类及相互作用。
(2)看物理性质(熔沸点、硬度、导电性等)。
2、下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是( )
A.食盐和蔗糖熔化 B.钠和硫熔化
C.碘和干冰升华 D.二氧化硅和氧化钠熔化
1、判断下列晶体所属的晶体类型?
蔗糖、 冰、 铁、 BaSO4、 金刚石、冰醋酸、 尿素、 水晶、 Na2O
C
课 堂 练 习
3、分析物质的物理性质,判断其晶体类型:
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电;___________
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电;___________
C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中;_______________
D、物质A,无色晶体,熔融时或溶于水中都能导电_____________
原子晶体
分子晶体
分子晶体
离子晶体
小结
1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
结构
构成晶体的粒子
微粒间的相互作用
性质
硬度
熔点
导电性
阴、阳离子
分子
原子
离子键
分子间
作用力
共价键
差距大
大
小
较大
较大
小
高
差距大
导电
不导电
不导电
熔融状态导电
-------
-------
4、下列属于分子晶体的一组物质是 ( )
A 、CaO、NO、CO
B、 CCl4、H2O2、He
C、 CO2、SO2、NaCl
D 、CH4、O2、Na2O
5、下列性质符合分子晶体的是 ( )
A、 熔点1070℃,易熔于水,水溶液能导电
B、 熔点是10.31℃,液体不导电,水溶液能导电
C、 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D、 熔点807℃ ,熔化时能导电,水溶液也能导电
B
B
6、下列的晶体中,化学键种类相同,晶体类型也相同的是 ( )
A、SO2与SiO2 B、CO2与H2O
C、C与HCl D、CCl4与SiC
7、碳化硅SiC的一种具有类似金刚石结构的晶体,其中C原子和S原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是 ( )
A、①③② B、②③①
C、③①② D、②①③
B
A
8、下列含有共价键的离子晶体是:①硫酸钠 ②氢氧化钾 ③金刚石 ④乙醇 ⑤氯化钙 ( )
A、①②⑤ B、①②
C、①④⑤ D、①⑤
B
巩固练习:
1、下列物质的晶体中,化学键类型相同,熔化时所
克服的作用力也完全相同的是( )
A、CO2和SiO2 B、NaCl和HCl
C、( NH4 )2 CO3和H2SO4 D、Na2S和KCl
2、以下性质适合分子晶体的是( )
A、熔点1070℃,易溶于水,水溶液能导电
B、熔点10.31℃,液态不导电,水溶液能导电
C、能溶于CS2 ,熔点112.8℃,沸点是444.6℃
D、熔点3550℃,沸点4827℃硬度大
D
BC
单质硼有无定形和晶体两种,参考下表数据回答:
(1)晶体硼的晶体类型属于__________晶体,理由是_________________________。
(2)已知晶体的结构单元是由硼原子组成的正二十面体(如图),其中有20个等边三角形的面和一定数目的顶角,每个顶角各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由_____个硼原子构成的,其中B—B键的键角为____ ,共含有____个B—B键。
原子
熔沸点很高,硬度很大
12
60°
30
3、P在空气中充分燃烧后,生成如下图所示的空间结构的分子,图中“〇”表示原子,线条表示化学键,键角为109.28'。
①请在图中找出P原子(将其涂黑)。
②由图可见,所形成的化合物分子式是 ,而P2O5是它的 式。
③分子内的P原子排列成 空间构型。
④每个P原子处于 的中心。
P4O10
最简
正四面体网状
正四面体
