2020-2021学年高中化学人教版必修1-1.1化学实验基本方法 课件(45张ppt)
文档属性
| 名称 | 2020-2021学年高中化学人教版必修1-1.1化学实验基本方法 课件(45张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-09 13:57:19 | ||
图片预览











文档简介
(共45张PPT)
第一章
从实验学化学
第一节
化学实验基本方法
?化学实验安全?
1、遵守实验室规则
本校实验室规则:
①进实验室前,
应先预习实验,
明确实验目
的、原理和方法,
严禁不预习进实验室;
②严禁将饮食或餐具带进实验室,更不能
将实验器皿当作餐具使用;
③使用电器要谨防触电,不要用湿手触摸
电器;
④绝不允许将几种试剂或药品随意混合,以
免发生爆炸、灼伤等事故;
⑤实验过程中,应严格遵守各项实验操作规
程,
严禁随意进行无关实验,
不得大声喧哗;
⑥有意外事故,应及时向老师报告;
⑦实验结束,应将仪器洗净,整理清洁实验
台,关好水龙头、抽风机,拉开电刀闸,
检查完毕实验室,把手洗净才能离开;
(1)了解一些常用危险化学品的标志
2、了解安全措施
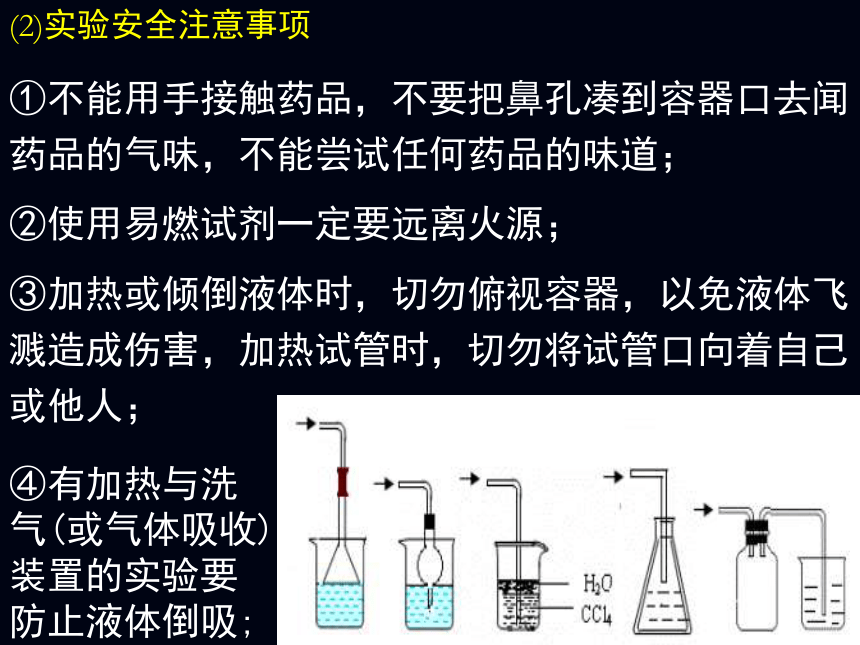
(2)实验安全注意事项
①不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不能尝试任何药品的味道;
②使用易燃试剂一定要远离火源;
③加热或倾倒液体时,切勿俯视容器,以免液体飞溅造成伤害,加热试管时,切勿将试管口向着自己或他人;
④有加热与洗气(或气体吸收)装置的实验要防止液体倒吸;
⑥做有毒气体实验时,应在通风橱中进行,并进行尾气处理(吸收或点燃);
⑤稀释浓酸,特别是浓硫酸时一定要将浓酸缓慢注入水中并不断搅拌以散发热量;
⑦点燃可燃性气体前要验纯。
①浓酸洒在实验台上,
先用NaHCO3溶液冲洗,
后用水冲洗;浓硫酸溅到皮肤上,
立即用大
量水冲洗,
再用3%~5%的NaHCO3溶液冲洗.
严重的须就医;
②浓碱洒在实验台上,先用稀醋酸中和,然后
用水冲洗干净。浓碱沾在皮肤上,先用水冲
洗,再涂硼酸溶液。严重时要就医;
③酒精及其他易燃有机物小面积失火,应迅速
用湿抹布扑灭,烫伤(灼伤)要就医。
(3)化学实验过程中意外事故的处理
(C)液溴有毒且易挥发,需盛放在磨口的细口瓶里,并加些水(水覆盖在液溴上面),起水封作用。
(1)几种特殊试剂的存放
3、掌握正确的操作方法
(A)钾、钙、钠在空气中极易氧化,遇水发生剧烈反应放在盛有煤油的广口瓶中以隔绝空气。
(B)白磷着火点低(40℃),在空气中能缓慢氧化而自燃,通常保存在冷水中。
(F)氢氧化钠固体易潮解,应盛放在易于密封的干燥广口瓶中保存;其溶液盛放在无色细口瓶里,瓶口都用橡皮塞塞紧,不能用玻璃塞。
(D)碘易升华且具有强烈刺激性气味,盛放在磨口的广口瓶里。
(E)浓硝酸、硝酸银见光易分解,应保存在棕色瓶中,贮放在黑暗而且温度低的地方。
例:指出下列操作的错误
(2)药品的取用
固体药品:粉状固体用药匙或小纸条直接送入仪器底部。块状固体用镊子缓缓从容器口滑到底部。不特殊说明用量时,取1~2g,定量时用天平称量。
液体药品:
少量液体用胶头滴管,
滴管口与容器口不能相碰(正中上方滴入).
多量液体可倾倒,
应手握标签.
不特殊说明用量时,
取1~2mL.
定量时用量筒量.
①定量试纸
pH试纸,使用时不可用蒸馏水湿润。
(3)试纸的使用
②定性试纸
蓝色或红色石蕊试纸,淀粉碘化钾试纸和品红试纸等,使用时应先用蒸馏水湿润。
a、检验溶液时,一般先把一小块试纸放在表面皿或玻璃片上,用沾有待测溶液的玻璃棒点试纸的中部,观察颜色的变化,判断溶液的性质。
b、检验气体时,一般先用蒸馏水把试纸润湿。粘在玻璃棒的一端,用玻璃棒把试纸放到盛有待测气体的试管口(注意不要接触),观察试纸的颜色变化情况来判断气体的性质。
注意:使用试纸时,不可将试纸直接插入待测液
可直接加热的仪器:☆
试管、蒸发皿
、坩埚、燃烧匙
坩埚
(4)加热的方法
强调
可直接加热的仪器:☆
试管、蒸发皿
、坩埚、燃烧匙
需垫石棉网加热的仪器:
烧杯、烧瓶、锥形瓶
不能加热的仪器:
量筒、集气瓶、漏斗、温度计、滴瓶、表面皿、广口瓶、细口瓶等
加热的思考:
1、点燃酒精灯时用旁边同学的酒精灯点燃?
2、能不能用酒精少于1/3的酒精灯加热?
3、直接用口吹灭酒精灯?
4、给液体加热时,液体不超试管体积多少?
5、热的容器直接放实验台或直接用水冲洗?
6、点燃H2、CO、CH4等易燃气体前应该?
1/3
验纯
例:指出下列操作中的错误
②给试管里的药品,
必须先进行预热,
以免试管炸裂.
如果试管里的药品是液体,
液体体积不要超过试管容积的1/3,
使试管口向上约45?角倾斜,
切不可使试管口朝者自己或有人的方向,
以免液体沸腾喷出伤人.
如果试管里的药品是固体,
要使试管口朝下倾斜,
以免试管内有水倒流炸裂试管.
③烧得很热的玻璃容器,不要立即用冷水冲洗,
否则可能破裂。也不要直接放在实验台上,应放在石棉网上。
(5)气体的收集
排气法
收集
排水法收集
向下排气法
密度小于
空气
向上排气法
密度大于
空气
难溶于水的气体
二、混合物的分离和提纯
思考与交流(P5)
1、利用什么方法和性质将金子与沙子分离?
2、如何分离铁屑和沙子?
根据金以单质形态存在、密度比沙大的性质,可以用水洗法将金子从沙里分离出来。
可以用磁铁吸取的方法将铁屑和沙分离开来。
过滤:
蒸发:
从液体中分离出不溶性固体。
分离溶于溶剂中的固体溶质。
以“粗盐的提纯”来复习和拓展(请同学们阅读P5实验1—1,找出粗盐的主要成分及所含杂质。)
杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等
主要成分:NaCl
提纯
NaCl
晶体
1.混合物的分离和提纯的常用方法之“过滤和蒸发”
粗盐的提纯:
水分蒸发,逐渐析出固体。
⒊蒸发:将滤液倒入蒸发皿,然后用酒精灯加热,同时用玻璃棒不断搅拌溶液,当容器内余少量液体时,停止加热,利用余热加热蒸干。
不溶物留再滤纸上,液体渗过滤纸,沿漏斗颈流入另一烧杯中。
⒉
过滤:将烧杯中的液体沿玻璃棒倒入过滤器中过滤。若滤液浑浊,再过滤一次。
粗盐逐渐溶解而减少,食盐水略显浑浊。
⒈
溶解:称取约4g的粗盐加到约12g水中,用玻璃棒轻轻搅拌,直至粗盐不再溶解为止。
现
象
步
骤
“一贴”:滤纸用水润湿紧贴漏斗
的内壁,中间不留有气泡。
“二低”:滤纸的边缘低于漏斗
口,
漏斗里的液体低于滤纸的边缘
“三靠”:倾倒液体的烧杯尖口要
紧靠玻璃棒,玻璃棒的末端轻靠
在三层滤纸的一边,漏斗下端的
管口靠烧杯内壁。
若:滤液浑浊应再过滤一次
2、过滤:
3、蒸发
(1)蒸发皿的液体不超过容积的2/3
(2)加热时,用玻璃棒不断搅拌
(3)当容器内余少量液体时,停止加热,
利用余热加热蒸干。
(4)取下未冷却的蒸发皿时,要
放在石棉网上。
(为什么?)
防止由于局部温度过高,造成液体飞溅。
(为什么?)
防止由于局部温度过高,造成晶体溅出。
问题讨论:
[实验1-1]得到的盐是纯净的NaCl吗?可能还有什么杂质没有除去?用什么方法可以检验它们呢?
纯净的NaCl
粗盐
溶
解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
蒸
发
过
滤
1、如何检验未知溶液中是否含有SO42-
?
实验1-2
取【实验1-1】得到的盐约0.5g放入试管中,向试管中加入约2
mL水配成溶液,先加稀盐酸使溶液酸化,然后向试管中滴入几滴BaCl2溶液。观察现象。
现象:
有白色沉淀生成
化学方程式:
BaCl2+Na2SO4=BaSO4↓+2NaCl
离子的检验:
试剂:稀盐酸和BaCl2溶液(先后顺序不限)
加入稀盐酸的原因:排除CO32-对SO42-检验的干扰。
思考1:还能通过检验哪些离子来说明所得到的氯化钠不纯,应采用什么试剂来检验?
2、你还记得以下离子的检验吗?
有白色沉淀生成
NaCl
+
AgNO3
=
AgCl↓+
NaNO3
检验H+
:
检验OH-
:
检验CO32-
:
检验CI-
:
试剂
现象
稀硝酸和AgNO3溶液
先加盐酸,产生的气体通入澄清石灰水
澄清石灰水变浑浊
紫色石蕊溶液
酚酞溶液
溶液变红
溶液变红
CaCl2+Na2CO3=CaCO3↓+2NaCl
Na2CO3溶液
CaCl2
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
NaOH溶液
MgCl2
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCl2溶液
硫酸盐
化学方程式
加入的试剂
杂质
思考与交流(P7)
⑴如果要除去粗盐中含有的可溶性杂质MgCl2
、CaCl2以及一些硫酸盐,应加入什么试剂?属分离还是提纯?
⑵加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可用什么方法把它们除去?
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
Na+
Cl-
Ca2+
OH-
Ba2+
Na+
Cl-
CO32-
OH-
Na+
Cl-
过量BaCl2
过量NaOH
过量Na2CO3
过滤
Na+
Cl-
适量HCl
试剂的先后顺序:
BaCl2
NaOH
Na2CO3
HCl
BaCl2
Na2CO3
NaOH
HCl
NaOH
BaCl2
Na2CO3
HCl
关键:
Na2CO3
溶液要在BaCl2
溶液后面,稀盐酸在最后。
在实际操作中,还要考虑所加试剂的先后顺序、试剂的用量,以及试剂过量后如何处理等。
思考2:还有其它的除杂方法吗?
2.混合物的分离和提纯的常用方法之“蒸馏和萃取”
蒸馏:利用液体沸点不同,提纯液态纯净物.
萃取:利用溶质在不同溶剂中的溶解度不同
分离溶液.
过滤:
蒸发:
从液体中分离出不溶性固体。
分离溶于溶剂中的固体溶质。
与“过滤、蒸发”的区别:
蒸馏瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、接受器(牛角器)等
蒸馏基本仪器:
蒸馏基本装置:
分析蒸馏过程
原理
根据液态物质沸点不同
液态混合物
气(易挥发)
液态纯净物
△
冷凝
问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶内物质?
控温显示加热范围
如:自来水蒸馏时温度≈100℃
冷凝收集
在100℃难于挥发,不挥发的杂质
蒸馏实验注意事项
①所盛液体不超过蒸馏瓶球部容积的
1/2
加热时,不能将液体蒸干
②温度计的水银球应位于蒸馏烧瓶的支管口下沿
③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸
④冷凝管中通冷却水时,下口(
),
上口(
)
进水
出水
萃取:液体混合物中一种溶质在两种互不相溶的溶剂里溶解性不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来.
概念分析:
混合物
溶质
溶剂
(一种)
(两种)
溶解性不同
两者互不相溶
萃取液
萃取
分液漏斗
分液
使用分液漏斗注意事项
1、使用前检查是否漏水。
2、加入萃取液后要先倒转分液漏斗用力振荡,
再静置。
3、分液时,上层液体由上口倒出,下层液体由
下端流出且分液漏斗下端紧贴烧杯内壁。
萃取剂选择条件
1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如,
CCl4(I2)>H2O
(I2)
3、不与被萃取的物质反应
如,
CCl4不与I2反应
不增:不引入新的杂质。
不变:不能改变被提纯物质的性质和质量尽量不减少。
易分:被提纯物与杂质易分离。
混合物的分离:
混合物的提纯:
将混合物中各物质用物理或化学方法将各成分彼此分开的过程。
将混合物中的杂质除去,以得到纯净物质的过程。物质提纯的原则为:不增、不变、易分。
3.混合物的分离和提纯的含义和区别
学与问(P5)
在分离和提纯物质时,要除掉杂质。化学上所指的杂质都是有害和无价值的吗?你能举例说明吗?
化学所指的杂质不一定是有害或无价值的,如水中含有一些物质和微量元素是对人体有益的。化学除杂,主要因为杂质的存在会影响某物质的利用价值(比如在化学反应中杂质的存在会引起一些副反应,或反应中杂质的存在会引起催化剂中毒等等)。
物理方法:过滤、蒸发、蒸馏、萃取、结晶、分液、渗析等
化学方法:灼烧、洗气、固体试剂吸收等
4.混合物的分离和提纯常用的方法和分类
按实质分:
按形式分:
物理方法:
2.按溶解度分:萃取、结晶
3.按沸点分:蒸馏、分馏、蒸发、升华
1.按溶解性分:过滤、分液
化学方法:
1.按热稳定性分:灼烧
2.按其它化学性质分:洗气、固体试剂吸收法等
4.按其它性质分:渗析
1.向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量氢氧化钠的溶液,又有白色沉淀生成;再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀
。原溶液中含有的离子可能是(
)
A.Ag+、Cu2+、Ba2+
B.Ag+、Ba2+、Mg2+
C.Ag+、Mg2+、Ca2+
D.Al3+、Mg2+、K+
BC
课堂练习:
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为(
)
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
D
3.有A、B、C、D四种溶液,它们各为K2CO3、K2SO4、NaHSO4、Ba(NO3)2中的一种.现进行下列实验:
A+C无明显变化;A+D无明显变化;B+D生成溶液及沉淀物E;B+C生成溶液F及沉淀,少量E溶于过量F中,生成溶液并放出气体.
由此可以确定A是
,B是
,
C是
,D是
.
K2CO3
K2SO4
NaHSO4
Ba(NO3)2
4.为了除去粗盐中的
Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是(
CD
)
①过滤
②加过量的
NaOH溶液
③加适量盐酸
④加过量
Na2C03溶液
⑤加过量
BaCl2溶液
A
①④②⑤③
B
④①②⑤③
C
②⑤④①③
D
⑤②④①③
第一章
从实验学化学
第一节
化学实验基本方法
?化学实验安全?
1、遵守实验室规则
本校实验室规则:
①进实验室前,
应先预习实验,
明确实验目
的、原理和方法,
严禁不预习进实验室;
②严禁将饮食或餐具带进实验室,更不能
将实验器皿当作餐具使用;
③使用电器要谨防触电,不要用湿手触摸
电器;
④绝不允许将几种试剂或药品随意混合,以
免发生爆炸、灼伤等事故;
⑤实验过程中,应严格遵守各项实验操作规
程,
严禁随意进行无关实验,
不得大声喧哗;
⑥有意外事故,应及时向老师报告;
⑦实验结束,应将仪器洗净,整理清洁实验
台,关好水龙头、抽风机,拉开电刀闸,
检查完毕实验室,把手洗净才能离开;
(1)了解一些常用危险化学品的标志
2、了解安全措施
(2)实验安全注意事项
①不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不能尝试任何药品的味道;
②使用易燃试剂一定要远离火源;
③加热或倾倒液体时,切勿俯视容器,以免液体飞溅造成伤害,加热试管时,切勿将试管口向着自己或他人;
④有加热与洗气(或气体吸收)装置的实验要防止液体倒吸;
⑥做有毒气体实验时,应在通风橱中进行,并进行尾气处理(吸收或点燃);
⑤稀释浓酸,特别是浓硫酸时一定要将浓酸缓慢注入水中并不断搅拌以散发热量;
⑦点燃可燃性气体前要验纯。
①浓酸洒在实验台上,
先用NaHCO3溶液冲洗,
后用水冲洗;浓硫酸溅到皮肤上,
立即用大
量水冲洗,
再用3%~5%的NaHCO3溶液冲洗.
严重的须就医;
②浓碱洒在实验台上,先用稀醋酸中和,然后
用水冲洗干净。浓碱沾在皮肤上,先用水冲
洗,再涂硼酸溶液。严重时要就医;
③酒精及其他易燃有机物小面积失火,应迅速
用湿抹布扑灭,烫伤(灼伤)要就医。
(3)化学实验过程中意外事故的处理
(C)液溴有毒且易挥发,需盛放在磨口的细口瓶里,并加些水(水覆盖在液溴上面),起水封作用。
(1)几种特殊试剂的存放
3、掌握正确的操作方法
(A)钾、钙、钠在空气中极易氧化,遇水发生剧烈反应放在盛有煤油的广口瓶中以隔绝空气。
(B)白磷着火点低(40℃),在空气中能缓慢氧化而自燃,通常保存在冷水中。
(F)氢氧化钠固体易潮解,应盛放在易于密封的干燥广口瓶中保存;其溶液盛放在无色细口瓶里,瓶口都用橡皮塞塞紧,不能用玻璃塞。
(D)碘易升华且具有强烈刺激性气味,盛放在磨口的广口瓶里。
(E)浓硝酸、硝酸银见光易分解,应保存在棕色瓶中,贮放在黑暗而且温度低的地方。
例:指出下列操作的错误
(2)药品的取用
固体药品:粉状固体用药匙或小纸条直接送入仪器底部。块状固体用镊子缓缓从容器口滑到底部。不特殊说明用量时,取1~2g,定量时用天平称量。
液体药品:
少量液体用胶头滴管,
滴管口与容器口不能相碰(正中上方滴入).
多量液体可倾倒,
应手握标签.
不特殊说明用量时,
取1~2mL.
定量时用量筒量.
①定量试纸
pH试纸,使用时不可用蒸馏水湿润。
(3)试纸的使用
②定性试纸
蓝色或红色石蕊试纸,淀粉碘化钾试纸和品红试纸等,使用时应先用蒸馏水湿润。
a、检验溶液时,一般先把一小块试纸放在表面皿或玻璃片上,用沾有待测溶液的玻璃棒点试纸的中部,观察颜色的变化,判断溶液的性质。
b、检验气体时,一般先用蒸馏水把试纸润湿。粘在玻璃棒的一端,用玻璃棒把试纸放到盛有待测气体的试管口(注意不要接触),观察试纸的颜色变化情况来判断气体的性质。
注意:使用试纸时,不可将试纸直接插入待测液
可直接加热的仪器:☆
试管、蒸发皿
、坩埚、燃烧匙
坩埚
(4)加热的方法
强调
可直接加热的仪器:☆
试管、蒸发皿
、坩埚、燃烧匙
需垫石棉网加热的仪器:
烧杯、烧瓶、锥形瓶
不能加热的仪器:
量筒、集气瓶、漏斗、温度计、滴瓶、表面皿、广口瓶、细口瓶等
加热的思考:
1、点燃酒精灯时用旁边同学的酒精灯点燃?
2、能不能用酒精少于1/3的酒精灯加热?
3、直接用口吹灭酒精灯?
4、给液体加热时,液体不超试管体积多少?
5、热的容器直接放实验台或直接用水冲洗?
6、点燃H2、CO、CH4等易燃气体前应该?
1/3
验纯
例:指出下列操作中的错误
②给试管里的药品,
必须先进行预热,
以免试管炸裂.
如果试管里的药品是液体,
液体体积不要超过试管容积的1/3,
使试管口向上约45?角倾斜,
切不可使试管口朝者自己或有人的方向,
以免液体沸腾喷出伤人.
如果试管里的药品是固体,
要使试管口朝下倾斜,
以免试管内有水倒流炸裂试管.
③烧得很热的玻璃容器,不要立即用冷水冲洗,
否则可能破裂。也不要直接放在实验台上,应放在石棉网上。
(5)气体的收集
排气法
收集
排水法收集
向下排气法
密度小于
空气
向上排气法
密度大于
空气
难溶于水的气体
二、混合物的分离和提纯
思考与交流(P5)
1、利用什么方法和性质将金子与沙子分离?
2、如何分离铁屑和沙子?
根据金以单质形态存在、密度比沙大的性质,可以用水洗法将金子从沙里分离出来。
可以用磁铁吸取的方法将铁屑和沙分离开来。
过滤:
蒸发:
从液体中分离出不溶性固体。
分离溶于溶剂中的固体溶质。
以“粗盐的提纯”来复习和拓展(请同学们阅读P5实验1—1,找出粗盐的主要成分及所含杂质。)
杂质:不溶性的泥沙,可溶性的
CaCl2、MgCl2、硫酸盐等
主要成分:NaCl
提纯
NaCl
晶体
1.混合物的分离和提纯的常用方法之“过滤和蒸发”
粗盐的提纯:
水分蒸发,逐渐析出固体。
⒊蒸发:将滤液倒入蒸发皿,然后用酒精灯加热,同时用玻璃棒不断搅拌溶液,当容器内余少量液体时,停止加热,利用余热加热蒸干。
不溶物留再滤纸上,液体渗过滤纸,沿漏斗颈流入另一烧杯中。
⒉
过滤:将烧杯中的液体沿玻璃棒倒入过滤器中过滤。若滤液浑浊,再过滤一次。
粗盐逐渐溶解而减少,食盐水略显浑浊。
⒈
溶解:称取约4g的粗盐加到约12g水中,用玻璃棒轻轻搅拌,直至粗盐不再溶解为止。
现
象
步
骤
“一贴”:滤纸用水润湿紧贴漏斗
的内壁,中间不留有气泡。
“二低”:滤纸的边缘低于漏斗
口,
漏斗里的液体低于滤纸的边缘
“三靠”:倾倒液体的烧杯尖口要
紧靠玻璃棒,玻璃棒的末端轻靠
在三层滤纸的一边,漏斗下端的
管口靠烧杯内壁。
若:滤液浑浊应再过滤一次
2、过滤:
3、蒸发
(1)蒸发皿的液体不超过容积的2/3
(2)加热时,用玻璃棒不断搅拌
(3)当容器内余少量液体时,停止加热,
利用余热加热蒸干。
(4)取下未冷却的蒸发皿时,要
放在石棉网上。
(为什么?)
防止由于局部温度过高,造成液体飞溅。
(为什么?)
防止由于局部温度过高,造成晶体溅出。
问题讨论:
[实验1-1]得到的盐是纯净的NaCl吗?可能还有什么杂质没有除去?用什么方法可以检验它们呢?
纯净的NaCl
粗盐
溶
解
悬浊液(泥沙、NaCl、MgCl2、CaCl2、硫酸盐)
不溶性杂质
NaCl、MgCl2、CaCl2、硫酸盐的溶液
蒸
发
过
滤
1、如何检验未知溶液中是否含有SO42-
?
实验1-2
取【实验1-1】得到的盐约0.5g放入试管中,向试管中加入约2
mL水配成溶液,先加稀盐酸使溶液酸化,然后向试管中滴入几滴BaCl2溶液。观察现象。
现象:
有白色沉淀生成
化学方程式:
BaCl2+Na2SO4=BaSO4↓+2NaCl
离子的检验:
试剂:稀盐酸和BaCl2溶液(先后顺序不限)
加入稀盐酸的原因:排除CO32-对SO42-检验的干扰。
思考1:还能通过检验哪些离子来说明所得到的氯化钠不纯,应采用什么试剂来检验?
2、你还记得以下离子的检验吗?
有白色沉淀生成
NaCl
+
AgNO3
=
AgCl↓+
NaNO3
检验H+
:
检验OH-
:
检验CO32-
:
检验CI-
:
试剂
现象
稀硝酸和AgNO3溶液
先加盐酸,产生的气体通入澄清石灰水
澄清石灰水变浑浊
紫色石蕊溶液
酚酞溶液
溶液变红
溶液变红
CaCl2+Na2CO3=CaCO3↓+2NaCl
Na2CO3溶液
CaCl2
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
NaOH溶液
MgCl2
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCl2溶液
硫酸盐
化学方程式
加入的试剂
杂质
思考与交流(P7)
⑴如果要除去粗盐中含有的可溶性杂质MgCl2
、CaCl2以及一些硫酸盐,应加入什么试剂?属分离还是提纯?
⑵加入你选择的试剂除掉杂质后,有没有引入其他离子?想一想可用什么方法把它们除去?
Ca2+
Mg2+
SO42-
Na+
Cl-
Ca2+
Mg2+
Ba2+
Na+
Cl-
Ca2+
OH-
Ba2+
Na+
Cl-
CO32-
OH-
Na+
Cl-
过量BaCl2
过量NaOH
过量Na2CO3
过滤
Na+
Cl-
适量HCl
试剂的先后顺序:
BaCl2
NaOH
Na2CO3
HCl
BaCl2
Na2CO3
NaOH
HCl
NaOH
BaCl2
Na2CO3
HCl
关键:
Na2CO3
溶液要在BaCl2
溶液后面,稀盐酸在最后。
在实际操作中,还要考虑所加试剂的先后顺序、试剂的用量,以及试剂过量后如何处理等。
思考2:还有其它的除杂方法吗?
2.混合物的分离和提纯的常用方法之“蒸馏和萃取”
蒸馏:利用液体沸点不同,提纯液态纯净物.
萃取:利用溶质在不同溶剂中的溶解度不同
分离溶液.
过滤:
蒸发:
从液体中分离出不溶性固体。
分离溶于溶剂中的固体溶质。
与“过滤、蒸发”的区别:
蒸馏瓶、温度计、冷凝管、酒精灯、锥形瓶、沸石、接受器(牛角器)等
蒸馏基本仪器:
蒸馏基本装置:
分析蒸馏过程
原理
根据液态物质沸点不同
液态混合物
气(易挥发)
液态纯净物
△
冷凝
问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶内物质?
控温显示加热范围
如:自来水蒸馏时温度≈100℃
冷凝收集
在100℃难于挥发,不挥发的杂质
蒸馏实验注意事项
①所盛液体不超过蒸馏瓶球部容积的
1/2
加热时,不能将液体蒸干
②温度计的水银球应位于蒸馏烧瓶的支管口下沿
③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸
④冷凝管中通冷却水时,下口(
),
上口(
)
进水
出水
萃取:液体混合物中一种溶质在两种互不相溶的溶剂里溶解性不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来.
概念分析:
混合物
溶质
溶剂
(一种)
(两种)
溶解性不同
两者互不相溶
萃取液
萃取
分液漏斗
分液
使用分液漏斗注意事项
1、使用前检查是否漏水。
2、加入萃取液后要先倒转分液漏斗用力振荡,
再静置。
3、分液时,上层液体由上口倒出,下层液体由
下端流出且分液漏斗下端紧贴烧杯内壁。
萃取剂选择条件
1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如,
CCl4(I2)>H2O
(I2)
3、不与被萃取的物质反应
如,
CCl4不与I2反应
不增:不引入新的杂质。
不变:不能改变被提纯物质的性质和质量尽量不减少。
易分:被提纯物与杂质易分离。
混合物的分离:
混合物的提纯:
将混合物中各物质用物理或化学方法将各成分彼此分开的过程。
将混合物中的杂质除去,以得到纯净物质的过程。物质提纯的原则为:不增、不变、易分。
3.混合物的分离和提纯的含义和区别
学与问(P5)
在分离和提纯物质时,要除掉杂质。化学上所指的杂质都是有害和无价值的吗?你能举例说明吗?
化学所指的杂质不一定是有害或无价值的,如水中含有一些物质和微量元素是对人体有益的。化学除杂,主要因为杂质的存在会影响某物质的利用价值(比如在化学反应中杂质的存在会引起一些副反应,或反应中杂质的存在会引起催化剂中毒等等)。
物理方法:过滤、蒸发、蒸馏、萃取、结晶、分液、渗析等
化学方法:灼烧、洗气、固体试剂吸收等
4.混合物的分离和提纯常用的方法和分类
按实质分:
按形式分:
物理方法:
2.按溶解度分:萃取、结晶
3.按沸点分:蒸馏、分馏、蒸发、升华
1.按溶解性分:过滤、分液
化学方法:
1.按热稳定性分:灼烧
2.按其它化学性质分:洗气、固体试剂吸收法等
4.按其它性质分:渗析
1.向某溶液中加入过量盐酸生成白色沉淀,过滤后向滤液中加入过量氢氧化钠的溶液,又有白色沉淀生成;再过滤后向滤液中加入碳酸钠溶液,又生成白色沉淀
。原溶液中含有的离子可能是(
)
A.Ag+、Cu2+、Ba2+
B.Ag+、Ba2+、Mg2+
C.Ag+、Mg2+、Ca2+
D.Al3+、Mg2+、K+
BC
课堂练习:
2.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为(
)
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
D
3.有A、B、C、D四种溶液,它们各为K2CO3、K2SO4、NaHSO4、Ba(NO3)2中的一种.现进行下列实验:
A+C无明显变化;A+D无明显变化;B+D生成溶液及沉淀物E;B+C生成溶液F及沉淀,少量E溶于过量F中,生成溶液并放出气体.
由此可以确定A是
,B是
,
C是
,D是
.
K2CO3
K2SO4
NaHSO4
Ba(NO3)2
4.为了除去粗盐中的
Ca2+、Mg2+、SO42-及泥砂,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是(
CD
)
①过滤
②加过量的
NaOH溶液
③加适量盐酸
④加过量
Na2C03溶液
⑤加过量
BaCl2溶液
A
①④②⑤③
B
④①②⑤③
C
②⑤④①③
D
⑤②④①③
