2020-2021学年高二化学人教版选修五2.2芳香烃 课件 (共59张ppt)
文档属性
| 名称 | 2020-2021学年高二化学人教版选修五2.2芳香烃 课件 (共59张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-09 14:00:13 | ||
图片预览








文档简介
(共60张PPT)
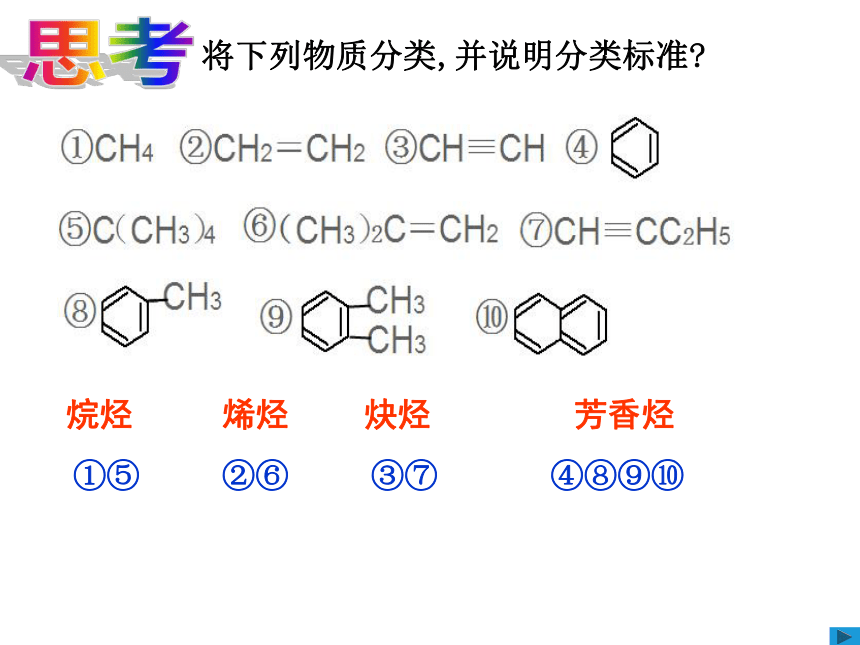
将下列物质分类,并说明分类标准?
①⑤
②⑥
③⑦
④⑧⑨⑩
烷烃
烯烃
炔烃
芳香烃
【复习】什么叫芳香烃?最简单的芳香烃是哪种物质?
分子中含有一个或多个苯环的一类烃属于芳香烃。
最简单的芳香烃是:
苯
甲苯
萘
蒽
C7H8
C10H8
C14H10
一、苯的结构与化学性质
比例模型
大
π
键模型
σ键模型
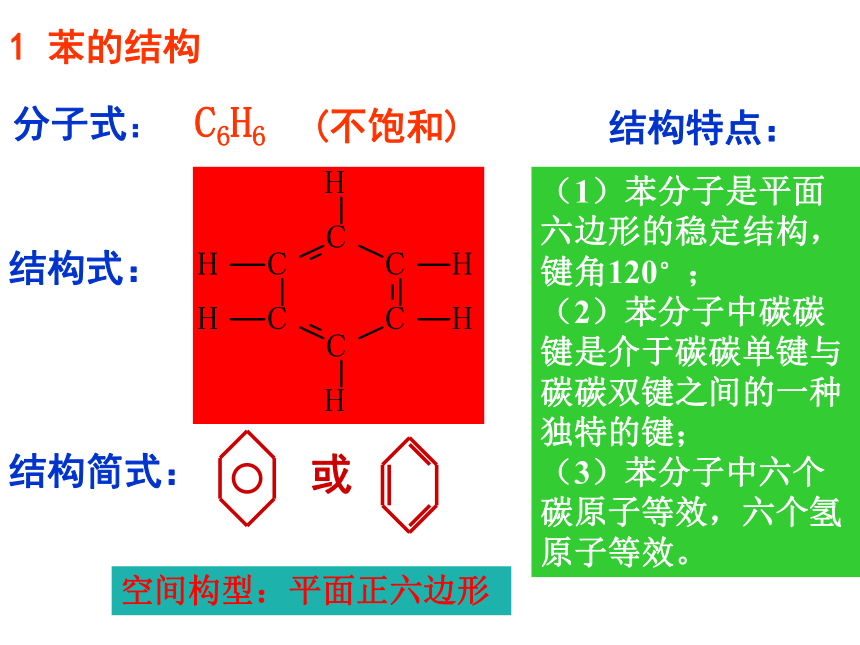
分子式:
C6H6
(不饱和)
结构简式:
或
结构式:
(1)苯分子是平面六边形的稳定结构,键角120°;
(2)苯分子中碳碳键是介于碳碳单键与碳碳双键之间的一种独特的键;
(3)苯分子中六个碳原子等效,六个氢原子等效。
结构特点:
空间构型:平面正六边形
1
苯的结构
【练习】(1)1866年凯库勒提出了苯的单双键交替的正六边形平面结构(如图所示),解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是
A、苯不能使溴水褪色
B、苯能与H2发生加成反应
C、溴苯没有同分异构体
D、邻二溴苯只有一种
AD
(2)现代化学认为苯分子碳碳之间的键是
是介于单键和双键之间的一种独特的键
2
苯的物理性质
状态:
颜色:
气味:
毒性:
水溶性:
挥发性:
密度:
液态
无色
有特殊气味
有毒
不溶于水
易挥发
比水小
性质
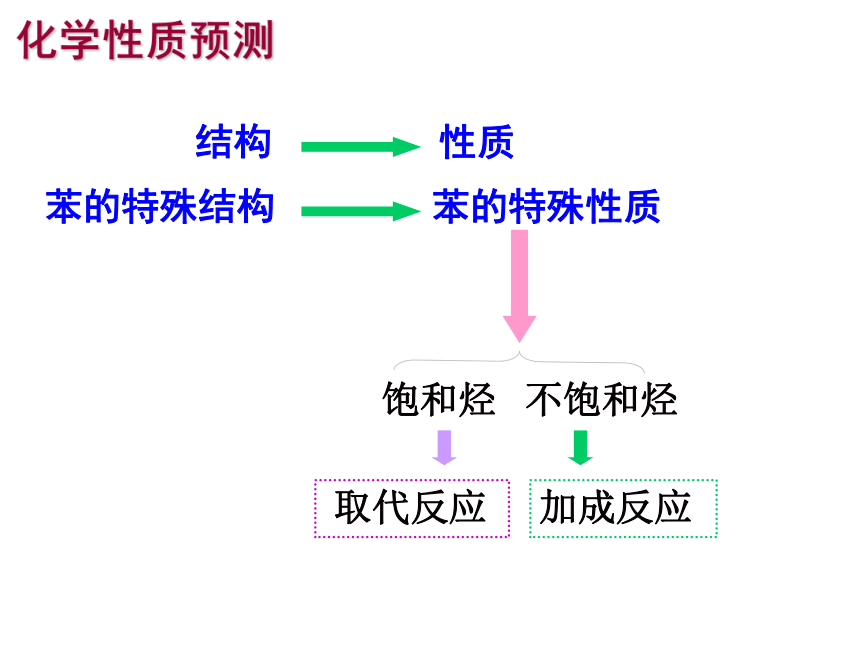
苯的特殊结构
苯的特殊性质
饱和烃
不饱和烃
取代反应
加成反应
结构
化学性质预测
3
苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
【实验表明】苯不能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色。
1.苯与溴不反应,但溴水层却变浅,Why?
2.
苯燃烧时产生的黑烟为什么比乙烯多?原因?
写出苯与氧气反应,与氢气加成,
与溴和浓硝酸发生取代的化学方程式。(P37)
点燃
【1】氧化反应
(1)燃烧
——火焰明亮并带有浓烟
(2)与酸性KMnO4的作用--
不反应
2C6H6
+
15O2
12CO2
+
6H2O
→
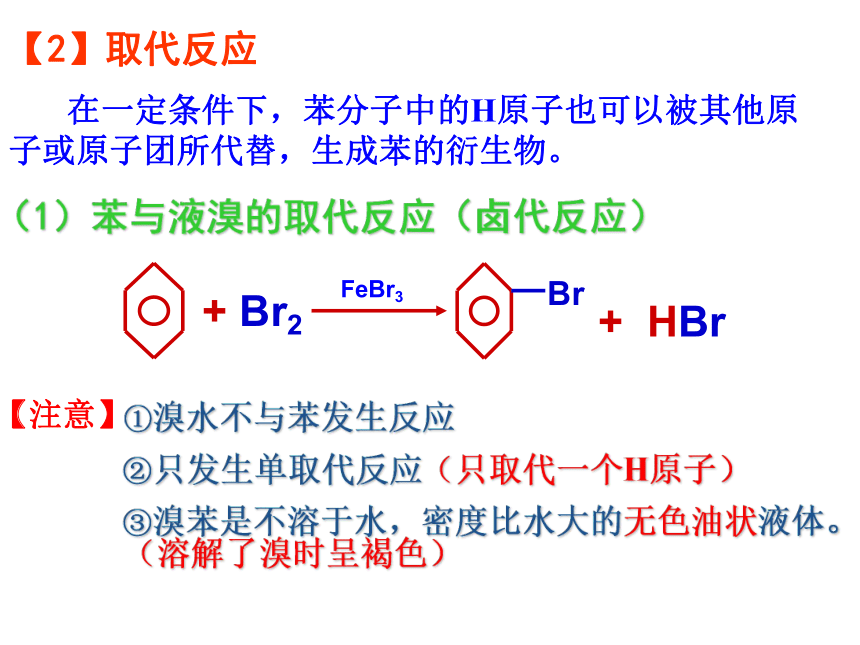
在一定条件下,苯分子中的H原子也可以被其他原子或原子团所代替,生成苯的衍生物。
(1)苯与液溴的取代反应(卤代反应)
+
Br2
Br
+
HBr
FeBr3
【注意】
①溴水不与苯发生反应
②只发生单取代反应(只取代一个H原子)
③溴苯是不溶于水,密度比水大的无色油状液体。(溶解了溴时呈褐色)
【2】取代反应
(2)苯与浓硝酸的取代反应(硝化反应)
浓硫酸
+
HNO3
50~60
oC
NO2
+
H2O
纯净的硝基苯是无色而有苦杏仁气味的油状液体,不溶于水,密度比水大。有毒。
浓硫酸作用:催化剂、吸水剂
加热方式:水浴加热,便于控制温度
-SO3H叫磺酸基。
磺化反应:苯分子里的氢原子被硫酸分子里的磺酸基所取代的反应。
苯磺酸
浓硫酸
(3)苯与浓硫酸的取代反应(磺化反应)
由于苯分子的碳碳键介于单键与双键之间,所以在一定条件下,苯仍可以与某些物质发生加成反应。
(1)苯与氢气的加成反应
环已烷
+
3H2
Ni
Δ
【3】加成反应
(2)苯与氯气的加成反应
+
3Cl2
光
Δ
Cl
Cl
Cl
Cl
Cl
Cl
苯分子中碳碳原子是介于碳碳单键和碳碳双键之间的特殊的键,所以其化学性质就既能像烷烃那样易发生卤代、硝化反应等,也能像烯烃那样发生加成反应。
能燃烧
易取代
难氧化
难加成
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案。
1.选用装置
2.加入药品的顺序
3.如何控温
4.产物提纯等
请同学们设计实验时,考虑以下问题:
1.溴是一种易挥发有剧毒的药品
2.溴与苯的反应非常缓慢,常用铁粉作为催化剂
3.该反应是放热反应,不需要加热
【苯与溴的实验设计】
A
C
D
2Fe
+
3Br2
=
2FeBr3
+
Br2
Br
+
HBr
FeBr3
AgNO3
+HBr
=
AgBr↓
+HNO3
【设计制备溴苯实验方案】
【主要仪器】圆底烧瓶、长导管、锥形瓶、铁架台等
【药品】苯、液溴、铁粉、硝酸银溶液
【反应原理】取代反应。实际起催化作用的是FeBr3
【设计制备溴苯实验方案】
【实验步骤】把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口,跟瓶口垂直的一段导管可以兼起冷凝器的作用。
【实验现象】
烧瓶中出现
;在导管口附近出现
。反应完毕后,向锥形瓶里的液体滴入AgNO3溶液,有
。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有
的液体。
红棕色
白雾
浅黄色沉淀
褐色不溶于水
【苯与溴的反应实验思考】
1、试剂的加入顺序怎样?各试剂在反应中所起到的作用?
A、为防止溴的挥发,先加入苯后加入溴,然后加入铁粉。
B、溴应是纯溴,而不是溴水。加入铁粉起催化作用,实际上起催化作用的是FeBr3。
2、导管为什么要这么长?其末端为何不插入液面?
C、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
D、导管末端不可插入锥形瓶内水面以下,因为HBr气体易溶于水,以免倒吸。
3、反应后的产物是什么?如何分离?
E、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。除去溴苯中的溴可加入NaOH溶液,振荡,再用分液漏斗分离。
4.哪些现象说明发生了取代反应而不是加成反应?
苯与溴反应生成溴苯的同时有溴化氢生成。
【苯与溴的反应实验思考】
从反应方程式得知产物中有溴化氢,我们要检验该产物
1.反应最后苯和溴会有剩余它们易挥发
2.长导管在很多实验中被用作冷凝蒸气使之回流
3.溴化氢的性质与氯化氢相似
1.用什么试剂去检验?现象是什么?
2.
检验过程中有没有其他物质干扰,有的话如何解决问题?
3.可否对实验装置进行改进?
【苯与溴的实验设计】
【苯与溴的改进实验1】
【苯与溴的改进实验2】
硝基苯:无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
【设计苯的硝化反应实验】
1.苯与硝酸的反应在50
℃
--60℃
时产物是硝基苯,温度过高会有副产物。
2.
硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4
.苯和硝酸都易挥发。
【实验步骤】
在一个大试管里,先加入1.5毫升浓硝酸和2毫升浓硫酸,摇匀,冷却到50—60℃以下,然后慢慢地滴入1毫升苯,不断摇动,使混和均匀,然后放在60℃的水浴中加热10分钟,把混和物倒入另一个盛水的试管里。
【实验现象】烧杯中有黄色油状物生成。用蒸馏水和氢氧化钠溶液洗涤分液,得纯硝基苯。
【设计苯的硝化反应实验方案】
【苯的硝化反应实验思考】
1、如何混合硫酸和硝酸的混合液?
①
先将浓硝酸注入大试管中,再慢慢注入浓硫酸,并及时摇匀和冷却。②
向冷却到50-60℃后的混酸中逐滴加入苯,充分振荡,混和均匀。切不可将浓硝酸注入浓硫酸中,因混和时要放出大量的热量,以免浓硫酸溅出,发生事故。
2、为何要水浴加热,并将温度控制在60℃?
②
水浴的温度一定要控制在60℃以下,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸反应生成苯磺酸等副反应。
③浓硫酸的作用:催化剂和吸水剂。
④反应装置中的温度计,应插入水浴液面以下,以测量水浴温度。(温度计下端不能触及烧杯底部及烧杯壁)
⑤把反应的混合物倒入一个盛水的烧杯里,烧杯底部聚集淡黄色的油状液体,这是因为在硝基苯中溶有NO2的缘故。除去杂质提纯硝基苯,可将粗产品依次用蒸馏水和NaOH溶液洗涤,再用分液漏斗分液。
3、浓硫酸的作用?
4、温度计的位置?
5、如何得到纯净的硝基苯?
【苯的硝化反应实验思考】
观察下列5种物质,分析它们的结构回答
其中①、③、⑤的关系是
.
其中②、④、⑤的关系是
.
同分异构体
同系物
二
苯的同系物
1
苯的同系物:
具有苯环(1个)结构,且在分子组成上相差一个或若干个CH2原子团的有机物。
通式:CnH2n-6(n≥6)
CH3
CH2CH3
甲苯
乙苯
苯环上的氢原子被烷烃基取代的产物。
下列物质属于苯的同系物是(
)
A.
B.
C.
D.
B
1.苯的化学性质有哪些?
2.比较苯和甲苯结构的异同点,推测甲苯的化学性质。
苯与甲苯性质比较
苯的同系物太多了不可能全部去研究怎么办呢?
苯的同系物不溶于水,并比水轻,
溶于酒精。
同苯一样,能使溴水水层颜色变浅,但不是发生化学
反应,而是因为萃取褪色。
【1】苯的同系物的氧化反应
⑴可燃性
⑵可使酸性高锰酸钾溶液褪色
2
苯的同系物的化学性质
【实验2-2】
1.
取一支试管,向其中加入2ml苯,再加入3滴酸性高锰酸钾溶液,振荡试管,观察现象。
2.
取一支试管,向其中加入2ml甲苯,再加入3滴酸性高锰酸钾溶液,振荡试管,观察现象。
现象
结论
苯+酸性
高锰酸钾
甲苯+酸性
高锰酸钾
酸性高锰酸钾溶液褪色
酸性高锰酸
钾溶液不褪色
苯不能被酸性高锰酸钾氧化
?
苯不能使酸性高锰酸钾溶液褪色,但是甲苯却可以使酸性高锰酸钾溶液褪色。对比苯、甲苯的结构特点,思考:可能是什么原因导致了以上现象?
苯环的存在对连在苯环上的烷基产生了影响,使烷基易被酸性高锰酸钾溶液氧化。
现象探究
等不能使酸性高锰酸钾溶液褪色
事实证明
等能使酸性高锰酸钾溶液褪色
综上所述:你又能找到什么规律?
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
苯的同系物烷基上与苯环相连的碳上至少有一个氢原子
H
|
—C—H
|
H
H
|
|
—C—C—
|
|
H
C
|
—C—C
|
C
×
苯的同系物使酸性高锰酸钾溶液褪色的条件
√
√
【设计实验】
如何鉴别苯、甲苯、己烯、CCl4?
加入溴水,褪色的是己烯;
分层后上层是红棕色,下层是无色的是苯和甲苯;
下层是红棕色的是四氯化碳。
向苯和甲苯中加入高锰酸钾溶液,褪色的是甲苯,不褪色的是苯。
分别写出对二甲苯,均三甲苯与酸性高锰酸钾溶液
反应后的产物。
从上组反应中我们看到甲基受苯环影响使得甲基易被氧化;那么苯环的化学性质有没有受到甲基的影响呢?
阅读课本P
38
实验以下的内容填表
温度
生成物
苯
甲苯
50℃-
60℃
30℃
硝基苯
邻、对位
硝基甲苯
甲苯的硝化反应比苯更容易进行
苯的同系物的苯环易发生取代反应,烷基使苯环的邻,对位的H更活泼。
【2】
苯的同系物的取代反应
1
苯的同系物的硝化反应
一种淡黄色的晶体,不溶于水。不稳定,易爆炸。它是一种烈性炸药,广泛用于国防、开矿、筑路、兴修水利等。
2,4,6-三硝基甲苯
CH3
CH3
NO2
-NO2
O2N-
+3HO-NO2
3H2O
+
浓H2SO4
△
TNT
炸
药
爆
炸
时
的
场
景
请问:条件一和条件二分别指的是什么条件?
2
苯的同系物的卤化反应
光照
FeCl3
光照条件下,取代烷基碳上的氢
卤化铁催化时,取代苯环上的氢
比较苯和甲苯与KMnO4溶液的作用,以及取代反应的条件与产物,你从中得到什么启示?
侧链和苯环相互影响:
侧链受苯环影响易被氧化;
苯环受侧链影响易被取代。
【结论】
苯的同系物也和氢气可以发生加成反应
请写出甲苯与氢气加成的化学方程式:
【3】苯的同系物加成反应
1
来源:
三
芳香烃的来源及其应用
a、煤的干馏
b、石油的催化重整
简单的芳香烃是基本的有机化工原料。
2
应用:
2
稠环芳香烃
萘
蒽
C10H8
C14H10
萘是无色片状晶体,具有特殊的气味,易升华,曾经用来防蛀、驱虫,但因它有一定的毒性,现已禁止使用。萘是一种主要的化工原料。
蒽也是一种无色的晶体,
易升华,是生产染料的主要原料。
菲
苯并芘
稠环芳香烃:由两个或两个以上的苯环共用相邻的2个碳原子而成的一类芳香烃。
讨论甲苯与液氯在不同的条件下可发生哪些反应?
1.已知分子式为C12H12的物质A结构简式为
则A环上的一溴代物有
(
)
A、2种
B、3种
C、4种
D、6种
B
2.直链烷烃的通式可用CnH2n+2表示,现有一系列芳香烃,按下列特点排列:
,
,
,……
若用通式表示这一系列化合物,其通式应为(
)
A、CnH2n-6
B、C6n+4H2n+6
C、C4n+6H2n+6
D、C2n+4H6n+6
B
等物质的量的下列烃分别完全燃烧,消耗氧气最多的是(?
??
)
?
A、甲烷?????
B、乙烯???
??
C、苯??
???
D、乙炔
C
等质量呢?
A
烃燃烧耗氧量规律:等物质的量看C和H原子个数;等质量看含H量.
【归纳】
烃
链烃
环烃
饱和链烃
不饱和链烃
脂环烃
芳香烃
(脂肪烃)
烷烃
烯烃
二烯烃
炔烃
苯的同系物
稠环芳烃
其它芳烃
环烷烃等
对比与归纳
烷
烯
苯
与Br2作用
Br2试剂
反应条件
反应类型
与KMnO4作用
点燃
现象
结论
纯溴
溴水
纯溴
溴水
光照
取代
加成
Fe粉
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被KMnO4氧化
易被KMnO4氧化
苯环难被KMnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
将下列物质分类,并说明分类标准?
①⑤
②⑥
③⑦
④⑧⑨⑩
烷烃
烯烃
炔烃
芳香烃
【复习】什么叫芳香烃?最简单的芳香烃是哪种物质?
分子中含有一个或多个苯环的一类烃属于芳香烃。
最简单的芳香烃是:
苯
甲苯
萘
蒽
C7H8
C10H8
C14H10
一、苯的结构与化学性质
比例模型
大
π
键模型
σ键模型
分子式:
C6H6
(不饱和)
结构简式:
或
结构式:
(1)苯分子是平面六边形的稳定结构,键角120°;
(2)苯分子中碳碳键是介于碳碳单键与碳碳双键之间的一种独特的键;
(3)苯分子中六个碳原子等效,六个氢原子等效。
结构特点:
空间构型:平面正六边形
1
苯的结构
【练习】(1)1866年凯库勒提出了苯的单双键交替的正六边形平面结构(如图所示),解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是
A、苯不能使溴水褪色
B、苯能与H2发生加成反应
C、溴苯没有同分异构体
D、邻二溴苯只有一种
AD
(2)现代化学认为苯分子碳碳之间的键是
是介于单键和双键之间的一种独特的键
2
苯的物理性质
状态:
颜色:
气味:
毒性:
水溶性:
挥发性:
密度:
液态
无色
有特殊气味
有毒
不溶于水
易挥发
比水小
性质
苯的特殊结构
苯的特殊性质
饱和烃
不饱和烃
取代反应
加成反应
结构
化学性质预测
3
苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
【实验表明】苯不能使高锰酸钾酸性溶液和溴的四氯化碳溶液褪色。
1.苯与溴不反应,但溴水层却变浅,Why?
2.
苯燃烧时产生的黑烟为什么比乙烯多?原因?
写出苯与氧气反应,与氢气加成,
与溴和浓硝酸发生取代的化学方程式。(P37)
点燃
【1】氧化反应
(1)燃烧
——火焰明亮并带有浓烟
(2)与酸性KMnO4的作用--
不反应
2C6H6
+
15O2
12CO2
+
6H2O
→
在一定条件下,苯分子中的H原子也可以被其他原子或原子团所代替,生成苯的衍生物。
(1)苯与液溴的取代反应(卤代反应)
+
Br2
Br
+
HBr
FeBr3
【注意】
①溴水不与苯发生反应
②只发生单取代反应(只取代一个H原子)
③溴苯是不溶于水,密度比水大的无色油状液体。(溶解了溴时呈褐色)
【2】取代反应
(2)苯与浓硝酸的取代反应(硝化反应)
浓硫酸
+
HNO3
50~60
oC
NO2
+
H2O
纯净的硝基苯是无色而有苦杏仁气味的油状液体,不溶于水,密度比水大。有毒。
浓硫酸作用:催化剂、吸水剂
加热方式:水浴加热,便于控制温度
-SO3H叫磺酸基。
磺化反应:苯分子里的氢原子被硫酸分子里的磺酸基所取代的反应。
苯磺酸
浓硫酸
(3)苯与浓硫酸的取代反应(磺化反应)
由于苯分子的碳碳键介于单键与双键之间,所以在一定条件下,苯仍可以与某些物质发生加成反应。
(1)苯与氢气的加成反应
环已烷
+
3H2
Ni
Δ
【3】加成反应
(2)苯与氯气的加成反应
+
3Cl2
光
Δ
Cl
Cl
Cl
Cl
Cl
Cl
苯分子中碳碳原子是介于碳碳单键和碳碳双键之间的特殊的键,所以其化学性质就既能像烷烃那样易发生卤代、硝化反应等,也能像烯烃那样发生加成反应。
能燃烧
易取代
难氧化
难加成
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案。
1.选用装置
2.加入药品的顺序
3.如何控温
4.产物提纯等
请同学们设计实验时,考虑以下问题:
1.溴是一种易挥发有剧毒的药品
2.溴与苯的反应非常缓慢,常用铁粉作为催化剂
3.该反应是放热反应,不需要加热
【苯与溴的实验设计】
A
C
D
2Fe
+
3Br2
=
2FeBr3
+
Br2
Br
+
HBr
FeBr3
AgNO3
+HBr
=
AgBr↓
+HNO3
【设计制备溴苯实验方案】
【主要仪器】圆底烧瓶、长导管、锥形瓶、铁架台等
【药品】苯、液溴、铁粉、硝酸银溶液
【反应原理】取代反应。实际起催化作用的是FeBr3
【设计制备溴苯实验方案】
【实验步骤】把苯和少量液态溴放在烧瓶里,同时加入少量铁屑作催化剂。用带导管的瓶塞塞紧瓶口,跟瓶口垂直的一段导管可以兼起冷凝器的作用。
【实验现象】
烧瓶中出现
;在导管口附近出现
。反应完毕后,向锥形瓶里的液体滴入AgNO3溶液,有
。把烧瓶里的液体倒在盛有冷水的烧杯里,烧杯底部有
的液体。
红棕色
白雾
浅黄色沉淀
褐色不溶于水
【苯与溴的反应实验思考】
1、试剂的加入顺序怎样?各试剂在反应中所起到的作用?
A、为防止溴的挥发,先加入苯后加入溴,然后加入铁粉。
B、溴应是纯溴,而不是溴水。加入铁粉起催化作用,实际上起催化作用的是FeBr3。
2、导管为什么要这么长?其末端为何不插入液面?
C、伸出烧瓶外的导管要有足够长度,其作用是导气、冷凝。
D、导管末端不可插入锥形瓶内水面以下,因为HBr气体易溶于水,以免倒吸。
3、反应后的产物是什么?如何分离?
E、纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。除去溴苯中的溴可加入NaOH溶液,振荡,再用分液漏斗分离。
4.哪些现象说明发生了取代反应而不是加成反应?
苯与溴反应生成溴苯的同时有溴化氢生成。
【苯与溴的反应实验思考】
从反应方程式得知产物中有溴化氢,我们要检验该产物
1.反应最后苯和溴会有剩余它们易挥发
2.长导管在很多实验中被用作冷凝蒸气使之回流
3.溴化氢的性质与氯化氢相似
1.用什么试剂去检验?现象是什么?
2.
检验过程中有没有其他物质干扰,有的话如何解决问题?
3.可否对实验装置进行改进?
【苯与溴的实验设计】
【苯与溴的改进实验1】
【苯与溴的改进实验2】
硝基苯:无色,油状液体,苦杏仁味,有毒,密度大于水,难溶于水,易溶于有机溶剂。硝基苯蒸气有毒性。
【设计苯的硝化反应实验】
1.苯与硝酸的反应在50
℃
--60℃
时产物是硝基苯,温度过高会有副产物。
2.
硫酸是该反应的催化剂,和硝酸混合时剧烈放热。
3.反应过程中硝酸会部分分解。
4
.苯和硝酸都易挥发。
【实验步骤】
在一个大试管里,先加入1.5毫升浓硝酸和2毫升浓硫酸,摇匀,冷却到50—60℃以下,然后慢慢地滴入1毫升苯,不断摇动,使混和均匀,然后放在60℃的水浴中加热10分钟,把混和物倒入另一个盛水的试管里。
【实验现象】烧杯中有黄色油状物生成。用蒸馏水和氢氧化钠溶液洗涤分液,得纯硝基苯。
【设计苯的硝化反应实验方案】
【苯的硝化反应实验思考】
1、如何混合硫酸和硝酸的混合液?
①
先将浓硝酸注入大试管中,再慢慢注入浓硫酸,并及时摇匀和冷却。②
向冷却到50-60℃后的混酸中逐滴加入苯,充分振荡,混和均匀。切不可将浓硝酸注入浓硫酸中,因混和时要放出大量的热量,以免浓硫酸溅出,发生事故。
2、为何要水浴加热,并将温度控制在60℃?
②
水浴的温度一定要控制在60℃以下,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸反应生成苯磺酸等副反应。
③浓硫酸的作用:催化剂和吸水剂。
④反应装置中的温度计,应插入水浴液面以下,以测量水浴温度。(温度计下端不能触及烧杯底部及烧杯壁)
⑤把反应的混合物倒入一个盛水的烧杯里,烧杯底部聚集淡黄色的油状液体,这是因为在硝基苯中溶有NO2的缘故。除去杂质提纯硝基苯,可将粗产品依次用蒸馏水和NaOH溶液洗涤,再用分液漏斗分液。
3、浓硫酸的作用?
4、温度计的位置?
5、如何得到纯净的硝基苯?
【苯的硝化反应实验思考】
观察下列5种物质,分析它们的结构回答
其中①、③、⑤的关系是
.
其中②、④、⑤的关系是
.
同分异构体
同系物
二
苯的同系物
1
苯的同系物:
具有苯环(1个)结构,且在分子组成上相差一个或若干个CH2原子团的有机物。
通式:CnH2n-6(n≥6)
CH3
CH2CH3
甲苯
乙苯
苯环上的氢原子被烷烃基取代的产物。
下列物质属于苯的同系物是(
)
A.
B.
C.
D.
B
1.苯的化学性质有哪些?
2.比较苯和甲苯结构的异同点,推测甲苯的化学性质。
苯与甲苯性质比较
苯的同系物太多了不可能全部去研究怎么办呢?
苯的同系物不溶于水,并比水轻,
溶于酒精。
同苯一样,能使溴水水层颜色变浅,但不是发生化学
反应,而是因为萃取褪色。
【1】苯的同系物的氧化反应
⑴可燃性
⑵可使酸性高锰酸钾溶液褪色
2
苯的同系物的化学性质
【实验2-2】
1.
取一支试管,向其中加入2ml苯,再加入3滴酸性高锰酸钾溶液,振荡试管,观察现象。
2.
取一支试管,向其中加入2ml甲苯,再加入3滴酸性高锰酸钾溶液,振荡试管,观察现象。
现象
结论
苯+酸性
高锰酸钾
甲苯+酸性
高锰酸钾
酸性高锰酸钾溶液褪色
酸性高锰酸
钾溶液不褪色
苯不能被酸性高锰酸钾氧化
?
苯不能使酸性高锰酸钾溶液褪色,但是甲苯却可以使酸性高锰酸钾溶液褪色。对比苯、甲苯的结构特点,思考:可能是什么原因导致了以上现象?
苯环的存在对连在苯环上的烷基产生了影响,使烷基易被酸性高锰酸钾溶液氧化。
现象探究
等不能使酸性高锰酸钾溶液褪色
事实证明
等能使酸性高锰酸钾溶液褪色
综上所述:你又能找到什么规律?
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
苯的同系物烷基上与苯环相连的碳上至少有一个氢原子
H
|
—C—H
|
H
H
|
|
—C—C—
|
|
H
C
|
—C—C
|
C
×
苯的同系物使酸性高锰酸钾溶液褪色的条件
√
√
【设计实验】
如何鉴别苯、甲苯、己烯、CCl4?
加入溴水,褪色的是己烯;
分层后上层是红棕色,下层是无色的是苯和甲苯;
下层是红棕色的是四氯化碳。
向苯和甲苯中加入高锰酸钾溶液,褪色的是甲苯,不褪色的是苯。
分别写出对二甲苯,均三甲苯与酸性高锰酸钾溶液
反应后的产物。
从上组反应中我们看到甲基受苯环影响使得甲基易被氧化;那么苯环的化学性质有没有受到甲基的影响呢?
阅读课本P
38
实验以下的内容填表
温度
生成物
苯
甲苯
50℃-
60℃
30℃
硝基苯
邻、对位
硝基甲苯
甲苯的硝化反应比苯更容易进行
苯的同系物的苯环易发生取代反应,烷基使苯环的邻,对位的H更活泼。
【2】
苯的同系物的取代反应
1
苯的同系物的硝化反应
一种淡黄色的晶体,不溶于水。不稳定,易爆炸。它是一种烈性炸药,广泛用于国防、开矿、筑路、兴修水利等。
2,4,6-三硝基甲苯
CH3
CH3
NO2
-NO2
O2N-
+3HO-NO2
3H2O
+
浓H2SO4
△
TNT
炸
药
爆
炸
时
的
场
景
请问:条件一和条件二分别指的是什么条件?
2
苯的同系物的卤化反应
光照
FeCl3
光照条件下,取代烷基碳上的氢
卤化铁催化时,取代苯环上的氢
比较苯和甲苯与KMnO4溶液的作用,以及取代反应的条件与产物,你从中得到什么启示?
侧链和苯环相互影响:
侧链受苯环影响易被氧化;
苯环受侧链影响易被取代。
【结论】
苯的同系物也和氢气可以发生加成反应
请写出甲苯与氢气加成的化学方程式:
【3】苯的同系物加成反应
1
来源:
三
芳香烃的来源及其应用
a、煤的干馏
b、石油的催化重整
简单的芳香烃是基本的有机化工原料。
2
应用:
2
稠环芳香烃
萘
蒽
C10H8
C14H10
萘是无色片状晶体,具有特殊的气味,易升华,曾经用来防蛀、驱虫,但因它有一定的毒性,现已禁止使用。萘是一种主要的化工原料。
蒽也是一种无色的晶体,
易升华,是生产染料的主要原料。
菲
苯并芘
稠环芳香烃:由两个或两个以上的苯环共用相邻的2个碳原子而成的一类芳香烃。
讨论甲苯与液氯在不同的条件下可发生哪些反应?
1.已知分子式为C12H12的物质A结构简式为
则A环上的一溴代物有
(
)
A、2种
B、3种
C、4种
D、6种
B
2.直链烷烃的通式可用CnH2n+2表示,现有一系列芳香烃,按下列特点排列:
,
,
,……
若用通式表示这一系列化合物,其通式应为(
)
A、CnH2n-6
B、C6n+4H2n+6
C、C4n+6H2n+6
D、C2n+4H6n+6
B
等物质的量的下列烃分别完全燃烧,消耗氧气最多的是(?
??
)
?
A、甲烷?????
B、乙烯???
??
C、苯??
???
D、乙炔
C
等质量呢?
A
烃燃烧耗氧量规律:等物质的量看C和H原子个数;等质量看含H量.
【归纳】
烃
链烃
环烃
饱和链烃
不饱和链烃
脂环烃
芳香烃
(脂肪烃)
烷烃
烯烃
二烯烃
炔烃
苯的同系物
稠环芳烃
其它芳烃
环烷烃等
对比与归纳
烷
烯
苯
与Br2作用
Br2试剂
反应条件
反应类型
与KMnO4作用
点燃
现象
结论
纯溴
溴水
纯溴
溴水
光照
取代
加成
Fe粉
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被KMnO4氧化
易被KMnO4氧化
苯环难被KMnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
