黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期期末考试化学试卷(Word版含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市第九中学校2020-2021学年高一下学期期末考试化学试卷(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 952.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-09 14:04:57 | ||
图片预览



文档简介
2020级高一学年下学期期末考试
化学试题
试题说明:1、本试题满分 100 分,答题时间 90 分钟。
2、请将答案填写在答题卡上,考试结束后只交答题卡。
3、可能用到的相对原子质量 H 1 Li 7 C 12 N 14 O 16 Mg 24 Fe 56 Cu 64
第Ⅰ卷 选择题部分
一、选择题(每小题只有一个选项正确,共20小题,1-15题每小题2分,16-20题每小题3分,共45分。)
下列说法正确的是( )
当反应体系放热时其焓减小,ΔH为负值
B.化学键断裂的能量是化学变化中能量变化的主要原因
C.一个化学反应,不管是一步完成的还是分几步完成的,其反应热是不相同的
D.苛性钠固体溶于水属于放热反应
下列说法不正确的是( )
A.我们把能够发生化学反应的碰撞叫做有效碰撞
B.活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能
C.当其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞的
次数增加,化学反应速率增大
D.活化分子之间发生的碰撞一定是有效碰撞
下列说法不正确的是( )
A.化学电源包括一次电池、二次电池和燃料电池等
B.铅酸蓄电池的缺点是比能量低、笨重
C.电镀时,通常把待镀的金属制品一端作阳极,把镀层金属一端作阴极
D.金属腐蚀过程中电化学腐蚀和化学腐蚀往往同时发生
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol NO(g)中的化学键形成时需要吸收632 kJ的能量
5.已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+a kJ/mol;2C(s)+O2(g)=2CO(g) ΔH=-220 kJ/mol,
H-H、O=O和O-H键的键能(kJ/mol)分别为436、496和462,则a为( )
A.+130 B.+350 C.-118 D.-332
6.理论研究表明,在101 kPa和298 K下,异构化反应过程的能量变化如图所示。
37909505080000下列说法正确的是( )
A.HNC比HCN稳定
B.该异构化反应的ΔH=-59.3 kJ/mol
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
7.下列示意图表示正确的是( )
甲 乙 丙 丁
A.甲图表示Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=+26.7kJ·mol-1反应的能量变化
B.乙图表示碳的燃烧热
C. 丙图表示实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH
溶液混合,混合液的最高温度随V(NaOH)的变化(已知V1+V2=60 mL)
D.已知稳定性顺序:B<A<C,某反应由两步反应A→B→C构成,反应过程中的能量变化曲线如丁图
8.下列与金属腐蚀有关的说法正确的是( )
837565698500
a b c d
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
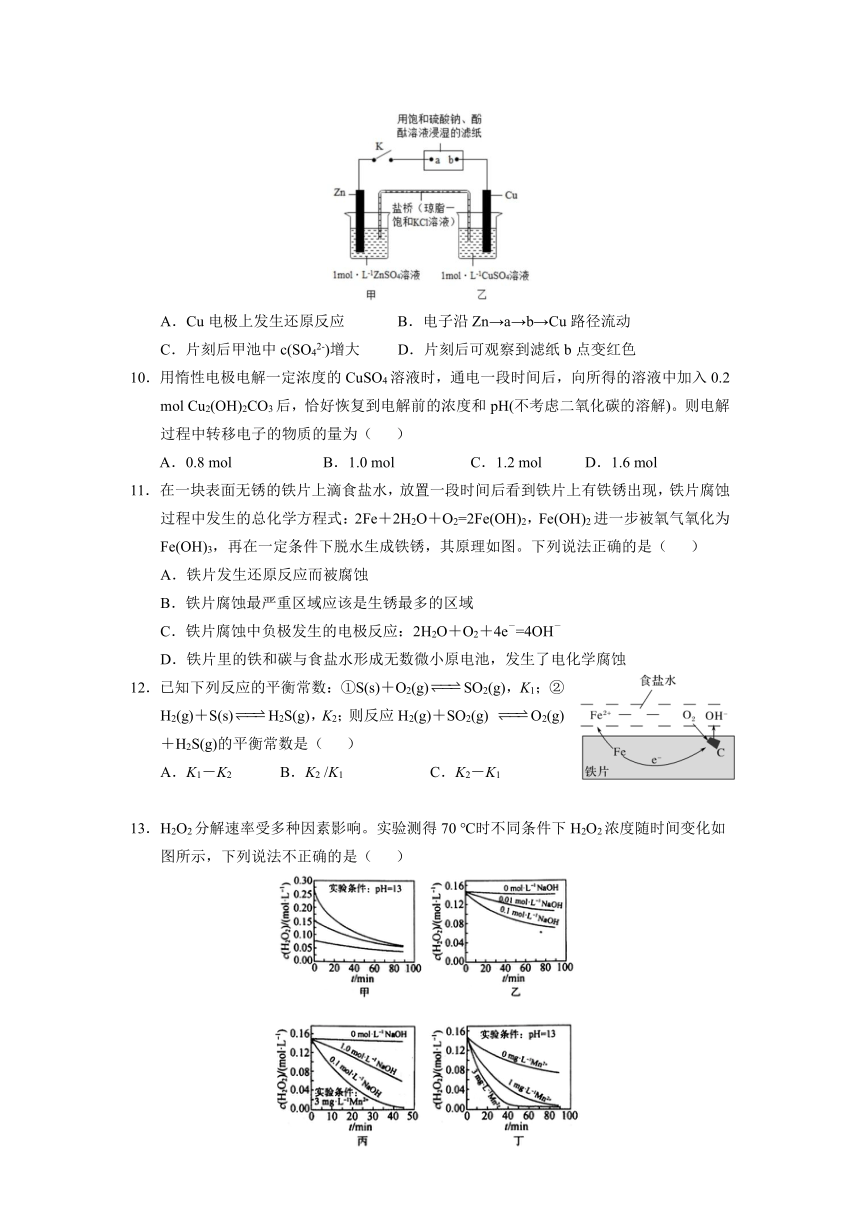
9.将下图所示实验装置中的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大 D.片刻后可观察到滤纸b点变红色
10.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.2 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为( )
A.0.8 mol B.1.0 mol C.1.2 mol D.1.6 mol
5076825592074000在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现,铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )
A.铁片发生还原反应而被腐蚀
B.铁片腐蚀最严重区域应该是生锈最多的区域
C.铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-=4OH-
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
12.已知下列反应的平衡常数:①S(s)+O2(g)SO2(g),K1;②H2(g)+S(s)H2S(g),K2;则反应H2(g)+SO2(g) O2(g)+H2S(g)的平衡常数是( )
A.K1-K2 B.K2 /K1 C.K2-K1 D.K1/K2
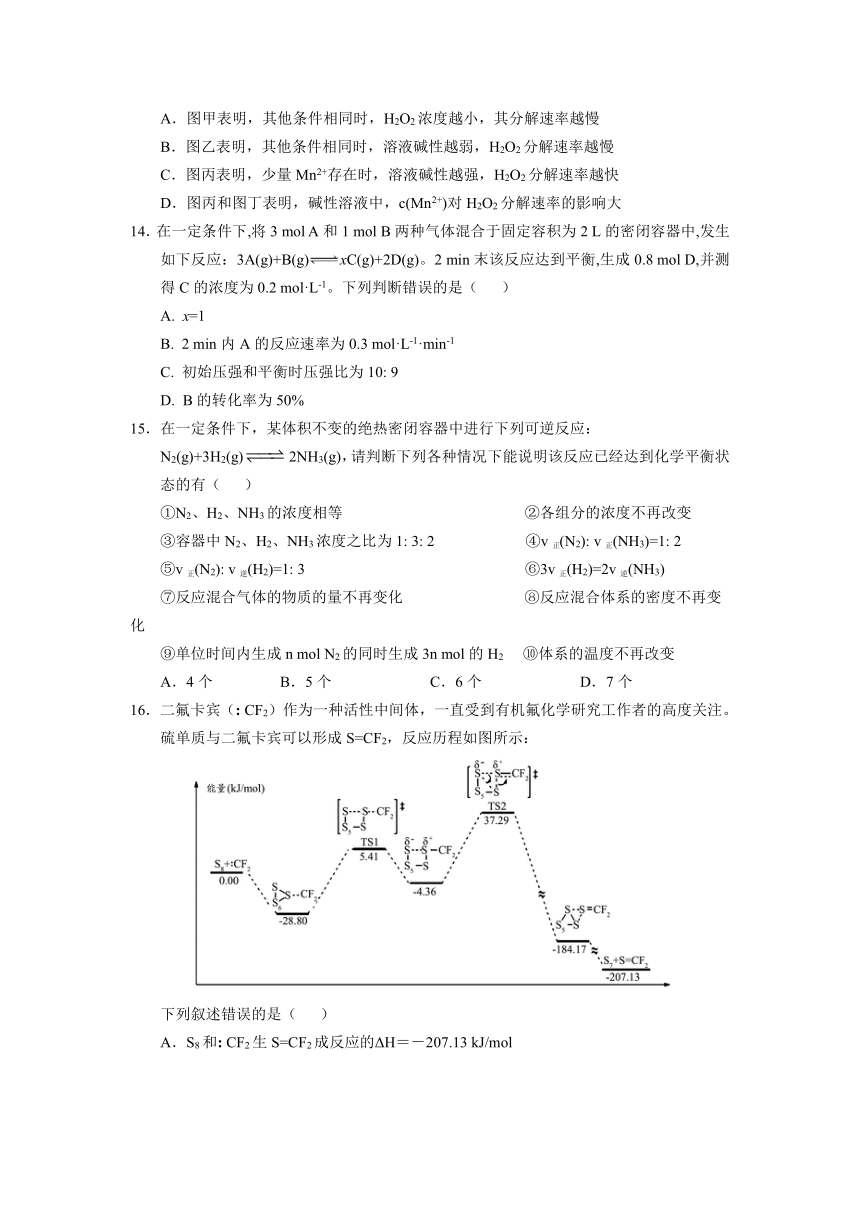
13.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间变化如图所示,下列说法不正确的是( )
2301240894334000
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大
14.在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
x=1
2 min内A的反应速率为0.3 mol·L-1·min-1
初始压强和平衡时压强比为10: 9
B的转化率为50%
15.在一定条件下,某体积不变的绝热密闭容器中进行下列可逆反应:N2(g)+3H2(g)2NH3(g),请判断下列各种情况下能说明该反应已经达到化学平衡状态的有( )
①N2、H2、NH3的浓度相等 ②各组分的浓度不再改变
③容器中N2、H2、NH3浓度之比为1: 3: 2 ④v正(N2): v正(NH3)=1: 2
⑤v正(N2): v逆(H2)=1: 3 ⑥3v正(H2)=2v逆(NH3)
⑦反应混合气体的物质的量不再变化 ⑧反应混合体系的密度不再变化
⑨单位时间内生成n mol N2的同时生成3n mol的H2 ⑩体系的温度不再改变
A.4个 B.5个 C.6个 D.7个
16.二氟卡宾(: CF2)作为一种活性中间体,一直受到有机氟化学研究工作者的高度关注。硫单质与二氟卡宾可以形成S=CF2,反应历程如图所示:
下列叙述错误的是( )
A.S8和: CF2生S=CF2成反应的ΔH=-207.13 kJ/mol
B.由生成的活化能为34.21 kJ/mol
C.上述反应历程中存在S-S键的断裂和生成
D.决定反应速率的基元反应的活化能为41.65 kJ/mol
17.科学家预言,被称为“黑金”的“新材料之王石墨烯”将彻底改变21世纪。我国关于石墨烯的专利总数世界排名第一。如图是我国研发的某种石墨烯电池有关原理示意图,左边装置工作时的电极反应为Li1-xC6+xLi++xe-=LiC6,Li[GS/Si]O2-xe-=Li1-x[GS/Si]O2+xLi+。下列说法错误的是( )
A.a与d电极上发生的反应类型相同
B.左右两个装置中的离子交换膜均为阳离子交换膜
C.电池放电时,正极反应为Li1-x[GS/Si]O2+xLi++xe-=Li[GS/Si]O2
D.若装置工作前c与d电极质量相等,则转移0.1 mol电子后两个电极质量相差0.7 g
18.用Mg-NaClO燃料电池作电源模拟消除工业酸性废水中的Cr2O72-(Cr2O72-还原为Cr3+),装置如图所示,下列说法正确的是( )
A.b电极材料为Mg,发生氧化反应
B.金属铁电极反应为:Fe-3e-=Fe3+
C.处理后的废水比原工业废水的pH大
D.装置工作过程中消耗7.2 g Mg,理论上消除0.l mol Cr2O72-
19.某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa)
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是( )
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在1.0×105 Pa、90 ℃条件下,当转化率为98 %时反应已达到平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30 ℃条件
下转化率从50 %增至90 %时段NO的反应速率为4a/370 mol/s
已知:2NO(g)+2CO(g)N2(g)+2CO2(g) △H=-746.5 kJ·mol-1,可在一定条件下反应消
除NO和CO的污染。某研究小组在三个容积均为V L的恒容密闭容器中,分别充入1.0 mol NO
和1.0 mol CO,在三种不同实验条件(见下表)下进行上述反应,反应体系的总压强(P)随时间变
化情况如下图所示,下列说法正确的是( )
已知:在其他条件不变时,升高温度,平衡向着吸热方向移动;使用催化剂,平衡不发生移动。
实验编号
a
b
c
温度/K
500
500
600
催化剂的比表面积/m2·g-1
82
124
124
4425952603500
A.曲线I对应的实验编号是a
B.由曲线II可知,达到平衡时CO物质的量为0.2 mol
C.实验c达到平衡时NO转化率大于实验b
D.催化剂的比表面积越大,混合气中NO和CO污染物的含量越少
第Ⅱ卷 非选择题部分
二、填空题(共55分)
21. (12分)按要求填空。
(1)已知固态软脂酸[CH3(CH2)14COOH]的燃烧热为9977 kJ/mol,写出软脂酸燃烧的热化学方程式: 。
(2)在N2(g)+3H2 (g)2NH3(g)中,当其他外界条件不变时,在反应中保持体系容积不变,充
入He,反应的速率 (填“增大”、“减小”或者“不变”);在反应中保持体系压强不变,充入He,反应的速率 (填“增大”、“减小”或者“不变”)。
(3)两极以石墨为电极电解硝酸银溶液,写出电解总反应的离子方程式: 。
(4)若某同学进行中和热实验测定时,有些操作不规范,造成测得中和热的数值偏低,请你分析
可能的原因是______。
测量盐酸的温度后,温度计没有用水冲洗干净
把量筒中的氢氧化钠溶液倒入量热计的内筒时动作迟缓
做本实验的当天室温较高
将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL 0.55 mol/L的氨水
在量取盐酸时仰视计数
量热计杯盖上插入温度计的小孔太大
(5)在其它条件不变时,10 ℃时以某物质表示的反应速率为3 mol/ (L·s),已知温度每升高10 ℃,反应速率是原来的2倍,则温度为50 ℃时,该反应的速率为 。
(6)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/4。为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,该方案属于 原理(“原电池”或“电解池”);下图中乙方案也可降低铁闸门腐蚀速率,称为 法。
18249906223000
22.(14分)化学反应伴随能量变化,获取反应能量变化有多条途径。
Ⅰ.(1)下列反应中,属于吸热反应的是_________。
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
化学键种类
H—H
Cl—Cl
H—Cl
键能(kJ/mol)
436
247
434
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=_________kJ·mol-1。
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________________________________。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
406971597726500①补全图:图中A处应填入___________________。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H_________(填“增大”、“减小”或者“不变”);若上述反应中产物为液态水,则该反应的△H_________(填“变大”、“变小”或者“不变”)。
II. 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:
若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状
况下体积为________________。
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用________交换膜(填“阳离子”或“阴离子”)。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填
“增大”、“减小”或者“不变”)。
23. (15分)为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图所示的装置进行实验,回答下列问题。
2566035605345500Ⅰ. 用甲装置进行第一组实验:
(1)在保证电极反应不变的情况下,下列材料不能代替插入硫酸铜溶液中的Cu电极的是_______(填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42-_____(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察
到的现象有____________________________。
Ⅱ. 该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,Y极溶液逐渐变成紫红色,
停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO42-)在溶液
中呈紫红色。请根据实验现象及所查信息,填写下列空白:
(3)电解过程中,X极溶液的pH_______(填“增大”、“减小”或者“不变”)。
(4)电解过程中,Y极发生的电极反应为_____________________和_____________________。
(5)另一小组同学将乙装置中6 mol/L NaOH溶液换成1 mol/L NaCl溶液,发现铁电极附近逐渐变成浅绿色,该小组同学认为铁电极附近溶液中生成了Fe2+,为了验证这一猜测,应使用_________(填试剂名称)来检验,现象为__________ ,则证明该小组同学猜想正确。
(6)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
1455420-4445000
①该同学想在Ⅱ中实现铁上镀铜,a处电极上发生的电极反应为___________。
②Ⅱ中电解前CuSO4溶液的浓度为3 mol/L,若维持电流强度为1 A,电池工作十分钟,理论上消耗Ⅰ中的CH4______ g(计算结果保留两位有效数字,已知F=96500 C·mol-1),此时电解池中CuSO4溶液的浓度为___________。
24.(14分)选择性催化还原法(SCR)是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是
利用NH3在特定催化剂作用下将NOx还原为N2。
主反应:4NH3(g) +4NO(g)+O2(g)4N2(g)+6H2O(g) ΔH1
副反应:4NH3(g)+ 3O2(g)2N2(g)+6H2O(g) ΔH2
(1)在无氧条件下,NH3也可还原NO:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3
则ΔH2=_______(用含ΔH1、ΔH3的式子表示)。
一定温度下,向2 L密闭刚性容器(含催化剂)中投入2 mol NH3和3 mol NO,发生反应4NH3(g)+6NO(g)5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为_______mol·L-1(列出计算式即可)。
(2)目前使用的SCR催化剂是V2O5-WO3/TiO2,关于该催化剂的说法正确的是_______。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(3)催化剂V2O5-WO3/TiO2中的V2O5是活性组分。在石英微型反应器中以一定流速通过烟气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化还原反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。
①从起始至对应A、B、C三点的平均反应速率由大到小的顺序为_________________。
②V2O5的质量分数对该催化剂活性的影响是______________________。
NO2存在如下平衡:2NO2(g)N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速
率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=
5357495147828000k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=_________。
还可用间接电解法除NO。其原理如图所示,则电解池阴极的
电极反应为_______________。
2020级高一学年下学期期末考试
化学答案
一、选择题(每小题只有一个选项正确,共20小题,1-15题每小题2分,16-20题每小题3分,共45分。)
1
2
3
4
5
6
7
8
9
10
A
D
C
B
A
C
D
B
A
C
11
12
13
14
15
16
17
18
19
20
D
B
C
D
A
B
D
C
D
B
二、填空题(共55分)
21. (12分)
(1) CH3(CH2)14COOH (s) + 23O2(g) ==16CO2(g) + 16H2O(l) △H=-9977 kJ·mol-1 (2分)
(2)不变 (1分) ;减小 (1分)
(3)4Ag+ + 2H2O = 4Ag + O2 ↑+ 4H+ (条件是电解) (2分)
(4)ABDF (2分,答对两个及以上给1分)
(5)48 mol/ (L·s) (2分,不写单位扣1分)
原电池 (1分);外加电流 (1分)
22.(14分)
Ⅰ. (1) AC(2分,答对1个给1分)
① -185 (2分)
②Na2O2(s)+2Na(s)=2Na2O(s) △H= -317 kJ·mol-1 (2分)
① 1 mol CO2(g)+3 mol H2(g) (2分)
②不变(1分);变小(1分)
II. (1) 0.896 L (2分)
(2)阴离子 (1分)
(3)减小(1分)
23. (15分)
Ⅰ.(1)B (1分)
(2)从右向左(1分) ; 滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可)(1分)
Ⅱ.(3)增大(1分)
(4)Fe-6e-+8OH-=FeO42-+4H2O (2分) 和4OH- - 4e-=2H2O+O2↑ (2分)
(5) 铁氰化钾(1分);蓝色沉淀 (1分)
(6)①CH4 -8e-+10OH- =CO32- + 7H2O(2分)
②0.012 (2分),3mol/L(1分)
24.(14分)
(1) (2分); (2分)
(2) C (2分)
(3)①C>B>A (2分)
②在100 ℃-200 ℃内,V2O5的质量分数对该催化剂活性的影响是催化剂的质量分数越高,催化剂的活性越好,超过200℃,没有明显区别 (2分)
(4)2k2·Kp (2分)
(5)2HSO+2H++2e-=S2O+2H2O (2分)
化学试题
试题说明:1、本试题满分 100 分,答题时间 90 分钟。
2、请将答案填写在答题卡上,考试结束后只交答题卡。
3、可能用到的相对原子质量 H 1 Li 7 C 12 N 14 O 16 Mg 24 Fe 56 Cu 64
第Ⅰ卷 选择题部分
一、选择题(每小题只有一个选项正确,共20小题,1-15题每小题2分,16-20题每小题3分,共45分。)
下列说法正确的是( )
当反应体系放热时其焓减小,ΔH为负值
B.化学键断裂的能量是化学变化中能量变化的主要原因
C.一个化学反应,不管是一步完成的还是分几步完成的,其反应热是不相同的
D.苛性钠固体溶于水属于放热反应
下列说法不正确的是( )
A.我们把能够发生化学反应的碰撞叫做有效碰撞
B.活化分子具有的平均能量与反应物分子具有的平均能量之差,叫做反应的活化能
C.当其他条件相同时,反应物浓度增大,单位体积内活化分子数增多,单位时间内有效碰撞的
次数增加,化学反应速率增大
D.活化分子之间发生的碰撞一定是有效碰撞
下列说法不正确的是( )
A.化学电源包括一次电池、二次电池和燃料电池等
B.铅酸蓄电池的缺点是比能量低、笨重
C.电镀时,通常把待镀的金属制品一端作阳极,把镀层金属一端作阴极
D.金属腐蚀过程中电化学腐蚀和化学腐蚀往往同时发生
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol NO(g)中的化学键形成时需要吸收632 kJ的能量
5.已知:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+a kJ/mol;2C(s)+O2(g)=2CO(g) ΔH=-220 kJ/mol,
H-H、O=O和O-H键的键能(kJ/mol)分别为436、496和462,则a为( )
A.+130 B.+350 C.-118 D.-332
6.理论研究表明,在101 kPa和298 K下,异构化反应过程的能量变化如图所示。
37909505080000下列说法正确的是( )
A.HNC比HCN稳定
B.该异构化反应的ΔH=-59.3 kJ/mol
C.正反应的活化能大于逆反应的活化能
D.使用催化剂,可以改变反应的反应热
7.下列示意图表示正确的是( )
甲 乙 丙 丁
A.甲图表示Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=+26.7kJ·mol-1反应的能量变化
B.乙图表示碳的燃烧热
C. 丙图表示实验的环境温度为20 ℃,将物质的量浓度相等、体积分别为V1、V2的H2SO4、NaOH
溶液混合,混合液的最高温度随V(NaOH)的变化(已知V1+V2=60 mL)
D.已知稳定性顺序:B<A<C,某反应由两步反应A→B→C构成,反应过程中的能量变化曲线如丁图
8.下列与金属腐蚀有关的说法正确的是( )
837565698500
a b c d
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
9.将下图所示实验装置中的K闭合,下列判断正确的是( )
A.Cu电极上发生还原反应 B.电子沿Zn→a→b→Cu路径流动
C.片刻后甲池中c(SO42-)增大 D.片刻后可观察到滤纸b点变红色
10.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.2 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为( )
A.0.8 mol B.1.0 mol C.1.2 mol D.1.6 mol
5076825592074000在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现,铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2=2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )
A.铁片发生还原反应而被腐蚀
B.铁片腐蚀最严重区域应该是生锈最多的区域
C.铁片腐蚀中负极发生的电极反应:2H2O+O2+4e-=4OH-
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
12.已知下列反应的平衡常数:①S(s)+O2(g)SO2(g),K1;②H2(g)+S(s)H2S(g),K2;则反应H2(g)+SO2(g) O2(g)+H2S(g)的平衡常数是( )
A.K1-K2 B.K2 /K1 C.K2-K1 D.K1/K2
13.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间变化如图所示,下列说法不正确的是( )
2301240894334000
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越慢
B.图乙表明,其他条件相同时,溶液碱性越弱,H2O2分解速率越慢
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,c(Mn2+)对H2O2分解速率的影响大
14.在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是( )
x=1
2 min内A的反应速率为0.3 mol·L-1·min-1
初始压强和平衡时压强比为10: 9
B的转化率为50%
15.在一定条件下,某体积不变的绝热密闭容器中进行下列可逆反应:N2(g)+3H2(g)2NH3(g),请判断下列各种情况下能说明该反应已经达到化学平衡状态的有( )
①N2、H2、NH3的浓度相等 ②各组分的浓度不再改变
③容器中N2、H2、NH3浓度之比为1: 3: 2 ④v正(N2): v正(NH3)=1: 2
⑤v正(N2): v逆(H2)=1: 3 ⑥3v正(H2)=2v逆(NH3)
⑦反应混合气体的物质的量不再变化 ⑧反应混合体系的密度不再变化
⑨单位时间内生成n mol N2的同时生成3n mol的H2 ⑩体系的温度不再改变
A.4个 B.5个 C.6个 D.7个
16.二氟卡宾(: CF2)作为一种活性中间体,一直受到有机氟化学研究工作者的高度关注。硫单质与二氟卡宾可以形成S=CF2,反应历程如图所示:
下列叙述错误的是( )
A.S8和: CF2生S=CF2成反应的ΔH=-207.13 kJ/mol
B.由生成的活化能为34.21 kJ/mol
C.上述反应历程中存在S-S键的断裂和生成
D.决定反应速率的基元反应的活化能为41.65 kJ/mol
17.科学家预言,被称为“黑金”的“新材料之王石墨烯”将彻底改变21世纪。我国关于石墨烯的专利总数世界排名第一。如图是我国研发的某种石墨烯电池有关原理示意图,左边装置工作时的电极反应为Li1-xC6+xLi++xe-=LiC6,Li[GS/Si]O2-xe-=Li1-x[GS/Si]O2+xLi+。下列说法错误的是( )
A.a与d电极上发生的反应类型相同
B.左右两个装置中的离子交换膜均为阳离子交换膜
C.电池放电时,正极反应为Li1-x[GS/Si]O2+xLi++xe-=Li[GS/Si]O2
D.若装置工作前c与d电极质量相等,则转移0.1 mol电子后两个电极质量相差0.7 g
18.用Mg-NaClO燃料电池作电源模拟消除工业酸性废水中的Cr2O72-(Cr2O72-还原为Cr3+),装置如图所示,下列说法正确的是( )
A.b电极材料为Mg,发生氧化反应
B.金属铁电极反应为:Fe-3e-=Fe3+
C.处理后的废水比原工业废水的pH大
D.装置工作过程中消耗7.2 g Mg,理论上消除0.l mol Cr2O72-
19.某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)2NO2(g),在其他条件相同时,测得实验数据如下表:
压强/(×105Pa)
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是( )
A.升高温度,反应速率加快
B.增大压强,反应速率变慢
C.在1.0×105 Pa、90 ℃条件下,当转化率为98 %时反应已达到平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30 ℃条件
下转化率从50 %增至90 %时段NO的反应速率为4a/370 mol/s
已知:2NO(g)+2CO(g)N2(g)+2CO2(g) △H=-746.5 kJ·mol-1,可在一定条件下反应消
除NO和CO的污染。某研究小组在三个容积均为V L的恒容密闭容器中,分别充入1.0 mol NO
和1.0 mol CO,在三种不同实验条件(见下表)下进行上述反应,反应体系的总压强(P)随时间变
化情况如下图所示,下列说法正确的是( )
已知:在其他条件不变时,升高温度,平衡向着吸热方向移动;使用催化剂,平衡不发生移动。
实验编号
a
b
c
温度/K
500
500
600
催化剂的比表面积/m2·g-1
82
124
124
4425952603500
A.曲线I对应的实验编号是a
B.由曲线II可知,达到平衡时CO物质的量为0.2 mol
C.实验c达到平衡时NO转化率大于实验b
D.催化剂的比表面积越大,混合气中NO和CO污染物的含量越少
第Ⅱ卷 非选择题部分
二、填空题(共55分)
21. (12分)按要求填空。
(1)已知固态软脂酸[CH3(CH2)14COOH]的燃烧热为9977 kJ/mol,写出软脂酸燃烧的热化学方程式: 。
(2)在N2(g)+3H2 (g)2NH3(g)中,当其他外界条件不变时,在反应中保持体系容积不变,充
入He,反应的速率 (填“增大”、“减小”或者“不变”);在反应中保持体系压强不变,充入He,反应的速率 (填“增大”、“减小”或者“不变”)。
(3)两极以石墨为电极电解硝酸银溶液,写出电解总反应的离子方程式: 。
(4)若某同学进行中和热实验测定时,有些操作不规范,造成测得中和热的数值偏低,请你分析
可能的原因是______。
测量盐酸的温度后,温度计没有用水冲洗干净
把量筒中的氢氧化钠溶液倒入量热计的内筒时动作迟缓
做本实验的当天室温较高
将50 mL 0.55 mol/L氢氧化钠溶液取成了50 mL 0.55 mol/L的氨水
在量取盐酸时仰视计数
量热计杯盖上插入温度计的小孔太大
(5)在其它条件不变时,10 ℃时以某物质表示的反应速率为3 mol/ (L·s),已知温度每升高10 ℃,反应速率是原来的2倍,则温度为50 ℃时,该反应的速率为 。
(6)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的1/4。为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,该方案属于 原理(“原电池”或“电解池”);下图中乙方案也可降低铁闸门腐蚀速率,称为 法。
18249906223000
22.(14分)化学反应伴随能量变化,获取反应能量变化有多条途径。
Ⅰ.(1)下列反应中,属于吸热反应的是_________。
A.C和CO2高温下反应 B.甲烷的燃烧反应
C.Ba(OH)2·8H2O与氯化铵反应 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
化学键种类
H—H
Cl—Cl
H—Cl
键能(kJ/mol)
436
247
434
计算可得:H2(g)+Cl2(g)=2HCl(g) △H=_________kJ·mol-1。
②通过盖斯定律可计算。已知在25 ℃、101 kPa时:
I.2Na(s)+O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________________________________。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
406971597726500①补全图:图中A处应填入___________________。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H_________(填“增大”、“减小”或者“不变”);若上述反应中产物为液态水,则该反应的△H_________(填“变大”、“变小”或者“不变”)。
II. 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,根据要求回答相关问题:
若在标准状况下,甲装置有448 mL氧气参加反应,则乙装置中铁电极上生成的气体在标准状
况下体积为________________。
(2)若用隔膜法电解饱和食盐水生成NaClO,则X应用________交换膜(填“阳离子”或“阴离子”)。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将_______(填
“增大”、“减小”或者“不变”)。
23. (15分)为了探究原电池和电解池的工作原理,某研究性学习小组分别用如图所示的装置进行实验,回答下列问题。
2566035605345500Ⅰ. 用甲装置进行第一组实验:
(1)在保证电极反应不变的情况下,下列材料不能代替插入硫酸铜溶液中的Cu电极的是_______(填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42-_____(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察
到的现象有____________________________。
Ⅱ. 该小组同学用乙装置进行第二组实验时发现,两极均有气体产生,Y极溶液逐渐变成紫红色,
停止实验后观察到铁电极明显变细,电解液仍澄清。查阅资料知,高铁酸根离子(FeO42-)在溶液
中呈紫红色。请根据实验现象及所查信息,填写下列空白:
(3)电解过程中,X极溶液的pH_______(填“增大”、“减小”或者“不变”)。
(4)电解过程中,Y极发生的电极反应为_____________________和_____________________。
(5)另一小组同学将乙装置中6 mol/L NaOH溶液换成1 mol/L NaCl溶液,发现铁电极附近逐渐变成浅绿色,该小组同学认为铁电极附近溶液中生成了Fe2+,为了验证这一猜测,应使用_________(填试剂名称)来检验,现象为__________ ,则证明该小组同学猜想正确。
(6)下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
1455420-4445000
①该同学想在Ⅱ中实现铁上镀铜,a处电极上发生的电极反应为___________。
②Ⅱ中电解前CuSO4溶液的浓度为3 mol/L,若维持电流强度为1 A,电池工作十分钟,理论上消耗Ⅰ中的CH4______ g(计算结果保留两位有效数字,已知F=96500 C·mol-1),此时电解池中CuSO4溶液的浓度为___________。
24.(14分)选择性催化还原法(SCR)是目前应用最为广泛的氮氧化物NOx的净化方法,其原理是
利用NH3在特定催化剂作用下将NOx还原为N2。
主反应:4NH3(g) +4NO(g)+O2(g)4N2(g)+6H2O(g) ΔH1
副反应:4NH3(g)+ 3O2(g)2N2(g)+6H2O(g) ΔH2
(1)在无氧条件下,NH3也可还原NO:4NH3(g)+6NO(g)5N2(g)+6H2O(g) ΔH3
则ΔH2=_______(用含ΔH1、ΔH3的式子表示)。
一定温度下,向2 L密闭刚性容器(含催化剂)中投入2 mol NH3和3 mol NO,发生反应4NH3(g)+6NO(g)5N2(g)+ 6H2O(g)。达到平衡状态时,NO的转化率为60 %,则平衡常数为_______mol·L-1(列出计算式即可)。
(2)目前使用的SCR催化剂是V2O5-WO3/TiO2,关于该催化剂的说法正确的是_______。
A.能加快反应速率,并且改变反应的焓变
B.能增大NH3还原NOx反应的平衡常数
C.具有选择性,能降低特定反应的活化能
(3)催化剂V2O5-WO3/TiO2中的V2O5是活性组分。在石英微型反应器中以一定流速通过烟气[n(O2):n(NH3):n(NO)=71:1:1],在不同温度下进行该催化还原反应,V2O5的质量分数对单位时间内NO去除率的影响如图所示。
①从起始至对应A、B、C三点的平均反应速率由大到小的顺序为_________________。
②V2O5的质量分数对该催化剂活性的影响是______________________。
NO2存在如下平衡:2NO2(g)N2O4(g) △H<0,在一定条件下,NO2与N2O4的消耗速
率与各自的分压(分压=总压×物质的量分数)有如下关系:v(NO2)=k1·p2(NO2),v(N2O4)=
5357495147828000k2·p(N2O4)。一定温度下,k1、k2与平衡常数kp(压力平衡常数,用平衡分压代替平衡浓度计算)间的关系k1=_________。
还可用间接电解法除NO。其原理如图所示,则电解池阴极的
电极反应为_______________。
2020级高一学年下学期期末考试
化学答案
一、选择题(每小题只有一个选项正确,共20小题,1-15题每小题2分,16-20题每小题3分,共45分。)
1
2
3
4
5
6
7
8
9
10
A
D
C
B
A
C
D
B
A
C
11
12
13
14
15
16
17
18
19
20
D
B
C
D
A
B
D
C
D
B
二、填空题(共55分)
21. (12分)
(1) CH3(CH2)14COOH (s) + 23O2(g) ==16CO2(g) + 16H2O(l) △H=-9977 kJ·mol-1 (2分)
(2)不变 (1分) ;减小 (1分)
(3)4Ag+ + 2H2O = 4Ag + O2 ↑+ 4H+ (条件是电解) (2分)
(4)ABDF (2分,答对两个及以上给1分)
(5)48 mol/ (L·s) (2分,不写单位扣1分)
原电池 (1分);外加电流 (1分)
22.(14分)
Ⅰ. (1) AC(2分,答对1个给1分)
① -185 (2分)
②Na2O2(s)+2Na(s)=2Na2O(s) △H= -317 kJ·mol-1 (2分)
① 1 mol CO2(g)+3 mol H2(g) (2分)
②不变(1分);变小(1分)
II. (1) 0.896 L (2分)
(2)阴离子 (1分)
(3)减小(1分)
23. (15分)
Ⅰ.(1)B (1分)
(2)从右向左(1分) ; 滤纸上有蓝色沉淀产生(答出“蓝色沉淀”或“蓝色斑点”即可)(1分)
Ⅱ.(3)增大(1分)
(4)Fe-6e-+8OH-=FeO42-+4H2O (2分) 和4OH- - 4e-=2H2O+O2↑ (2分)
(5) 铁氰化钾(1分);蓝色沉淀 (1分)
(6)①CH4 -8e-+10OH- =CO32- + 7H2O(2分)
②0.012 (2分),3mol/L(1分)
24.(14分)
(1) (2分); (2分)
(2) C (2分)
(3)①C>B>A (2分)
②在100 ℃-200 ℃内,V2O5的质量分数对该催化剂活性的影响是催化剂的质量分数越高,催化剂的活性越好,超过200℃,没有明显区别 (2分)
(4)2k2·Kp (2分)
(5)2HSO+2H++2e-=S2O+2H2O (2分)
同课章节目录
