2020-2021学年高一化学鲁科版(2019)必修第一册第一章《认识化学科学》测试卷-含解析
文档属性
| 名称 | 2020-2021学年高一化学鲁科版(2019)必修第一册第一章《认识化学科学》测试卷-含解析 |  | |
| 格式 | docx | ||
| 文件大小 | 120.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-09 14:11:09 | ||
图片预览




文档简介
第一章《认识化学科学》测试卷
一、单选题(共15小题)
1.如图装置用来检验氯气的部分性质,下列说法不正确的是( )
A.
装置A的作用是除去氯气中的水蒸气
B.
该实验必须在通风橱中进行
C.
装置C中发生反应为Cl2+2NaOH===NaCl+NaClO+H2O
D.
装置B的现象是干燥布条退色,湿润布条不退色
2.下列说法中,不正确的是( )
A.
化学家可以制造出自然界中不存在的物质
B.
化学的特征就是认识分子和制造分子,是一门具有创造性和实用性的科学
C.
利用化学变化可以制造出新的分子,但不能制造出新的原子
D.
化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中
3.化学成为一门科学并较快发展,始于( )
A.
舍勒发现氧气
B.
质量守恒定律的发现
C.
原子-分子学说的问世
D.
中国湿法冶金技术的推广
4.下列变化不属于化学科学研究范畴的是( )
A.
电解水生成氢气和氧气
B.
合成有机高分子材料
C.
原子弹爆炸
D.
生产合成纤维和合成橡胶
5.下列说法中正确的是
( )
A.
在50
mL量筒中配制0.100
0
mol·L-1的碳酸钠溶液
B.
0.5
mol
O3与11.2
L
O3所含的分子数一定相等
C.
分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
D.
常温常压下,22.4
L的NO2和CO2混合气体中含有2NA个氧原子
6.中国药学家屠呦呦因发现青蒿素,开创了治疗疟疾的新方法,荣获诺贝尔奖。已知青蒿素的分子式为C15H22O5。下列有关说法正确的是( )
A.
青蒿素的摩尔质量为282
g·mol-1
B.
青蒿素中C、H、O的质量之比为15∶22∶5
C.
1
mol青蒿素的体积约为22.4
L
D.
1
mol青蒿素中含11
mol
H2
7.下列说法不正确的是( )
A.
金属Na和Na2O2分别投入到FeCl3溶液中,都既有气体放出又有沉淀生成
B.
Na2O2能和水反应生成O2
C.
Na2O和Na2O2组成元素相同,与CO2反应产物也相同
D.
钠着火不可以用泡沫灭火剂或水灭火,可以用沙子盖灭
8.用NaOH固体配制1.0
mol·L-1的NaOH溶液220
mL,下列说法正确的是
( )
A.
首先称取NaOH固体8.8
g
B.
定容时仰视刻度线会使所配制的溶液浓度偏高
C.
定容后将溶液摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线
D.
容量瓶中原有少量蒸馏水没有影响
9.漂白粉在空气中放置易失效的主要原因是( )
A.
Ca(ClO)2不稳定,易分解
B.
CaCl2易吸水而潮解
C.
Ca(ClO)2跟空气中的水和CO2反应
D.
Ca(ClO)2跟空气中的O2反应
10.下列说法中正确的是( )
A.
标准状况下,1
mol酒精的体积是22.4
L
B.
1
mol任何气体体积约为22.4
L
C.
在标准状况下,0.3
mol
氮气和0.7
mol氧气混合气体总体积约为22.4
L
D.
通常状况下,1
mol
氮气的体积约为22.4
L
11.下列说法中正确的是( )
A.
物质的摩尔质量等于其相对分子(或原子)质量
B.
物质的摩尔质量是该物质1
mol时的质量
C.
物质的摩尔质量等于其相对分子质量的6.02×1023倍
D.
摩尔质量的单位是g·mol-1
12.下列实验过程中没有气体产生的是( )
A.
A
B.
B
C.
C
D.
D
13.amol
H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.mol-1
B.mol-1
C.mol-1
D.mol-1
14.三个相同的恒温恒容密闭容器中分别盛有等质量的氢气、甲烷、氧气,下列说法正确的是
A.
三种气体的分子数目一定相等
B.
三种气体物质的量之比为16∶2∶1
C.
三种气体的密度之比为1∶2∶16
D.
三种气体的压强一定相等
15.4
℃时,若20滴水恰好为1
mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)( )
A.
20NA
B.NA/360
C.
9NA/10
D.
360/NA
二、实验题(共3小题)
16.氯元素是生产生活中常见的非金属元素。某同学欲探究Cl2及其化合物的性质。
(1)把Cl2通入水中,反应的化学方程式是__________________________________________
________________________________________________________________________。
(2)用氯水进行如下表实验:
①实验Ⅰ的现象说明,氯水具有的性质是________。
②实验Ⅱ:a.ⅰ现象中的白色沉淀是________。
b.综合ⅰ和ⅱ现象,该同学推测实验Ⅱ发生的反应为Cl2+AgNO3+________===HNO3+AgCl↓+_________________________________________________(将反应补充完整)。
③为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,该同学设计实验如下:
c.将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色。
d.……
上述实验d的方案是______________________________________________________________
________________________________________________________________________。
(3)该同学查阅资料得知,最初,人们直接用氯气做漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
①你认为“使用起来不方便,效果也不理想”的原因是______________________________
________________________________________________________________________。
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是______________。
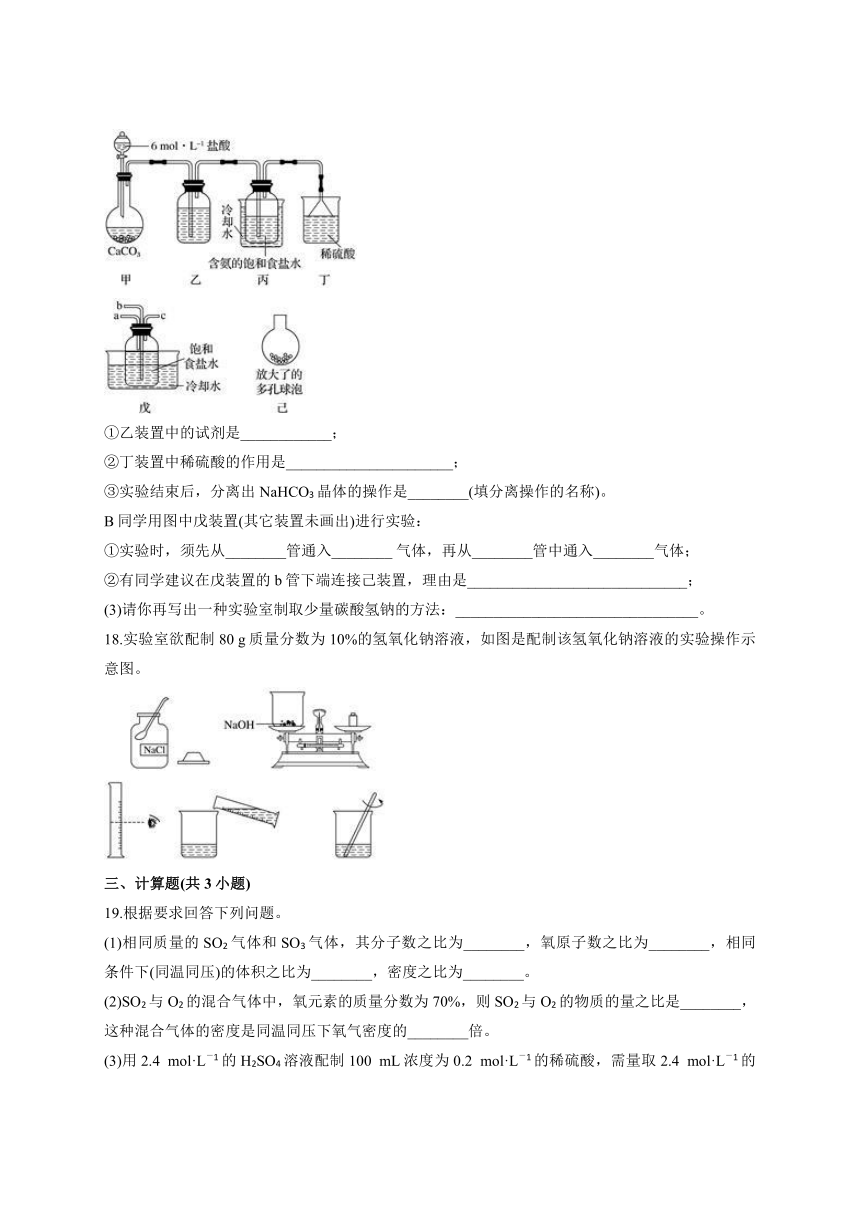
17.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关化学方程式:NH3+CO2+H2O===NH4HCO3;NH4HCO3+NaCl===NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O。
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是( )
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们设计了各种方案。
A同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。试回答下列有关问题:
①乙装置中的试剂是____________;
②丁装置中稀硫酸的作用是______________________;
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
B同学用图中戊装置(其它装置未画出)进行实验:
①实验时,须先从________管通入________
气体,再从________管中通入________气体;
②有同学建议在戊装置的b管下端连接己装置,理由是_____________________________;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:________________________________。
18.实验室欲配制80
g质量分数为10%的氢氧化钠溶液,如图是配制该氢氧化钠溶液的实验操作示意图。
三、计算题(共3小题)
19.根据要求回答下列问题。
(1)相同质量的SO2气体和SO3气体,其分子数之比为________,氧原子数之比为________,相同条件下(同温同压)的体积之比为________,密度之比为________。
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是________,这种混合气体的密度是同温同压下氧气密度的________倍。
(3)用2.4
mol·L-1的H2SO4溶液配制100
mL浓度为0.2
mol·L-1的稀硫酸,需量取2.4
mol·L-1的H2SO4溶液的体积是________mL。
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未洗涤烧杯和玻璃棒,使所配溶液浓度________;
②定容时俯视刻度线,使所配溶液浓度________;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度________。
20.(1)等物质的量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为_________。
(2)等质量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为_________。
(3)将物质的量均为0.2
mol的钠、镁、铝分别投入100
mL
1
mol·L-1的盐酸中,三者产生的氢气在相同条件下的体积比为_________。
21.标准状况下,5.6
L氯气和6.72
L氢气的混合气体充分反应后,所得混合气体若用2.50
mol·L-1的NaOH溶液完全吸收,则需要NaOH溶液的体积为_________
mL。
四、填空题(共3小题)
22.有一瓶氯化钠试剂的标签如下图所示,仔细观察标签,然后回答下列问题。
氯化钠标签
(1)该瓶未开封的试剂中含氯化钠的物质的量为______。
(2)从上述试剂瓶中取出0.5
g样品配成溶液,溶液中Na+与Cl-总数为________。
23.在标准状况下,将560
L氨气溶于1
L水中所得氨水的密度为0.9
g·mL-1,计算:
(1)氨水中溶质的质量分数是__________。
(2)溶液中的物质的量浓度是__________。
(3)从中取出20
mL
加水稀释至100
mL后的物质的量浓度是__________。
24.写出下列反应的离子方程式:
(1)碳酸氢钠溶液与稀盐酸混合____________________;
(2)将碳酸钠溶液逐滴加入稀盐酸中________________________;
(3)将少量的稀盐酸逐滴加入碳酸钠溶液中____________________________________;
(4)将过量的稀盐酸逐滴加入碳酸钠溶液中____________________________________。
答案解析
1.【答案】D
【解析】 氯气没有漂白作用,次氯酸具有漂白作用,所以装置B中干燥布条不退色,湿润布条退色。
2.【答案】D
【解析】化学具有创造性,化学家可以制造出自然界中不存在的物质,A项正确;认识分子和制造分子,是化学的特征,体现了化学的创造性和实用性,B项正确;原子是化学变化中的最小微粒,分子是保持物质性质的最小微粒,则利用化学方法,我们可以制造出新的分子,但不能制造出新原子,C项正确;化学研究会造成严重的环境污染,但人类可以利用化学反应将有毒物质转化为无毒物质,并进一步解决环境污染问题,D项错误。
3.【答案】C
【解析】化学成为一门科学并较快发展,始于原子-分子学说的建立。
4.【答案】C
【解析】在化学变化过程中,元素的种类、原子的种类、数目不发生变化,原子之间重新组合生成新物质,如A、B、D三项;
而C项中原子弹爆炸是核反应,不属于化学变化,因而不属于化学科学研究的范畴。
5.【答案】C
【解析】配制一定物质的量浓度的溶液所用的基本仪器是容量瓶,A不正确;因为不知道11.2
L
O3是否处于标准状况下,所以无法计算其物质的量,B不正确;NO2、CO2都是一个分子中含有两个氧原子,C正确;常温常压下,气体的摩尔体积与标准状况下的不同,不能用22.4
L·mol-1计算,D不正确。
6.【答案】A
【解析】青蒿素的摩尔质量为282
g·mol-1,A项正确;青蒿素中C、H、O的物质的量之比为15∶22∶5,B项错误;青蒿素在标准状况下不是气体,C项错误;青蒿素中不含H2,D项错误。
7.【答案】C
【解析】A项,Na和水反应生成H2和NaOH,Na2O2和水反应生成NaOH和O2,NaOH和FeCl3反应生成Fe(OH)3沉淀,正确;B项,Na2O2是金属氧化物,和水反应生成O2,正确;C项,Na2O和Na2O2组成元素相同,Na2O与CO2反应生成碳酸钠,Na2O2与CO2反应生成Na2CO3和O2,错误;D项,Na燃烧生成Na2O2,Na2O2能与CO2和水反应均生成O2,正确。
8.【答案】D
【解析】依题意,配制1.0
mol·L-1的NaOH溶液220
mL,要用250
mL容量瓶,则需要NaOH固体10.0
g,A项错误;B、C项中的操作都会使配制的溶液浓度偏低,B、C错误。
9.【答案】C
【解析】漂白粉在空气中失效的原因是Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO,2HClO2HCl+O2↑。
10.【答案】C
【解析】酒精为液体,不适用气体摩尔体积,A项错误;标准状况下,1
mol任何气体体积约为22.4
L
,B项错误;氮气、氧气可共存,C项正确;通常状况下,1
mol
N2体积不是22.4
L,D项错误。
11.【答案】D
【解析】摩尔质量是单位物质的量的物质所具有的质量,用符号M表示,常用单位是g·mol-1。当物质的质量以克为单位时,物质的摩尔质量与1
mol该物质的质量在数值上都等于其相对分子质量或相对原子质量,但二者的单位不同。
12.【答案】C
【解析】 A项,HClO见光分解生成氧气;B项,氯水中的H+与发酵粉中的NaHCO3反应生成CO2;C项,氯水滴入NaOH溶液中反应生成NaClO和NaCl,没有气体产生;D项,H2O与Na2O2反应产生O2。
13.【答案】B
【解析】根据氧原子守恒可知:4×amol×NA=b,NA=mol-1。
14.【答案】B
【解析】质量相等,三种气体的物质的量或气体分子数与摩尔质量成反比;等质量、等体积的三种气体,其密度相等;同温同体积同质量气体的压强之比等于其摩尔质量倒数之比。
15.【答案】B
【解析】在4℃时,1
mL水的质量为1
g,物质的量为mol,含水分子数为个,
1滴水中所含的水分子数为。
16.【答案】(1)Cl2+H2O===HCl+HClO
(2)①酸性和漂白性(或强氧化性)
②a.AgCl b.H2O HClO
③取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色
(3)①氯气的溶解度不大,且生成的HClO不稳定,难保存
②CaCO3CaO+CO2↑、CaO+H2O===Ca(OH)2、2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
【解析】(1)把Cl2通入水中,氯气与水反应生成盐酸和次氯酸,反应的化学方程式是Cl2+H2O===HCl+HClO。
(2)①实验Ⅰ把氯水点在蓝色石蕊试纸上,试纸先变红,证明氯水呈酸性;后褪色,说明氯水具有漂白性。②实验
Ⅱ:a.向氯水中滴加足量AgNO3溶液,不断振荡,有白色沉淀生成,发生的反应为AgNO3+HCl===AgCl↓+HNO3,白色沉淀是AgCl。b.综合ⅰ和ⅱ现象,该同学推测实验Ⅱ发生的反应为Cl2+AgNO3+H2O===HNO3+AgCl↓+HClO。③为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,应先验证硝酸没有漂白性,再验证次氯酸具有漂白性,故上述实验d的方案是取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色。
(3)①直接用氯气做漂白剂,“使用起来不方便,效果也不理想”的原因是氯气的溶解度不大,且生成的HClO不稳定,难保存。②以氯气、石灰石、水为原料制取漂白粉的有关反应的化学方程式是CaCO3CaO+CO2↑、CaO+H2O===Ca(OH)2、2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。
17.【答案】(1)
c
(2)
A①饱和碳酸氢钠溶液 ②吸收多余氨气 ③过滤B①a NH3 b CO2 ②增大气体与溶液接触面积,提高CO2吸收率
(3)用碳酸氢铵与适量饱和食盐水反应,或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
【解析】(1)碳酸氢钠易溶于水,
a错误;碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,
b错误;碳酸氢钠的溶解度相对最小,在溶液中首先结晶析出,c正确。
(2)A①盐酸易挥发,利用盐酸制取的二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,通过碳酸氢钠溶液可除掉二氧化碳气体中的氯化氢气体。②丁中稀硫酸可吸收挥发出的氨气。③分离固体与液体常采用的实验操作是过滤。
B①制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,先通入氨气使溶液呈碱性,可增加CO2的溶解量;由于氨气溶解度大,如果将氨气直接通入水中溶解,容易产生倒吸,所以从图中导管下端位置可知a通NH3,b通CO2。②装置改动后二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率。(3)从题干信息NH4HCO3+NaCl===NaHCO3↓+NH4Cl可得,碳酸氢钠的溶解度小于碳酸钠,可在饱和Na2CO3溶液中通入过量CO2:Na2CO3+CO2+H2O===2NaHCO3↓,也可采用烧碱溶液中通入过量CO2,NaOH+CO2===NaHCO3。
18.【答案】(1)8 72 (2)100
mL
【解析】(1)需氢氧化钠的质量=80
g×10%=8
g,需水的质量=80
g-8
g=72
g,水的体积为72
mL。
(2)因为需要的水的体积是72
mL,应选用规格为100
mL的量筒来量取所需要的水。
19.【答案】(1)5∶4 5∶6 5∶4 4∶5 (2)3∶4
(3)8.3 (4)①偏低 ②偏高 ③偏低
【解析】(1)设SO2与SO3均为1
g,则
n(SO2)==mol,
n(SO3)==mol,
则SO2中n(O)=2n(SO2)=mol,SO3中n(O)=mol,故分子数之比为∶=5∶4,氧原子数之比为∶=5∶6。据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2)∶V(SO3)=5∶4,密度之比等于摩尔质量之比,即ρ(SO2)∶ρ(SO3)=64∶80=4∶5。
(2)设有100
g混合物,则氧元素的质量为70
g,硫元素的质量为30
g,二氧化硫中硫元素的质量分数为50%,则二氧化硫的质量为=60
g,氧气的质量为100
g-60
g=40
g,氧气的摩尔质量是32
g·mol-1,二氧化硫的摩尔质量是64
g·mol-1,SO2与O2的物质的量之比为∶=3∶4,同温同压下气体的密度比等于摩尔质量比,混合气体的密度比等于摩尔质量比,混合气体的平均摩尔质量为g·mol-1=g·mol-1,混合气体与氧气的平均摩尔质量比为∶32=∶1,所以混合气体的密度是氧气密度的倍。
(3)根据稀释前后硫酸的物质的量不变可知:
2.4
mol·L-1×V=0.100
L×0.2
mol·L-1,V=0.008
3
L,故需要量取2.4
mol·L-1的H2SO4溶液的体积是8.3
mL。
(4)误差分析根据公式c=进行分析,若未洗涤烧杯和玻璃棒,则n减小,V不变,c偏低;若定容时俯视,则使所加溶液体积变小,n不变,V减小,c偏高;若摇匀后发现低于液面再加蒸馏水,则会使V变大,由于n不变,则c偏低。
20.【答案】(1)1∶2∶3 (2)∶∶(或36∶69∶92) (3)2∶1∶1
【解析】(1)金属完全反应,令金属的物质的量均为1
mol,根据得失电子守恒,Na反应生成氢气的物质的量为=0.5
mol,Mg反应生成氢气的物质的量为=1
mol,Al反应生成氢气的物质的量为=1.5
mol,相同条件下,气体体积之比等于物质的量之比,则等物质的量的Na、Mg、Al生成氢气体积之比=0.5
mol∶1
mol∶1.5
mol=1∶2∶3。
(2)金属完全反应,令金属的质量均为1
g,则利用反应关系式:
2
Na~H2↑
46
2
1
gm
列比例式可得:m==g;
同理可得1
g
Mg、Al反应产生氢气的质量分别为g、g,即质量相同的Na、Mg、Al生成氢气的质量之比=g∶g∶g=36∶69∶92。相同条件下,氢气的体积之比等于其质量之比。
(3)100
mL
1
mol·L-1的盐酸中H+物质的量为0.1
L×1
mol·L-1=0.1
mol,若将0.2
mol金属钠、镁、铝分别投入到100
mL
1
mol·L-1的盐酸中,可知三种金属都过量,盐酸不足,但金属钠能与水继续反应生成氢气,所以镁、铝反应生成的氢气一样多,其生成氢气的物质的量为=0.05
mol,而钠反应生成的氢气最多,其生成氢气的物质的量为=0.1
mol,故Na、Mg、Al生成氢气的体积比为0.1
mol∶0.05
mol∶0.05
mol=2∶1∶1。
21.【答案】200
【解析】n(Cl2)==0.25
mol;n(H2)==0.3
mol。由H2+Cl22HCl可知H2过量0.05
mol,由Cl2的物质的量0.25
mol可求出生成的HCl为0.5
mol。再根据HCl+NaOH===NaCl+H2O,可确定需要NaOH的物质的量为0.5
mol。故所需NaOH溶液的体积为:=0.2
L,即200
mL。
22.【答案】 (1)8.2mol (2)9.9×1021
【解析】 (1)500
g×96%÷58.5
g·mol-1≈8.2
mol。
(2)0.5
g×96%÷58.5
g·mol-1×2×6.02×1023mol-1≈9.9×1021。
23.【答案】(1)29.82% (2)15.8
mol·L-1 (3)3.16
mol·L-1
【解析】(1)n(NH3)===25
mol;m(NH3)=25
mol×17
g·mol-1=425
g;m(H2O)=1
000
mL×1
g·mL-1=1
000
g。m(溶液)=1
000
g+425
g=1
425
g。质量分数为×100%=29.82%。
(2)可由c=进行转化计算。
24.【答案】(1)HCO+H+===CO2↑+H2O
(2)CO+2H+===
CO2↑+H2O
(3)
CO+H+===
HCO
(4)CO+H+===
HCO,HCO+H+===CO2↑+H2O
【解析】碳酸钠、碳酸氢钠都能与盐酸反应,生成氯化钠、二氧化碳和水;要注意的是碳酸钠与盐酸反应时,加入的顺序不同,其现象不同;碳酸钠与盐酸的用量不同,其产物可能不同。
一、单选题(共15小题)
1.如图装置用来检验氯气的部分性质,下列说法不正确的是( )
A.
装置A的作用是除去氯气中的水蒸气
B.
该实验必须在通风橱中进行
C.
装置C中发生反应为Cl2+2NaOH===NaCl+NaClO+H2O
D.
装置B的现象是干燥布条退色,湿润布条不退色
2.下列说法中,不正确的是( )
A.
化学家可以制造出自然界中不存在的物质
B.
化学的特征就是认识分子和制造分子,是一门具有创造性和实用性的科学
C.
利用化学变化可以制造出新的分子,但不能制造出新的原子
D.
化学研究会造成严重的环境污染,最终人类将会毁灭在化学物质中
3.化学成为一门科学并较快发展,始于( )
A.
舍勒发现氧气
B.
质量守恒定律的发现
C.
原子-分子学说的问世
D.
中国湿法冶金技术的推广
4.下列变化不属于化学科学研究范畴的是( )
A.
电解水生成氢气和氧气
B.
合成有机高分子材料
C.
原子弹爆炸
D.
生产合成纤维和合成橡胶
5.下列说法中正确的是
( )
A.
在50
mL量筒中配制0.100
0
mol·L-1的碳酸钠溶液
B.
0.5
mol
O3与11.2
L
O3所含的分子数一定相等
C.
分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
D.
常温常压下,22.4
L的NO2和CO2混合气体中含有2NA个氧原子
6.中国药学家屠呦呦因发现青蒿素,开创了治疗疟疾的新方法,荣获诺贝尔奖。已知青蒿素的分子式为C15H22O5。下列有关说法正确的是( )
A.
青蒿素的摩尔质量为282
g·mol-1
B.
青蒿素中C、H、O的质量之比为15∶22∶5
C.
1
mol青蒿素的体积约为22.4
L
D.
1
mol青蒿素中含11
mol
H2
7.下列说法不正确的是( )
A.
金属Na和Na2O2分别投入到FeCl3溶液中,都既有气体放出又有沉淀生成
B.
Na2O2能和水反应生成O2
C.
Na2O和Na2O2组成元素相同,与CO2反应产物也相同
D.
钠着火不可以用泡沫灭火剂或水灭火,可以用沙子盖灭
8.用NaOH固体配制1.0
mol·L-1的NaOH溶液220
mL,下列说法正确的是
( )
A.
首先称取NaOH固体8.8
g
B.
定容时仰视刻度线会使所配制的溶液浓度偏高
C.
定容后将溶液摇匀,静置时发现液面低于刻度线,于是又加少量水至刻度线
D.
容量瓶中原有少量蒸馏水没有影响
9.漂白粉在空气中放置易失效的主要原因是( )
A.
Ca(ClO)2不稳定,易分解
B.
CaCl2易吸水而潮解
C.
Ca(ClO)2跟空气中的水和CO2反应
D.
Ca(ClO)2跟空气中的O2反应
10.下列说法中正确的是( )
A.
标准状况下,1
mol酒精的体积是22.4
L
B.
1
mol任何气体体积约为22.4
L
C.
在标准状况下,0.3
mol
氮气和0.7
mol氧气混合气体总体积约为22.4
L
D.
通常状况下,1
mol
氮气的体积约为22.4
L
11.下列说法中正确的是( )
A.
物质的摩尔质量等于其相对分子(或原子)质量
B.
物质的摩尔质量是该物质1
mol时的质量
C.
物质的摩尔质量等于其相对分子质量的6.02×1023倍
D.
摩尔质量的单位是g·mol-1
12.下列实验过程中没有气体产生的是( )
A.
A
B.
B
C.
C
D.
D
13.amol
H2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为( )
A.mol-1
B.mol-1
C.mol-1
D.mol-1
14.三个相同的恒温恒容密闭容器中分别盛有等质量的氢气、甲烷、氧气,下列说法正确的是
A.
三种气体的分子数目一定相等
B.
三种气体物质的量之比为16∶2∶1
C.
三种气体的密度之比为1∶2∶16
D.
三种气体的压强一定相等
15.4
℃时,若20滴水恰好为1
mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)( )
A.
20NA
B.NA/360
C.
9NA/10
D.
360/NA
二、实验题(共3小题)
16.氯元素是生产生活中常见的非金属元素。某同学欲探究Cl2及其化合物的性质。
(1)把Cl2通入水中,反应的化学方程式是__________________________________________
________________________________________________________________________。
(2)用氯水进行如下表实验:
①实验Ⅰ的现象说明,氯水具有的性质是________。
②实验Ⅱ:a.ⅰ现象中的白色沉淀是________。
b.综合ⅰ和ⅱ现象,该同学推测实验Ⅱ发生的反应为Cl2+AgNO3+________===HNO3+AgCl↓+_________________________________________________(将反应补充完整)。
③为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,该同学设计实验如下:
c.将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色。
d.……
上述实验d的方案是______________________________________________________________
________________________________________________________________________。
(3)该同学查阅资料得知,最初,人们直接用氯气做漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
①你认为“使用起来不方便,效果也不理想”的原因是______________________________
________________________________________________________________________。
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是______________。
17.我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关化学方程式:NH3+CO2+H2O===NH4HCO3;NH4HCO3+NaCl===NaHCO3↓+NH4Cl;2NaHCO3Na2CO3+CO2↑+H2O。
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是( )
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们设计了各种方案。
A同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。试回答下列有关问题:
①乙装置中的试剂是____________;
②丁装置中稀硫酸的作用是______________________;
③实验结束后,分离出NaHCO3晶体的操作是________(填分离操作的名称)。
B同学用图中戊装置(其它装置未画出)进行实验:
①实验时,须先从________管通入________
气体,再从________管中通入________气体;
②有同学建议在戊装置的b管下端连接己装置,理由是_____________________________;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:________________________________。
18.实验室欲配制80
g质量分数为10%的氢氧化钠溶液,如图是配制该氢氧化钠溶液的实验操作示意图。
三、计算题(共3小题)
19.根据要求回答下列问题。
(1)相同质量的SO2气体和SO3气体,其分子数之比为________,氧原子数之比为________,相同条件下(同温同压)的体积之比为________,密度之比为________。
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是________,这种混合气体的密度是同温同压下氧气密度的________倍。
(3)用2.4
mol·L-1的H2SO4溶液配制100
mL浓度为0.2
mol·L-1的稀硫酸,需量取2.4
mol·L-1的H2SO4溶液的体积是________mL。
(4)试分析下列操作对所配溶液的浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未洗涤烧杯和玻璃棒,使所配溶液浓度________;
②定容时俯视刻度线,使所配溶液浓度________;
③摇匀后,发现液面低于刻度线,又滴加蒸馏水,使所配溶液浓度________。
20.(1)等物质的量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为_________。
(2)等质量的钠、镁、铝分别与足量盐酸反应,产生的氢气在相同条件下的体积比为_________。
(3)将物质的量均为0.2
mol的钠、镁、铝分别投入100
mL
1
mol·L-1的盐酸中,三者产生的氢气在相同条件下的体积比为_________。
21.标准状况下,5.6
L氯气和6.72
L氢气的混合气体充分反应后,所得混合气体若用2.50
mol·L-1的NaOH溶液完全吸收,则需要NaOH溶液的体积为_________
mL。
四、填空题(共3小题)
22.有一瓶氯化钠试剂的标签如下图所示,仔细观察标签,然后回答下列问题。
氯化钠标签
(1)该瓶未开封的试剂中含氯化钠的物质的量为______。
(2)从上述试剂瓶中取出0.5
g样品配成溶液,溶液中Na+与Cl-总数为________。
23.在标准状况下,将560
L氨气溶于1
L水中所得氨水的密度为0.9
g·mL-1,计算:
(1)氨水中溶质的质量分数是__________。
(2)溶液中的物质的量浓度是__________。
(3)从中取出20
mL
加水稀释至100
mL后的物质的量浓度是__________。
24.写出下列反应的离子方程式:
(1)碳酸氢钠溶液与稀盐酸混合____________________;
(2)将碳酸钠溶液逐滴加入稀盐酸中________________________;
(3)将少量的稀盐酸逐滴加入碳酸钠溶液中____________________________________;
(4)将过量的稀盐酸逐滴加入碳酸钠溶液中____________________________________。
答案解析
1.【答案】D
【解析】 氯气没有漂白作用,次氯酸具有漂白作用,所以装置B中干燥布条不退色,湿润布条退色。
2.【答案】D
【解析】化学具有创造性,化学家可以制造出自然界中不存在的物质,A项正确;认识分子和制造分子,是化学的特征,体现了化学的创造性和实用性,B项正确;原子是化学变化中的最小微粒,分子是保持物质性质的最小微粒,则利用化学方法,我们可以制造出新的分子,但不能制造出新原子,C项正确;化学研究会造成严重的环境污染,但人类可以利用化学反应将有毒物质转化为无毒物质,并进一步解决环境污染问题,D项错误。
3.【答案】C
【解析】化学成为一门科学并较快发展,始于原子-分子学说的建立。
4.【答案】C
【解析】在化学变化过程中,元素的种类、原子的种类、数目不发生变化,原子之间重新组合生成新物质,如A、B、D三项;
而C项中原子弹爆炸是核反应,不属于化学变化,因而不属于化学科学研究的范畴。
5.【答案】C
【解析】配制一定物质的量浓度的溶液所用的基本仪器是容量瓶,A不正确;因为不知道11.2
L
O3是否处于标准状况下,所以无法计算其物质的量,B不正确;NO2、CO2都是一个分子中含有两个氧原子,C正确;常温常压下,气体的摩尔体积与标准状况下的不同,不能用22.4
L·mol-1计算,D不正确。
6.【答案】A
【解析】青蒿素的摩尔质量为282
g·mol-1,A项正确;青蒿素中C、H、O的物质的量之比为15∶22∶5,B项错误;青蒿素在标准状况下不是气体,C项错误;青蒿素中不含H2,D项错误。
7.【答案】C
【解析】A项,Na和水反应生成H2和NaOH,Na2O2和水反应生成NaOH和O2,NaOH和FeCl3反应生成Fe(OH)3沉淀,正确;B项,Na2O2是金属氧化物,和水反应生成O2,正确;C项,Na2O和Na2O2组成元素相同,Na2O与CO2反应生成碳酸钠,Na2O2与CO2反应生成Na2CO3和O2,错误;D项,Na燃烧生成Na2O2,Na2O2能与CO2和水反应均生成O2,正确。
8.【答案】D
【解析】依题意,配制1.0
mol·L-1的NaOH溶液220
mL,要用250
mL容量瓶,则需要NaOH固体10.0
g,A项错误;B、C项中的操作都会使配制的溶液浓度偏低,B、C错误。
9.【答案】C
【解析】漂白粉在空气中失效的原因是Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO,2HClO2HCl+O2↑。
10.【答案】C
【解析】酒精为液体,不适用气体摩尔体积,A项错误;标准状况下,1
mol任何气体体积约为22.4
L
,B项错误;氮气、氧气可共存,C项正确;通常状况下,1
mol
N2体积不是22.4
L,D项错误。
11.【答案】D
【解析】摩尔质量是单位物质的量的物质所具有的质量,用符号M表示,常用单位是g·mol-1。当物质的质量以克为单位时,物质的摩尔质量与1
mol该物质的质量在数值上都等于其相对分子质量或相对原子质量,但二者的单位不同。
12.【答案】C
【解析】 A项,HClO见光分解生成氧气;B项,氯水中的H+与发酵粉中的NaHCO3反应生成CO2;C项,氯水滴入NaOH溶液中反应生成NaClO和NaCl,没有气体产生;D项,H2O与Na2O2反应产生O2。
13.【答案】B
【解析】根据氧原子守恒可知:4×amol×NA=b,NA=mol-1。
14.【答案】B
【解析】质量相等,三种气体的物质的量或气体分子数与摩尔质量成反比;等质量、等体积的三种气体,其密度相等;同温同体积同质量气体的压强之比等于其摩尔质量倒数之比。
15.【答案】B
【解析】在4℃时,1
mL水的质量为1
g,物质的量为mol,含水分子数为个,
1滴水中所含的水分子数为。
16.【答案】(1)Cl2+H2O===HCl+HClO
(2)①酸性和漂白性(或强氧化性)
②a.AgCl b.H2O HClO
③取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色
(3)①氯气的溶解度不大,且生成的HClO不稳定,难保存
②CaCO3CaO+CO2↑、CaO+H2O===Ca(OH)2、2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
【解析】(1)把Cl2通入水中,氯气与水反应生成盐酸和次氯酸,反应的化学方程式是Cl2+H2O===HCl+HClO。
(2)①实验Ⅰ把氯水点在蓝色石蕊试纸上,试纸先变红,证明氯水呈酸性;后褪色,说明氯水具有漂白性。②实验
Ⅱ:a.向氯水中滴加足量AgNO3溶液,不断振荡,有白色沉淀生成,发生的反应为AgNO3+HCl===AgCl↓+HNO3,白色沉淀是AgCl。b.综合ⅰ和ⅱ现象,该同学推测实验Ⅱ发生的反应为Cl2+AgNO3+H2O===HNO3+AgCl↓+HClO。③为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,应先验证硝酸没有漂白性,再验证次氯酸具有漂白性,故上述实验d的方案是取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色。
(3)①直接用氯气做漂白剂,“使用起来不方便,效果也不理想”的原因是氯气的溶解度不大,且生成的HClO不稳定,难保存。②以氯气、石灰石、水为原料制取漂白粉的有关反应的化学方程式是CaCO3CaO+CO2↑、CaO+H2O===Ca(OH)2、2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O。
17.【答案】(1)
c
(2)
A①饱和碳酸氢钠溶液 ②吸收多余氨气 ③过滤B①a NH3 b CO2 ②增大气体与溶液接触面积,提高CO2吸收率
(3)用碳酸氢铵与适量饱和食盐水反应,或往烧碱溶液中通入过量CO2;或往饱和Na2CO3溶液中通入过量CO2等
【解析】(1)碳酸氢钠易溶于水,
a错误;碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,
b错误;碳酸氢钠的溶解度相对最小,在溶液中首先结晶析出,c正确。
(2)A①盐酸易挥发,利用盐酸制取的二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,通过碳酸氢钠溶液可除掉二氧化碳气体中的氯化氢气体。②丁中稀硫酸可吸收挥发出的氨气。③分离固体与液体常采用的实验操作是过滤。
B①制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,先通入氨气使溶液呈碱性,可增加CO2的溶解量;由于氨气溶解度大,如果将氨气直接通入水中溶解,容易产生倒吸,所以从图中导管下端位置可知a通NH3,b通CO2。②装置改动后二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率。(3)从题干信息NH4HCO3+NaCl===NaHCO3↓+NH4Cl可得,碳酸氢钠的溶解度小于碳酸钠,可在饱和Na2CO3溶液中通入过量CO2:Na2CO3+CO2+H2O===2NaHCO3↓,也可采用烧碱溶液中通入过量CO2,NaOH+CO2===NaHCO3。
18.【答案】(1)8 72 (2)100
mL
【解析】(1)需氢氧化钠的质量=80
g×10%=8
g,需水的质量=80
g-8
g=72
g,水的体积为72
mL。
(2)因为需要的水的体积是72
mL,应选用规格为100
mL的量筒来量取所需要的水。
19.【答案】(1)5∶4 5∶6 5∶4 4∶5 (2)3∶4
(3)8.3 (4)①偏低 ②偏高 ③偏低
【解析】(1)设SO2与SO3均为1
g,则
n(SO2)==mol,
n(SO3)==mol,
则SO2中n(O)=2n(SO2)=mol,SO3中n(O)=mol,故分子数之比为∶=5∶4,氧原子数之比为∶=5∶6。据阿伏加德罗定律:体积之比等于物质的量之比,即V(SO2)∶V(SO3)=5∶4,密度之比等于摩尔质量之比,即ρ(SO2)∶ρ(SO3)=64∶80=4∶5。
(2)设有100
g混合物,则氧元素的质量为70
g,硫元素的质量为30
g,二氧化硫中硫元素的质量分数为50%,则二氧化硫的质量为=60
g,氧气的质量为100
g-60
g=40
g,氧气的摩尔质量是32
g·mol-1,二氧化硫的摩尔质量是64
g·mol-1,SO2与O2的物质的量之比为∶=3∶4,同温同压下气体的密度比等于摩尔质量比,混合气体的密度比等于摩尔质量比,混合气体的平均摩尔质量为g·mol-1=g·mol-1,混合气体与氧气的平均摩尔质量比为∶32=∶1,所以混合气体的密度是氧气密度的倍。
(3)根据稀释前后硫酸的物质的量不变可知:
2.4
mol·L-1×V=0.100
L×0.2
mol·L-1,V=0.008
3
L,故需要量取2.4
mol·L-1的H2SO4溶液的体积是8.3
mL。
(4)误差分析根据公式c=进行分析,若未洗涤烧杯和玻璃棒,则n减小,V不变,c偏低;若定容时俯视,则使所加溶液体积变小,n不变,V减小,c偏高;若摇匀后发现低于液面再加蒸馏水,则会使V变大,由于n不变,则c偏低。
20.【答案】(1)1∶2∶3 (2)∶∶(或36∶69∶92) (3)2∶1∶1
【解析】(1)金属完全反应,令金属的物质的量均为1
mol,根据得失电子守恒,Na反应生成氢气的物质的量为=0.5
mol,Mg反应生成氢气的物质的量为=1
mol,Al反应生成氢气的物质的量为=1.5
mol,相同条件下,气体体积之比等于物质的量之比,则等物质的量的Na、Mg、Al生成氢气体积之比=0.5
mol∶1
mol∶1.5
mol=1∶2∶3。
(2)金属完全反应,令金属的质量均为1
g,则利用反应关系式:
2
Na~H2↑
46
2
1
gm
列比例式可得:m==g;
同理可得1
g
Mg、Al反应产生氢气的质量分别为g、g,即质量相同的Na、Mg、Al生成氢气的质量之比=g∶g∶g=36∶69∶92。相同条件下,氢气的体积之比等于其质量之比。
(3)100
mL
1
mol·L-1的盐酸中H+物质的量为0.1
L×1
mol·L-1=0.1
mol,若将0.2
mol金属钠、镁、铝分别投入到100
mL
1
mol·L-1的盐酸中,可知三种金属都过量,盐酸不足,但金属钠能与水继续反应生成氢气,所以镁、铝反应生成的氢气一样多,其生成氢气的物质的量为=0.05
mol,而钠反应生成的氢气最多,其生成氢气的物质的量为=0.1
mol,故Na、Mg、Al生成氢气的体积比为0.1
mol∶0.05
mol∶0.05
mol=2∶1∶1。
21.【答案】200
【解析】n(Cl2)==0.25
mol;n(H2)==0.3
mol。由H2+Cl22HCl可知H2过量0.05
mol,由Cl2的物质的量0.25
mol可求出生成的HCl为0.5
mol。再根据HCl+NaOH===NaCl+H2O,可确定需要NaOH的物质的量为0.5
mol。故所需NaOH溶液的体积为:=0.2
L,即200
mL。
22.【答案】 (1)8.2mol (2)9.9×1021
【解析】 (1)500
g×96%÷58.5
g·mol-1≈8.2
mol。
(2)0.5
g×96%÷58.5
g·mol-1×2×6.02×1023mol-1≈9.9×1021。
23.【答案】(1)29.82% (2)15.8
mol·L-1 (3)3.16
mol·L-1
【解析】(1)n(NH3)===25
mol;m(NH3)=25
mol×17
g·mol-1=425
g;m(H2O)=1
000
mL×1
g·mL-1=1
000
g。m(溶液)=1
000
g+425
g=1
425
g。质量分数为×100%=29.82%。
(2)可由c=进行转化计算。
24.【答案】(1)HCO+H+===CO2↑+H2O
(2)CO+2H+===
CO2↑+H2O
(3)
CO+H+===
HCO
(4)CO+H+===
HCO,HCO+H+===CO2↑+H2O
【解析】碳酸钠、碳酸氢钠都能与盐酸反应,生成氯化钠、二氧化碳和水;要注意的是碳酸钠与盐酸反应时,加入的顺序不同,其现象不同;碳酸钠与盐酸的用量不同,其产物可能不同。
