江苏省徐州师范大学附属中学2011-2012学年高二下学期期中考试化学试题
文档属性
| 名称 | 江苏省徐州师范大学附属中学2011-2012学年高二下学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 101.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-30 09:56:04 | ||
图片预览


文档简介
徐州师范大学附属中学2011-2012学年高二下学期期中考试化学试题
本试卷分第Ⅰ卷和第Ⅱ卷(非选择题)两部分。共120分,考试时间100分钟。
考生注意:
1.答第I卷前,考生务必在答题卡上用0.5mm签字笔清楚填写姓名、座位号和班级。
2.第I卷(1—15小题),答案必须全部写在答题卡上,写在试卷上一律不给分
3.可能用到的相对原子质量:H—1 C—12 N—14 O—16
第Ⅰ卷(选择题 共40分)
一、单项选择题:本题包括10小题,每题2分,共计20分。每小题只有一个选项符合题意。
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B.用液氢代替汽油 C.开发风能 D.开发地热能
2. 下列有利于反应自发进行的是
①反应吸热 ②反应放热 ③反应后熵增加 ④反应后熵减小
A.①③ B.②③ C.②④ D.①④
3.下列离子中能使纯水的电离程度减小的是
A.F— B.HCO3— C.Cl— D.HCOOH
4.某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为
A. 大于25.3% B. 小于25.3% C. 等于25.3% D.无法确定
5.SO2是大气中常见的污染气体,溶于水后形成的溶液能导电,则SO2属于
A.强电解质 B.弱电解质 C.非电解质 D.不是电解质也不是非电解质
6.反应CO+H2O(g)CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是
A. 将压强减小至原来的一半 B. 将反应温度升高至1200 K
C. 添加催化剂 D. 增大水蒸气的浓度
7.在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是
①FeCl3溶液与Cu的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 ③FeCl3溶液与KI的反应 ④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 ⑤FeCl3溶液与H2S的反应⑥FeCl3溶液与NaHCO3溶液的反应 ⑦配制FeCl3溶液需加入一定量的盐酸
A. ①④⑥ B. ②③⑤⑥ C.②④⑥⑦ D. ①②③④⑤⑥⑦
8. 对于平衡体系:aA(g)+bB(g)cC(g)+dD(s) △H<0,下列判断中正确的是
A.若(a+b)<(c+d),则反应一定能自发向右进行。
B.若从正反应开始,起始时A、B的物质的量之比为a :b,则平衡时A、B的转化率之比也为a :b
C.若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量等于(m+n)mol。
D.若a+b=c ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大
9.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
10.电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电
解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3
的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性
变化如右图,则加入氨水前CH3COOH的电离度为
A.0.5% B.1.5% C.0.1% D.1%
二、不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
C.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液c(Na+)=c(NO3-)
12.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:
2C1— + 2H2O H2↑ + Cl2↑ + 2OH—
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe一2e—=Fe2+
13.下列溶液中离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.由水电离的c(H+) =10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.在pH=1的溶液中:NH4+、K+、NO3-、Cl-
D.有NO3—存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
14.某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:
C(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:
C(CH3COO-)>c(Na+)>c(H+)>c(OH-)
15.今有反应X(g)+Y(g) 3Z(g);△H<0若反应开始经t1秒后达到
平衡,经t2秒后,由于反应条件的改变使平衡破坏, t3时又达到平
衡,如图示,试分析,从t2到t3秒曲线变化的原因是
A.增加了反应体系的压强 B.使用了催化剂
C.升高了反应的温度 D.增大了X和Y的浓度
第Ⅱ卷 非选择题(共80分)
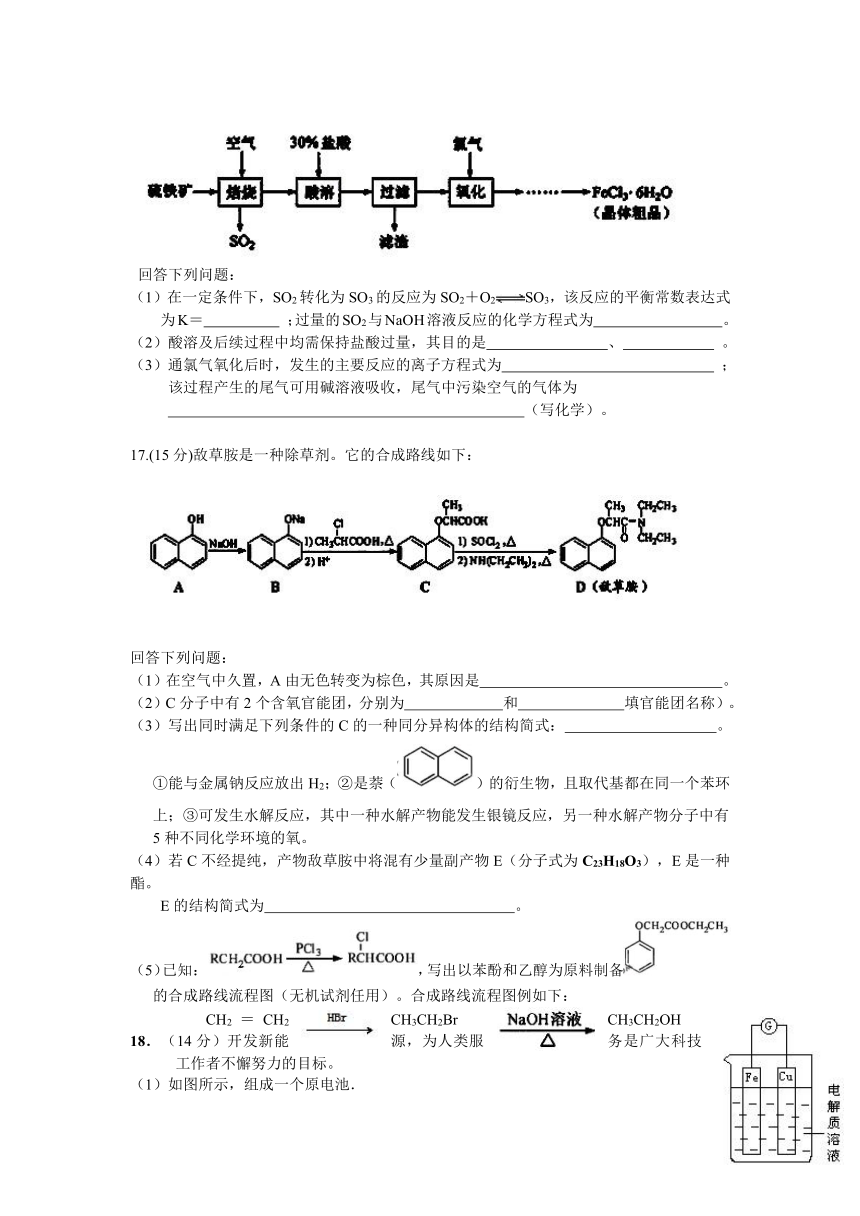
16.(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为SO2+O2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学)。
17.(15分)敌草胺是一种除草剂。它的合成路线如下:
回答下列问题:
(1)在空气中久置,A由无色转变为棕色,其原因是 。
(2)C分子中有2个含氧官能团,分别为 和 填官能团名称)。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式: 。
①能与金属钠反应放出H2;②是萘()的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧。
(4)若C不经提纯,产物敌草胺中将混有少量副产物E(分子式为C23H18O3),E是一种酯。
E的结构简式为 。
(5)已知:,写出以苯酚和乙醇为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
CH2=CH2 CH3CH2Br CH3CH2OH
18.(14分)开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____;
②当电解质溶液为浓硝酸时:Cu电极是___极,其电极反应为_____。
(2)请写出电解硫酸铜溶液的总化学方程式 。
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学
方程式为: 。
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)
为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。
写出B极发生的电极反应式: 。
19.(12分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有__ _。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_________式滴定管。
②滴定时眼睛应 。
③有关数据记录如下:
测定序号 待测溶液的体积/mL 所耗盐酸标准液的体积/mL
滴定前 滴定后
1 20.00 0.50 20.78
2 20.00 1.20 21.32
(3)计算:烧碱样品的纯度是_________________。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
20.(15分)一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:
3A(g)+B (g)xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为_________,x=_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是_________;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件_________(可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入______molA气体和_______molB气体。
21.(12分)
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为_______ mol·L-1 。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是_________(填序号)。
① 0.2 mol·L-1的CuSO4溶液 ② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl ④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A ==== H+ + HA- , HA- H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-)
D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
参考答案
1 2 3 4 5 6 7 8 9 10
A B D C C B C D A D
11 12 13 14 15
AD D BC AD C
16.(12分)
(1)k=c2(SO3)/c(O2)·c2(SO2) SO2+NaOH=NaHSO3
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+Fe2+=2Cl-+Fe3+ Cl2 HCl
【分析】本题让元素化合物知识与生产工艺、化学平衡原理结合起来,引导中学化学教学关注化学学科的应用性和实践性。本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力。
【备考提示】我们元素化合物知识教学要与基本实验实验、化工生产工艺、日常生活等结合起来,做到学以致用,而不是简单的来回重复和死记硬背。
17.(15分)
(1)A被空气中的O2氧化
(2)羟基 醚键
【分析】本题是一道基础有机合成题,仅将敌草胺的合成过程列出,着力考查阅读有机合成方案、利用题设信息、解决实际问题的能力,也考查了学生对信息接受和处理的敏锐程度、思维的整体性和对有机合成的综合分析能力。本题涉及到有机物性质、有机官能团、同分异构体推理和书写,合成路线流程图设计与表达,重点考查课学生思维的敏捷性和灵活性,对学生的信息获取和加工能力提出较高要求。
【备考提示】解答有机推断题时,我们应首先要认真审题,分析题意,从中分离出已知条件和推断内容,弄清被推断物和其他有机物的关系,以特征点作为解题突破口,结合信息和相关知识进行推理,排除干扰,作出正确推断。一般可采取的方法有:顺推法(以有机物结构、性质和实验现象为主线,采用正向思维,得出正确结论)、逆推法(以有机物结构、性质和实验现象为主线,采用逆向思维,得出正确结论)、多法结合推断(综合应用顺推法和逆推法)等。关注官能团种类的改变,搞清反应机理。
本试卷分第Ⅰ卷和第Ⅱ卷(非选择题)两部分。共120分,考试时间100分钟。
考生注意:
1.答第I卷前,考生务必在答题卡上用0.5mm签字笔清楚填写姓名、座位号和班级。
2.第I卷(1—15小题),答案必须全部写在答题卡上,写在试卷上一律不给分
3.可能用到的相对原子质量:H—1 C—12 N—14 O—16
第Ⅰ卷(选择题 共40分)
一、单项选择题:本题包括10小题,每题2分,共计20分。每小题只有一个选项符合题意。
1.石油是一种重要能源,人类正面临着石油短缺、油价上涨的困惑。以下解决能源问题的方法不当的是
A.用木材作燃料 B.用液氢代替汽油 C.开发风能 D.开发地热能
2. 下列有利于反应自发进行的是
①反应吸热 ②反应放热 ③反应后熵增加 ④反应后熵减小
A.①③ B.②③ C.②④ D.①④
3.下列离子中能使纯水的电离程度减小的是
A.F— B.HCO3— C.Cl— D.HCOOH
4.某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为
A. 大于25.3% B. 小于25.3% C. 等于25.3% D.无法确定
5.SO2是大气中常见的污染气体,溶于水后形成的溶液能导电,则SO2属于
A.强电解质 B.弱电解质 C.非电解质 D.不是电解质也不是非电解质
6.反应CO+H2O(g)CO2+H2在1000 K达到平衡时,分别改变下列条件,平衡常数K值发生变化的是
A. 将压强减小至原来的一半 B. 将反应温度升高至1200 K
C. 添加催化剂 D. 增大水蒸气的浓度
7.在下列有FeCl3溶液参加的反应中,与Fe3+水解有关的反应是
①FeCl3溶液与Cu的反应 ②将FeCl3溶液加热蒸干,并灼烧最终得到Fe2O3 ③FeCl3溶液与KI的反应 ④饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 ⑤FeCl3溶液与H2S的反应⑥FeCl3溶液与NaHCO3溶液的反应 ⑦配制FeCl3溶液需加入一定量的盐酸
A. ①④⑥ B. ②③⑤⑥ C.②④⑥⑦ D. ①②③④⑤⑥⑦
8. 对于平衡体系:aA(g)+bB(g)cC(g)+dD(s) △H<0,下列判断中正确的是
A.若(a+b)<(c+d),则反应一定能自发向右进行。
B.若从正反应开始,起始时A、B的物质的量之比为a :b,则平衡时A、B的转化率之比也为a :b
C.若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量等于(m+n)mol。
D.若a+b=c ,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强增大
9.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)N2(g)+2CO2(g)。下列说法不正确的是
A.升高温度可使该反应的逆反应速率降低
B.使用高效催化剂可有效提高正反应速率
C.反应达到平衡后,NO的反应速率保持恒定
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
10.电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电
解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3
的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性
变化如右图,则加入氨水前CH3COOH的电离度为
A.0.5% B.1.5% C.0.1% D.1%
二、不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
C.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液c(Na+)=c(NO3-)
12.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:
2C1— + 2H2O H2↑ + Cl2↑ + 2OH—
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe一2e—=Fe2+
13.下列溶液中离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.由水电离的c(H+) =10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.在pH=1的溶液中:NH4+、K+、NO3-、Cl-
D.有NO3—存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
14.某溶液中仅含Na+、H+、OH-、CH3COO-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.若溶液中部分粒子间满足:c(CH3COO-)=c(Na+)则该溶液一定呈中性
C.若溶液中溶质仅为CH3COONa,则粒子间一定满足:
C(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.若溶液中的溶质为CH3COONa和CH3COOH,则溶液中粒子间一定满足:
C(CH3COO-)>c(Na+)>c(H+)>c(OH-)
15.今有反应X(g)+Y(g) 3Z(g);△H<0若反应开始经t1秒后达到
平衡,经t2秒后,由于反应条件的改变使平衡破坏, t3时又达到平
衡,如图示,试分析,从t2到t3秒曲线变化的原因是
A.增加了反应体系的压强 B.使用了催化剂
C.升高了反应的温度 D.增大了X和Y的浓度
第Ⅱ卷 非选择题(共80分)
16.(12分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为SO2+O2SO3,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为
(写化学)。
17.(15分)敌草胺是一种除草剂。它的合成路线如下:
回答下列问题:
(1)在空气中久置,A由无色转变为棕色,其原因是 。
(2)C分子中有2个含氧官能团,分别为 和 填官能团名称)。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式: 。
①能与金属钠反应放出H2;②是萘()的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧。
(4)若C不经提纯,产物敌草胺中将混有少量副产物E(分子式为C23H18O3),E是一种酯。
E的结构简式为 。
(5)已知:,写出以苯酚和乙醇为原料制备的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
CH2=CH2 CH3CH2Br CH3CH2OH
18.(14分)开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池.
①当电解质溶液为稀硫酸时:
Cu电极是_____(填“正”或“负”)极,其电极反应为____;
②当电解质溶液为浓硝酸时:Cu电极是___极,其电极反应为_____。
(2)请写出电解硫酸铜溶液的总化学方程式 。
(3)燃烧氢气时耗氧量小,放出热量多。已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2燃烧热的热化学
方程式为: 。
(4)下图是一碳酸盐燃料电池(MCFC),以水煤气(CO、H2)
为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。
写出B极发生的电极反应式: 。
19.(12分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000 mL溶液。除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有__ _。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_________式滴定管。
②滴定时眼睛应 。
③有关数据记录如下:
测定序号 待测溶液的体积/mL 所耗盐酸标准液的体积/mL
滴定前 滴定后
1 20.00 0.50 20.78
2 20.00 1.20 21.32
(3)计算:烧碱样品的纯度是_________________。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
20.(15分)一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:
3A(g)+B (g)xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为_________,x=_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是_________;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件_________(可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入______molA气体和_______molB气体。
21.(12分)
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为_______ mol·L-1 。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是_________(填序号)。
① 0.2 mol·L-1的CuSO4溶液 ② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl ④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是___(填序号)。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A ==== H+ + HA- , HA- H+ + A2- 。
①则Na2A溶液显________(填“酸性”“中性”或“碱性”);NaHA溶液显________(填“酸性”“中性”或“碱性”)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+)
C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-)
D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-)
参考答案
1 2 3 4 5 6 7 8 9 10
A B D C C B C D A D
11 12 13 14 15
AD D BC AD C
16.(12分)
(1)k=c2(SO3)/c(O2)·c2(SO2) SO2+NaOH=NaHSO3
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+Fe2+=2Cl-+Fe3+ Cl2 HCl
【分析】本题让元素化合物知识与生产工艺、化学平衡原理结合起来,引导中学化学教学关注化学学科的应用性和实践性。本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,考查学生对新信息的处理能力。
【备考提示】我们元素化合物知识教学要与基本实验实验、化工生产工艺、日常生活等结合起来,做到学以致用,而不是简单的来回重复和死记硬背。
17.(15分)
(1)A被空气中的O2氧化
(2)羟基 醚键
【分析】本题是一道基础有机合成题,仅将敌草胺的合成过程列出,着力考查阅读有机合成方案、利用题设信息、解决实际问题的能力,也考查了学生对信息接受和处理的敏锐程度、思维的整体性和对有机合成的综合分析能力。本题涉及到有机物性质、有机官能团、同分异构体推理和书写,合成路线流程图设计与表达,重点考查课学生思维的敏捷性和灵活性,对学生的信息获取和加工能力提出较高要求。
【备考提示】解答有机推断题时,我们应首先要认真审题,分析题意,从中分离出已知条件和推断内容,弄清被推断物和其他有机物的关系,以特征点作为解题突破口,结合信息和相关知识进行推理,排除干扰,作出正确推断。一般可采取的方法有:顺推法(以有机物结构、性质和实验现象为主线,采用正向思维,得出正确结论)、逆推法(以有机物结构、性质和实验现象为主线,采用逆向思维,得出正确结论)、多法结合推断(综合应用顺推法和逆推法)等。关注官能团种类的改变,搞清反应机理。
同课章节目录
