人教版高中化学必修一第一章第一节化学实验基本办法 课件(47张ppt)
文档属性
| 名称 | 人教版高中化学必修一第一章第一节化学实验基本办法 课件(47张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-10 07:13:40 | ||
图片预览










文档简介
(共47张PPT)
第一节
化学实验的基本方法
----------蒸馏与萃取
为什么自来水会有漂白粉味?
在水处理的过程中,为保证饮用水的卫生,水厂对出厂水必须投加一定量的消毒剂氯。因此,自来水中有漂白粉味主要是由于自来水中余氯偏高,出现类似漂白粉味的氯味。
处理办法:这种情况是水厂正常生产投加消毒剂所致,自来水在煮沸后氯味将自然消失,用户可放心使用;若用户要把自来水作特殊用途(如养金鱼),可以将自来水放置一段时间,氯会自然挥发消失。
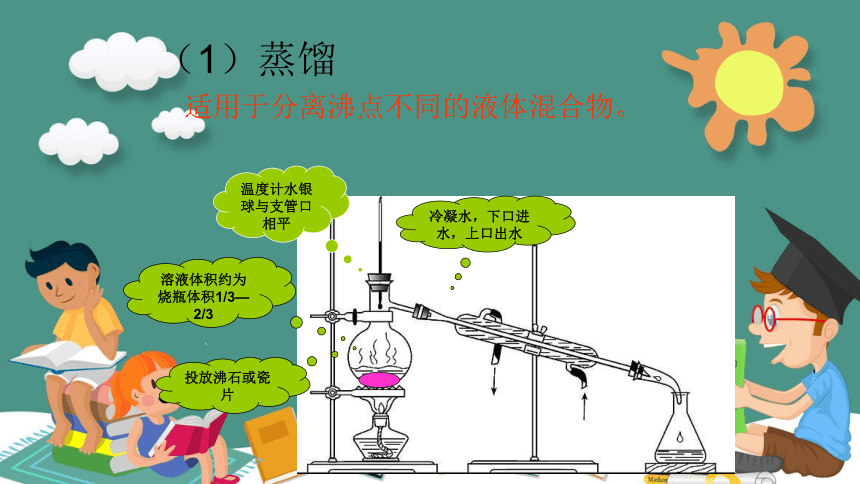
蒸馏烧瓶
冷凝管
牛角管或接液管
温度计
投放沸石或瓷片
温度计水银球与支管口相平
冷凝水,下口进水,上口出水
溶液体积约为烧瓶体积1/3—2/3
(1)蒸馏
适用于分离沸点不同的液体混合物。
实验1-3
实
验
现
象
1.在试管中加入少量自来水和几滴稀HNO3和AgNO3
2.取少量蒸馏水加入几滴HNO3
和AgNO3
有白色难溶物
无现象
利用蒸馏的方法,从酒精的水溶液中提纯分离出酒精,蒸馏出来的是哪种物质?
思考:
蒸馏在日常生活中的应用
酒精的提纯
石油的分馏
海水的淡化
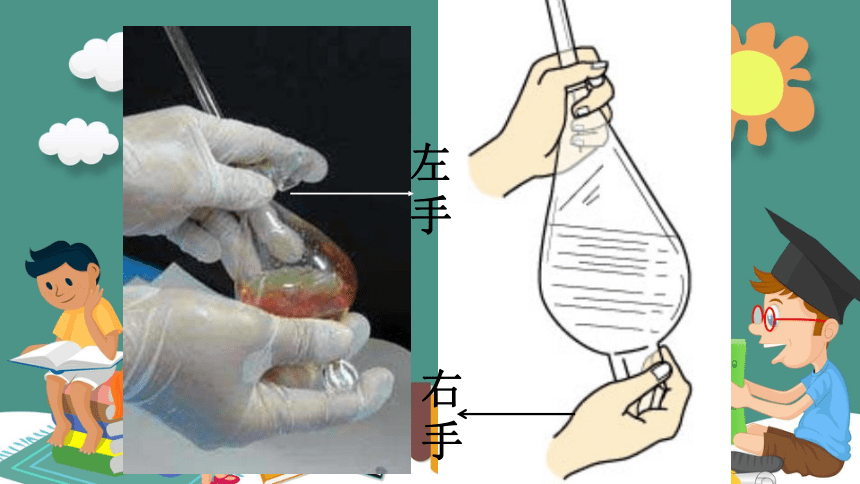
怎么样从水和油的混合物中把水和油分离出来?
使用分液漏斗注意事项
漏斗下端口要靠在烧杯内壁
(3)当下层液体恰好流完时,迅速关上活塞,从漏斗口倒出上层液体
(2)旋开活塞,使下层液体慢慢沿烧杯壁流下
(1)先把玻璃塞取下,以便与大气相通,有利于液体的流下
2、分液漏斗所装液体量不能超过其容量的2/3
3、分液时
1、使用前检查是否漏水
(2)分液:
分离互不相溶的液体混合物
(3)
萃取:
原理:利用物质在互不相溶的两种溶剂中的溶解性不同,可以使该物质从溶解度小的溶剂转移到溶解度较大的溶剂中的方法。
A和C组成溶液,加一种溶剂B,A易溶于B,A难溶于C,所以B可以把A在A和C组成的溶液中萃取出来,其中B称作萃取剂。
左手
右手
萃取实验步骤:混液---振荡---静置---分液
主要仪器:分液漏斗
P9
实验1-4
注意事项:
(1)每次振荡后,须不断放气,以减少分液漏斗内的气压。(不能对准人)
(2)萃取原则:少量多次。
分析讨论
1、上层液体中的溶剂是(
),下层液体
中溶剂是(
)
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、
苯与H2O比较有何异同?
H2O
苯
都能溶解碘单质(
I2);都不与
碘单质(
I2)反应。
异:
苯与H2O互不相溶;碘单质在苯中的溶解度大。
同:
苯
作为萃取剂的条件
1、萃取剂与原溶剂互不相溶;
2、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度;
3、与溶质、溶剂均不反应;
4、萃取剂与原溶剂密度不同。
将实验1-4中的萃取剂换为酒精是否可以?请说明原因
不可以,酒精与水互溶
碘的萃取剂:汽油、煤油、苯、四氯化碳等
小结
1、混合物分离与提纯的方法
方法
适用范围
装置
举例
过滤
蒸发
从液体中分离出不溶的固体物质
分离溶剂和溶质
蒸发食盐溶液获得食盐晶体
除去氯化钠溶液中的泥沙
方法
适用范围
装置
举例
蒸馏
萃取
四氯化碳(苯)把溶于水里的碘萃取出来
分离酒精和水的混合物;用自来水制取蒸馏水
分离沸点不同而又相溶的液态混合物(分离固液混合物)
利用溶质在两种互不相溶的溶剂里溶解度的不同
2、物质的检验
1、SO42-的检验(实验1-2)
2、Cl-的检验(实验1-4)
稀盐酸+BaCl2(酸化)
BaSO4↓
稀硝酸+AgNO3
AgCl↓
可以检验硫酸及可溶性硫酸盐
1、不可溶性的固体和液体分离
——
2、可溶性的固体和液体分离——
3、沸点不同的液体混合物分离——
4、溶解度不同的可溶性混合物分离——
5、互不相溶的液体混合物分离——
过滤
蒸发
蒸馏
萃取
分液
现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。
实
例
分离方法
选择的依据
除去澄清石灰水中的碳酸钙
蒸馏
溶解度随温度变化的差异
用CCl4提取溴水中溴单质
过滤
在不同溶剂中溶解度的差异
分离醋酸(沸点118℃)与乙醇(沸点78.5℃)
分液
沸点的差异较大
分离汽油和水
结晶
两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中提取硝酸钾
萃取
物质在水中溶解度的不同
1、曹冲解决问题的方法?
3、你能否称出一个原子的质量?
由曹冲称象想到的…
2、怎样测出一张纸的厚度?
质量(宏观):
粒子数(微观):
12g
32g
44g
1个
1个
1个
C
+
O2
CO2
点燃
往事回顾
宏观物质的质量与微量粒子的数目之间有什么联系呢?
?
物质的量
【Amount
of
substance】
宏观
微观
物质
质量
粒子数目
国际单位制(SI)
物理量
单位名称
单位符号
长度(L)
米
m
质量(m)
千克
kg
时间(t)
秒
s
电流(I)
安培
A
热力学温度
开尔文
K
物质的量(n)
摩尔
mol
发光强度
坎德拉
cd
资料卡片
1、物质的量:
一.物质的量及其单位——摩尔
定义:
表示一定数目粒子的集合体的物理量。
1
2
符号:
单位:
3
注意:
“物质的量”为专业术语,字数不可增减,不能简单的理解为“物质的质量”或“物质的数量”。
n
摩尔(mol)
下列说法不正确的是(
)
A.摩尔是国际单位制的7个基本物理量之一
B.物质的量是表示含有一定数目的粒子集合体的物
理量
C.物质的量的单位是“摩尔”
D.物质的量是表示物质的数量的单位
A、D
牛刀小试
一打铅笔有12支
一箱牛奶有24瓶
一盒别针有100个
生活小常识
1971年,在第十四届国际计量大会上规定:将0.012kg12C中所含有的碳原子数定为1摩尔(1mol)。
1
摩尔(mol)的标准
已知一个12C原子的质量为1.993×10-26
千克,那么0.012
kg12C中有多少个碳原子?
——
0.012kg
1.993×10-26kg
≈
6.02
×1023
解析:
百度一下
1811年,他发现了阿伏加德罗定律
此后,又发现了阿伏加德罗常数
阿伏加德罗是第一个认识到物质由分子组成、分子由原子组成的人。他的分子假说奠定了原子一分子论的基础,推动了物理学、化学的发展,对近代科学产生了深远的影响。
国际计量大会规定:将0.012kg12C中所含有的碳原子数称为阿伏加德罗常数【Avogadro‘s
constant
】
符号表示为:NA
,单位:mol-1,
其数值约为6.02
×1023
如果把6.02×1023个硬币排成一行,可以来回于地球与太阳之间多少次?
如果有
6.02×1023
粒米让全球60亿人吃,每人每天吃10斤,可吃多少时间?
感受一下
240亿次
1万4千年!
如此巨大的数据!
判断正误,说明理由。
A.1
molCO2
B.1
mol小麦
C.摩尔是7个基本物理量之一
D.1
mol氢
×
小麦不是微观粒子
×没有指出是具体的哪种微观粒子!
√
×
摩尔不是物理量
从以上可以看出,阿伏加德罗常数是一个很庞大的数字,因此物质的量的描述对象只能应用于微观粒子,不适用于宏观物质。
感悟一下
2、1mol的标准与阿伏加德罗常数
1mol的标准:
0.012
kg12C中所含的碳原
子数目,数目约为6.02×1023个。
1
2
3
阿伏加德罗常数:
单位mol-1,符号:NA,约为6.02×1023
mol-1
1
mol物质(微粒):
含NA个粒子的任何物质或微粒的集合体。
小结
1mol
H2O
中含有的水分子数约为多少?
2mol
CO2
中含有的CO2的分子数约为多少?
6.02
×1023
6.02
×1023
×2
=
1.204
×1024
信手拈来
3、粒子个数(N)、阿伏加德罗常数(NA)、物质的量(n)三者的关系
n
=
N
NA
N
=
n
NA
·
n
(H)
=
=
=1.5mol
9.03×1023
6.02×1023mol-1
解析:
N(H)
NA
N(O2)=n(O2)
×NA=5mol×6.02×1023mol-1=3.01×1024
解析:
课堂演练
(2)9.03×1023个H原子,其物质的量是多少?
(1)5molO2中大约有多少个氧分子?
1mol物质
所含粒子数
一个粒子的质量(g)
1mol
粒子的质量(g)
粒子的相对原子(分子)质量
1mol
C
1.993×10-23
1mol
Al
4.485×10-23
1mol
H2O
2.990×10-23
1mol
Fe3+
9.278×10-23
6.02×1023
6.02×1023
6.02×1023
6.02×1023
12
27
18
56
问题探究
完成填空,从中你能得出什么结论?
12
27
18
56
发现规律
1mol任何粒子或物质的质量(以克为单位
时),其数值与这种粒子的相对原子(分子)质量相等。
⑴1molCu质量是
⑵1molO2质量是______
⑶1molNa+质量是
⑷1molNaCl质量是_______
64g
32g
23g
58.5g
结论:
课堂练习:
1molO2质量是32克
2molO2质量是
克
a
molO2质量是
克
探究:物质的质量与物质的量之间有什么关系?
0.5molO2质量是
克
某物质的质量与其物质的量的比值不变!
单位物质的量的物质所具有的质量。
符号:M
单位:
g/mol
m
——
n
M
=
表达式:
某物质的摩尔质量在以g/mol为单位时,与1mol物质的质量以克为单位时在数值上相等,也与该物质的相对原子(分子)质量的数值相等。
如:M(H)
=
1g/mol
M(O2)
=
32g/mol
M(CO2)
=
________
M(NaCl)
=
_________
4、摩尔质量(Molar
mass
)
44g/mol
58.5g/mol
下列说法正确的是
(
)
A.O的摩尔质量是32
g?mol-1
B.硫酸的摩尔质量是98g
C.CO2的相对分子质量是44g
D.H2O摩尔质量是18g/mol
D
n
=
m
M
——
m
——
n
M
=
例
:
24.5克H2SO4的物质的量是多少?
解:H2SO4的相对分子质量为98,故其摩尔质量为98
g·mol-1。
n(H2SO4)
=
=0.25
mol
答:24.5g的H2SO4的物质的量是0.25mol
知识迁移
1、0.5molNaOH的质量是多少?
2、若水(H2O)的质量是36g,你能算出水分子的个数吗?
【小试身手】
宏观物质的质量与微观粒子数目的关系
m
N
NA
—
=
—
M
n
=
归纳小结:
物质的量是把微观粒子和宏观物质联系起来的一座桥梁。
(难见、难称量)
微观粒子
宏观物质
(可见、可称量)
物质的量
÷
NA
×NA
×M
÷
M
微粒数
(N)
物质的量(n)
物质的质量(m)
意义:
若amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
(
)
A.a/(4b)
mol-1
B.b/a
mol-1
C.a/b
mol-1
D.b/(4a)
mol-1
D
试试吧
第一节
化学实验的基本方法
----------蒸馏与萃取
为什么自来水会有漂白粉味?
在水处理的过程中,为保证饮用水的卫生,水厂对出厂水必须投加一定量的消毒剂氯。因此,自来水中有漂白粉味主要是由于自来水中余氯偏高,出现类似漂白粉味的氯味。
处理办法:这种情况是水厂正常生产投加消毒剂所致,自来水在煮沸后氯味将自然消失,用户可放心使用;若用户要把自来水作特殊用途(如养金鱼),可以将自来水放置一段时间,氯会自然挥发消失。
蒸馏烧瓶
冷凝管
牛角管或接液管
温度计
投放沸石或瓷片
温度计水银球与支管口相平
冷凝水,下口进水,上口出水
溶液体积约为烧瓶体积1/3—2/3
(1)蒸馏
适用于分离沸点不同的液体混合物。
实验1-3
实
验
现
象
1.在试管中加入少量自来水和几滴稀HNO3和AgNO3
2.取少量蒸馏水加入几滴HNO3
和AgNO3
有白色难溶物
无现象
利用蒸馏的方法,从酒精的水溶液中提纯分离出酒精,蒸馏出来的是哪种物质?
思考:
蒸馏在日常生活中的应用
酒精的提纯
石油的分馏
海水的淡化
怎么样从水和油的混合物中把水和油分离出来?
使用分液漏斗注意事项
漏斗下端口要靠在烧杯内壁
(3)当下层液体恰好流完时,迅速关上活塞,从漏斗口倒出上层液体
(2)旋开活塞,使下层液体慢慢沿烧杯壁流下
(1)先把玻璃塞取下,以便与大气相通,有利于液体的流下
2、分液漏斗所装液体量不能超过其容量的2/3
3、分液时
1、使用前检查是否漏水
(2)分液:
分离互不相溶的液体混合物
(3)
萃取:
原理:利用物质在互不相溶的两种溶剂中的溶解性不同,可以使该物质从溶解度小的溶剂转移到溶解度较大的溶剂中的方法。
A和C组成溶液,加一种溶剂B,A易溶于B,A难溶于C,所以B可以把A在A和C组成的溶液中萃取出来,其中B称作萃取剂。
左手
右手
萃取实验步骤:混液---振荡---静置---分液
主要仪器:分液漏斗
P9
实验1-4
注意事项:
(1)每次振荡后,须不断放气,以减少分液漏斗内的气压。(不能对准人)
(2)萃取原则:少量多次。
分析讨论
1、上层液体中的溶剂是(
),下层液体
中溶剂是(
)
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、
苯与H2O比较有何异同?
H2O
苯
都能溶解碘单质(
I2);都不与
碘单质(
I2)反应。
异:
苯与H2O互不相溶;碘单质在苯中的溶解度大。
同:
苯
作为萃取剂的条件
1、萃取剂与原溶剂互不相溶;
2、溶质在萃取剂中的溶解度远远大于在原溶剂中的溶解度;
3、与溶质、溶剂均不反应;
4、萃取剂与原溶剂密度不同。
将实验1-4中的萃取剂换为酒精是否可以?请说明原因
不可以,酒精与水互溶
碘的萃取剂:汽油、煤油、苯、四氯化碳等
小结
1、混合物分离与提纯的方法
方法
适用范围
装置
举例
过滤
蒸发
从液体中分离出不溶的固体物质
分离溶剂和溶质
蒸发食盐溶液获得食盐晶体
除去氯化钠溶液中的泥沙
方法
适用范围
装置
举例
蒸馏
萃取
四氯化碳(苯)把溶于水里的碘萃取出来
分离酒精和水的混合物;用自来水制取蒸馏水
分离沸点不同而又相溶的液态混合物(分离固液混合物)
利用溶质在两种互不相溶的溶剂里溶解度的不同
2、物质的检验
1、SO42-的检验(实验1-2)
2、Cl-的检验(实验1-4)
稀盐酸+BaCl2(酸化)
BaSO4↓
稀硝酸+AgNO3
AgCl↓
可以检验硫酸及可溶性硫酸盐
1、不可溶性的固体和液体分离
——
2、可溶性的固体和液体分离——
3、沸点不同的液体混合物分离——
4、溶解度不同的可溶性混合物分离——
5、互不相溶的液体混合物分离——
过滤
蒸发
蒸馏
萃取
分液
现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。
实
例
分离方法
选择的依据
除去澄清石灰水中的碳酸钙
蒸馏
溶解度随温度变化的差异
用CCl4提取溴水中溴单质
过滤
在不同溶剂中溶解度的差异
分离醋酸(沸点118℃)与乙醇(沸点78.5℃)
分液
沸点的差异较大
分离汽油和水
结晶
两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中提取硝酸钾
萃取
物质在水中溶解度的不同
1、曹冲解决问题的方法?
3、你能否称出一个原子的质量?
由曹冲称象想到的…
2、怎样测出一张纸的厚度?
质量(宏观):
粒子数(微观):
12g
32g
44g
1个
1个
1个
C
+
O2
CO2
点燃
往事回顾
宏观物质的质量与微量粒子的数目之间有什么联系呢?
?
物质的量
【Amount
of
substance】
宏观
微观
物质
质量
粒子数目
国际单位制(SI)
物理量
单位名称
单位符号
长度(L)
米
m
质量(m)
千克
kg
时间(t)
秒
s
电流(I)
安培
A
热力学温度
开尔文
K
物质的量(n)
摩尔
mol
发光强度
坎德拉
cd
资料卡片
1、物质的量:
一.物质的量及其单位——摩尔
定义:
表示一定数目粒子的集合体的物理量。
1
2
符号:
单位:
3
注意:
“物质的量”为专业术语,字数不可增减,不能简单的理解为“物质的质量”或“物质的数量”。
n
摩尔(mol)
下列说法不正确的是(
)
A.摩尔是国际单位制的7个基本物理量之一
B.物质的量是表示含有一定数目的粒子集合体的物
理量
C.物质的量的单位是“摩尔”
D.物质的量是表示物质的数量的单位
A、D
牛刀小试
一打铅笔有12支
一箱牛奶有24瓶
一盒别针有100个
生活小常识
1971年,在第十四届国际计量大会上规定:将0.012kg12C中所含有的碳原子数定为1摩尔(1mol)。
1
摩尔(mol)的标准
已知一个12C原子的质量为1.993×10-26
千克,那么0.012
kg12C中有多少个碳原子?
——
0.012kg
1.993×10-26kg
≈
6.02
×1023
解析:
百度一下
1811年,他发现了阿伏加德罗定律
此后,又发现了阿伏加德罗常数
阿伏加德罗是第一个认识到物质由分子组成、分子由原子组成的人。他的分子假说奠定了原子一分子论的基础,推动了物理学、化学的发展,对近代科学产生了深远的影响。
国际计量大会规定:将0.012kg12C中所含有的碳原子数称为阿伏加德罗常数【Avogadro‘s
constant
】
符号表示为:NA
,单位:mol-1,
其数值约为6.02
×1023
如果把6.02×1023个硬币排成一行,可以来回于地球与太阳之间多少次?
如果有
6.02×1023
粒米让全球60亿人吃,每人每天吃10斤,可吃多少时间?
感受一下
240亿次
1万4千年!
如此巨大的数据!
判断正误,说明理由。
A.1
molCO2
B.1
mol小麦
C.摩尔是7个基本物理量之一
D.1
mol氢
×
小麦不是微观粒子
×没有指出是具体的哪种微观粒子!
√
×
摩尔不是物理量
从以上可以看出,阿伏加德罗常数是一个很庞大的数字,因此物质的量的描述对象只能应用于微观粒子,不适用于宏观物质。
感悟一下
2、1mol的标准与阿伏加德罗常数
1mol的标准:
0.012
kg12C中所含的碳原
子数目,数目约为6.02×1023个。
1
2
3
阿伏加德罗常数:
单位mol-1,符号:NA,约为6.02×1023
mol-1
1
mol物质(微粒):
含NA个粒子的任何物质或微粒的集合体。
小结
1mol
H2O
中含有的水分子数约为多少?
2mol
CO2
中含有的CO2的分子数约为多少?
6.02
×1023
6.02
×1023
×2
=
1.204
×1024
信手拈来
3、粒子个数(N)、阿伏加德罗常数(NA)、物质的量(n)三者的关系
n
=
N
NA
N
=
n
NA
·
n
(H)
=
=
=1.5mol
9.03×1023
6.02×1023mol-1
解析:
N(H)
NA
N(O2)=n(O2)
×NA=5mol×6.02×1023mol-1=3.01×1024
解析:
课堂演练
(2)9.03×1023个H原子,其物质的量是多少?
(1)5molO2中大约有多少个氧分子?
1mol物质
所含粒子数
一个粒子的质量(g)
1mol
粒子的质量(g)
粒子的相对原子(分子)质量
1mol
C
1.993×10-23
1mol
Al
4.485×10-23
1mol
H2O
2.990×10-23
1mol
Fe3+
9.278×10-23
6.02×1023
6.02×1023
6.02×1023
6.02×1023
12
27
18
56
问题探究
完成填空,从中你能得出什么结论?
12
27
18
56
发现规律
1mol任何粒子或物质的质量(以克为单位
时),其数值与这种粒子的相对原子(分子)质量相等。
⑴1molCu质量是
⑵1molO2质量是______
⑶1molNa+质量是
⑷1molNaCl质量是_______
64g
32g
23g
58.5g
结论:
课堂练习:
1molO2质量是32克
2molO2质量是
克
a
molO2质量是
克
探究:物质的质量与物质的量之间有什么关系?
0.5molO2质量是
克
某物质的质量与其物质的量的比值不变!
单位物质的量的物质所具有的质量。
符号:M
单位:
g/mol
m
——
n
M
=
表达式:
某物质的摩尔质量在以g/mol为单位时,与1mol物质的质量以克为单位时在数值上相等,也与该物质的相对原子(分子)质量的数值相等。
如:M(H)
=
1g/mol
M(O2)
=
32g/mol
M(CO2)
=
________
M(NaCl)
=
_________
4、摩尔质量(Molar
mass
)
44g/mol
58.5g/mol
下列说法正确的是
(
)
A.O的摩尔质量是32
g?mol-1
B.硫酸的摩尔质量是98g
C.CO2的相对分子质量是44g
D.H2O摩尔质量是18g/mol
D
n
=
m
M
——
m
——
n
M
=
例
:
24.5克H2SO4的物质的量是多少?
解:H2SO4的相对分子质量为98,故其摩尔质量为98
g·mol-1。
n(H2SO4)
=
=0.25
mol
答:24.5g的H2SO4的物质的量是0.25mol
知识迁移
1、0.5molNaOH的质量是多少?
2、若水(H2O)的质量是36g,你能算出水分子的个数吗?
【小试身手】
宏观物质的质量与微观粒子数目的关系
m
N
NA
—
=
—
M
n
=
归纳小结:
物质的量是把微观粒子和宏观物质联系起来的一座桥梁。
(难见、难称量)
微观粒子
宏观物质
(可见、可称量)
物质的量
÷
NA
×NA
×M
÷
M
微粒数
(N)
物质的量(n)
物质的质量(m)
意义:
若amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
(
)
A.a/(4b)
mol-1
B.b/a
mol-1
C.a/b
mol-1
D.b/(4a)
mol-1
D
试试吧
