2020-2021学年高一化学人教版(2019)必修第一册第二章第一节第一课时钠的化学性质 课件(24张ppt)
文档属性
| 名称 | 2020-2021学年高一化学人教版(2019)必修第一册第二章第一节第一课时钠的化学性质 课件(24张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 28.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-10 08:44:49 | ||
图片预览








文档简介
(共24张PPT)
第一节
钠及其化合物
第一课时
依据上一章所学请思考:物质通常都有哪样一些性质需要我们去加以掌握?如何去掌握?
既然任何一种物质的化学性质都是按照类别和价态来进行建构
那么下面我们就以此为指导来探究具体的物质,看一看它们都有哪样的一些性质?
首先我们来认识在自然界中普遍存在的元素——钠元素,看一看钠元素所形成的物质都有哪些性质?
请问:钠元素都可形成哪些类别的物质?
钠元素可形成的物质:
单质—氧化物—碱—盐
下面我们首先来研究钠单质
请问:钠有何性质呢?
广州日报—炸起千层浪,珠江钠“水雷”谜团待解
2018年7月,在广州珠江河段曾经发生过惊险神秘的“水雷”,6个装满金属钠的铁皮水桶浮在水面上,其中3个发生剧烈爆炸,另3个被成功打捞。据现场的同志讲,早上10点多,河内突然冒起一股白烟,在水面上漂浮的一个铁桶内窜出黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。据悉,其中另有一铁桶被过往船只发现,并将其打捞,准备清洗后使用,但当船员把盖子打开后桶内冒起浓浓白烟,而且,一接触桶内的物质,双手感到剧烈的疼痛,于是他们又将桶推到水里,一遇到水就炸了。所幸该船只迅速逃离,伤亡不大。
【谜团】
1、为什么装满金属钠的铁桶不下沉?
2、为什么打捞上来的桶打开盖子后,马上冒出白烟,而且一旦人们接触了桶内的物质,双手感到剧烈的疼痛?
3、为什么一遇到水,铁桶就会着火爆炸?
4、消防队员将打捞上来的铁桶如何处理?
要弄清上述问题,就得弄清钠是一种什么样的物质?有何化学性质?
钠单质到底是一种什么样的物质呢?
一:钠的物理性质
实验探究:
颜色:
银白色
金属光泽的固体
状态:
硬度:
质软,可用小刀切割
☆钠的取用→镊子(不能用手接触)
切割金属钠要注意实验安全!
☆煤油要用滤纸擦干
☆切割在滤纸或玻璃片上进行
密度:
小于水,大于煤油
想一想钠还有什么物性?
钠单质有何化学性质呢?
预测:请同学们根据钠单质的类别预测钠单质的化学性质?
既然钠这种物质属于金属单质,那么金属单质通常应具有怎样的化学性质呢?
探究:请同学们结合铁单质的化学性质归纳总结金属单质应具有怎样的通性?
立足于以上探究并结合金属活动顺序表思考:钠单质是否也具有这些性质呢?
下面我们结合实验来进行探究
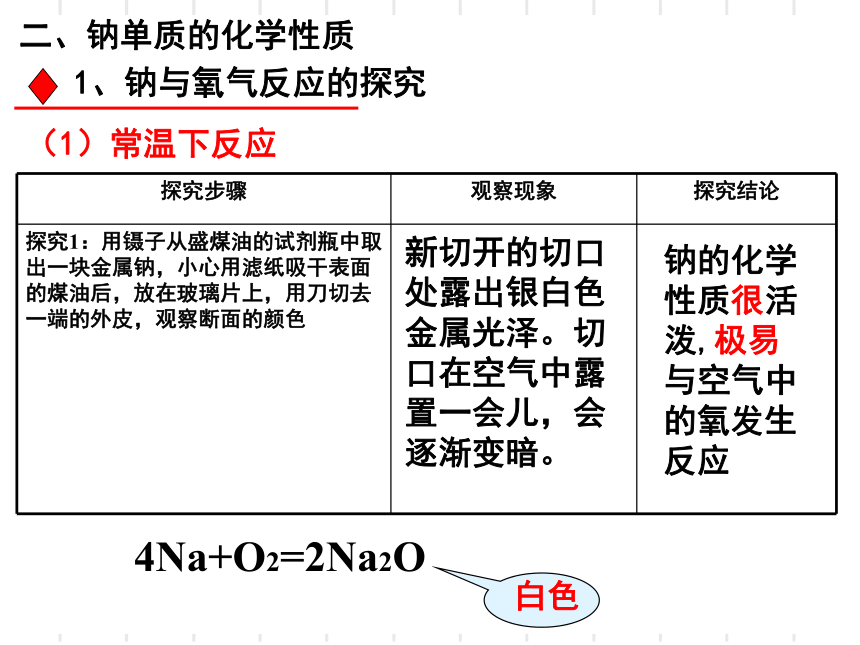
二、钠单质的化学性质
1、钠与氧气反应的探究
(1)常温下反应
探究步骤
观察现象
探究结论
探究1:用镊子从盛煤油的试剂瓶中取出一块金属钠,小心用滤纸吸干表面的煤油后,放在玻璃片上,用刀切去一端的外皮,观察断面的颜色
新切开的切口处露出银白色金属光泽。切口在空气中露置一会儿,会逐渐变暗。
钠的化学性质很活泼,极易与空气中的氧发生反应
4Na+O2=2Na2O
白色
探究步骤
观察现象
探究结论
探究2:
取一小块金属钠(吸干表面的的煤油)放在坩埚里,加热。
☆熔化成闪亮的小球
☆剧烈燃烧,燃烧时火焰呈黄色
☆最后生成淡黄色固体
钠的熔点较低,钠与O2反应,条件不同,现象不同,产物不同
(2)加热后反应
特殊的氧化物——过氧化钠(Na2O2),淡黄色固体
+1
-1
2Na+O2
Na2O2
点燃
是不是加热后生成的也是氧化钠呢?
氧化钠与过氧化钠的比较
氧化钠
过氧化钠
化
学
式
氧的化合价
颜
色
生
成
条
件
Na2O
Na2O2
-2
-1
白色
淡黄色
常温
点燃或加热
两种氧化物,哪一个更稳定呢?
除此之外,钠单质能否与其它的非金属单质反应呢?为什么?
钠单质还能和很多其他非金属反应
2Na
+
Cl2
2NaCl
点燃
2Na
+
S
Na2S
△
除此之外,钠还能与哪些物质发生反应呢?
预测:可与酸、盐、水发生反应
2、钠与水的反应的探究
讨论:(1)结合钠与水的组成以及所学的氧化还原反应的知识预测钠与水反应后的生成物都有哪些?
(2)如何对这些产物进行检验?
实验钠与水的反应
概括
现象
性质
2Na+2H2O=2NaOH+H2↑
钠浮在水面上
浮
密度比水小
在水面上四处游动,发出嘶嘶声
游、响
产生气体
立刻熔成一个小球
熔
反应放热,熔点低
红
反应后溶液变红
生成碱性物质
提示:注意观察钠在水中哪个部位反应?形态有何变化?如何运动?有无响声?
分析Na与水反应的化合价的变化,思考钠与水反应的本质?
2Na+2H2O
=2Na+2OH-
+
H2
化合价升高,失去电子,被氧化
化合价降低,得到电子,被还原
0
0
+1
+1
本质:钠失电子,水电离产生的H+得电子
练习:写出钠与水反应的离子方程式
3、钠与酸溶液反应的探究
思考:钠能否与酸反应?
在此基础上请同学们继续思考:该反应的实质是什么?
思考讨论:
(1)、依据钠与水、酸反应的实质都是与H+反应思考:将两块钠投入酸溶液和水中,哪个反应更剧烈?为什么?
(2)、如果将过量的钠投入酸溶液中,会发生哪些反应?
4、钠与盐溶液反应的探究
预测:如果将钠投入盐溶液中,能否发生置换反应?
【实验探究】将一小块金属钠投入CuSO4溶液中,可观察到什么
现象?写出发生的化学方程式。
观察到现象:反应剧烈,钠熔成小球,浮在水面上,迅速游动,嘶嘶作响,溶液中同时出现蓝色沉淀。
立足于以上实验现象请思考:将钠投入盐溶液中,发生的是置换反应吗?
既然不是置换反应请问:反应中的氢氧化铜蓝色沉淀是如何生成的呢?
2Na+2H2O
=
2NaOH+H2↑,
CuSO4+2NaOH
=
Cu(OH)2↓+Na2SO4
钠与氯化铁溶液反应的现象是什么?产物有哪些?写出该反应的化学方程式。
推测:
规律:
钠与盐溶液反应时,先与水反应,生成的NaOH再与盐溶液反应(如果能反应),而不是钠去置换盐溶液里的金属。
思考:如果钠要与盐发生置换,必须遵循什么样的条件呢?
练习:课时跟踪检测134页第14题
至此我们对钠单质的化学性质进行了详细的探讨,结合探讨请思考:钠单质在反应中通常用作什么剂?为什么呢?其原因何在?
由此可见:我们在掌握物质的性质时,一定要树立起一个意识,就是结构决定性质。尤其是在单质性质的学习中,要善于根据构成该单质的原子结构去推测该单质在反应中到底是用作氧化剂还是用作还原剂。
至此我们对钠单质的化学性质进行了详细的探讨,在此基础上请同学们对所学的钠单质与铁单质的化学性质进行比较,找出它们在化学性质上有何相同之处?又有何不同之处?
由此可见:钠单质除了具有一般活泼金属单质所具有的共性外,还具有自身的特性。
在此基础上请同学们结合钠的性质思考:
四、钠单质的保存:保存在盛有煤油或石蜡的试剂瓶中。
1、自然界中可不可能有钠单质呢?为什么?
2、实验室应如何来保存钠的单质?
三、钠元素的存在:
只有化合态,没有游离态。
在此基础上请同学们继续结合钠的性质思考:
当在火灾现场有大量钠存在时,应怎样灭火?能用水灭火?
干燥的沙土灭火
至此我们对与钠单质有关的知识进行了详细的学习,那么立足于所学请思考:
通常我们应如何来建构一种物质的有关知识呢?其方法是什么?
建构物质的方法:
结构、类别→性质→元素在自然界中的存在、物质的保存、用途。
【谜团】的解释:
1、为什么装满金属钠的铁桶不下沉?
2、为什么打捞上来的桶打开盖子后,马上冒出白烟,而且一旦人们接触了桶内的物质,双手感到剧烈的疼痛?
3、为什么一遇到水,铁桶就会着火爆炸?
4、消防队员将打捞上来的铁桶如何处理?
巩固基础:学案31页第1题
拓展迁移:学案31页第3题、学案32页第3题、第4题
练习4:若m
g
Na在足量氯气中燃烧,生成固体的质量为(m+3.55
g),则m
g
Na与氧气反应,生成固体的质量为( )
①(m+0.8
g) ②(m+1.0
g) ③(m+1.2
g)
④(m+1.6
g) ⑤(m+1.4
g)
A.①④
B.①⑤
C.③④
D.①②③④⑤
D
能力提高:课时跟踪检测133页第7题、第10题
研究物质化学性质的一般步骤、方法
课堂小结
实验验证
预测性质
归纳总结
选择
代表物
设计
方案
Na
反应条件
反应装置
依据
物质的类别、
氧化还原理论
第一节
钠及其化合物
第一课时
依据上一章所学请思考:物质通常都有哪样一些性质需要我们去加以掌握?如何去掌握?
既然任何一种物质的化学性质都是按照类别和价态来进行建构
那么下面我们就以此为指导来探究具体的物质,看一看它们都有哪样的一些性质?
首先我们来认识在自然界中普遍存在的元素——钠元素,看一看钠元素所形成的物质都有哪些性质?
请问:钠元素都可形成哪些类别的物质?
钠元素可形成的物质:
单质—氧化物—碱—盐
下面我们首先来研究钠单质
请问:钠有何性质呢?
广州日报—炸起千层浪,珠江钠“水雷”谜团待解
2018年7月,在广州珠江河段曾经发生过惊险神秘的“水雷”,6个装满金属钠的铁皮水桶浮在水面上,其中3个发生剧烈爆炸,另3个被成功打捞。据现场的同志讲,早上10点多,河内突然冒起一股白烟,在水面上漂浮的一个铁桶内窜出黄色火苗,紧接着一声巨响,蘑菇状的水柱冲天而起。据悉,其中另有一铁桶被过往船只发现,并将其打捞,准备清洗后使用,但当船员把盖子打开后桶内冒起浓浓白烟,而且,一接触桶内的物质,双手感到剧烈的疼痛,于是他们又将桶推到水里,一遇到水就炸了。所幸该船只迅速逃离,伤亡不大。
【谜团】
1、为什么装满金属钠的铁桶不下沉?
2、为什么打捞上来的桶打开盖子后,马上冒出白烟,而且一旦人们接触了桶内的物质,双手感到剧烈的疼痛?
3、为什么一遇到水,铁桶就会着火爆炸?
4、消防队员将打捞上来的铁桶如何处理?
要弄清上述问题,就得弄清钠是一种什么样的物质?有何化学性质?
钠单质到底是一种什么样的物质呢?
一:钠的物理性质
实验探究:
颜色:
银白色
金属光泽的固体
状态:
硬度:
质软,可用小刀切割
☆钠的取用→镊子(不能用手接触)
切割金属钠要注意实验安全!
☆煤油要用滤纸擦干
☆切割在滤纸或玻璃片上进行
密度:
小于水,大于煤油
想一想钠还有什么物性?
钠单质有何化学性质呢?
预测:请同学们根据钠单质的类别预测钠单质的化学性质?
既然钠这种物质属于金属单质,那么金属单质通常应具有怎样的化学性质呢?
探究:请同学们结合铁单质的化学性质归纳总结金属单质应具有怎样的通性?
立足于以上探究并结合金属活动顺序表思考:钠单质是否也具有这些性质呢?
下面我们结合实验来进行探究
二、钠单质的化学性质
1、钠与氧气反应的探究
(1)常温下反应
探究步骤
观察现象
探究结论
探究1:用镊子从盛煤油的试剂瓶中取出一块金属钠,小心用滤纸吸干表面的煤油后,放在玻璃片上,用刀切去一端的外皮,观察断面的颜色
新切开的切口处露出银白色金属光泽。切口在空气中露置一会儿,会逐渐变暗。
钠的化学性质很活泼,极易与空气中的氧发生反应
4Na+O2=2Na2O
白色
探究步骤
观察现象
探究结论
探究2:
取一小块金属钠(吸干表面的的煤油)放在坩埚里,加热。
☆熔化成闪亮的小球
☆剧烈燃烧,燃烧时火焰呈黄色
☆最后生成淡黄色固体
钠的熔点较低,钠与O2反应,条件不同,现象不同,产物不同
(2)加热后反应
特殊的氧化物——过氧化钠(Na2O2),淡黄色固体
+1
-1
2Na+O2
Na2O2
点燃
是不是加热后生成的也是氧化钠呢?
氧化钠与过氧化钠的比较
氧化钠
过氧化钠
化
学
式
氧的化合价
颜
色
生
成
条
件
Na2O
Na2O2
-2
-1
白色
淡黄色
常温
点燃或加热
两种氧化物,哪一个更稳定呢?
除此之外,钠单质能否与其它的非金属单质反应呢?为什么?
钠单质还能和很多其他非金属反应
2Na
+
Cl2
2NaCl
点燃
2Na
+
S
Na2S
△
除此之外,钠还能与哪些物质发生反应呢?
预测:可与酸、盐、水发生反应
2、钠与水的反应的探究
讨论:(1)结合钠与水的组成以及所学的氧化还原反应的知识预测钠与水反应后的生成物都有哪些?
(2)如何对这些产物进行检验?
实验钠与水的反应
概括
现象
性质
2Na+2H2O=2NaOH+H2↑
钠浮在水面上
浮
密度比水小
在水面上四处游动,发出嘶嘶声
游、响
产生气体
立刻熔成一个小球
熔
反应放热,熔点低
红
反应后溶液变红
生成碱性物质
提示:注意观察钠在水中哪个部位反应?形态有何变化?如何运动?有无响声?
分析Na与水反应的化合价的变化,思考钠与水反应的本质?
2Na+2H2O
=2Na+2OH-
+
H2
化合价升高,失去电子,被氧化
化合价降低,得到电子,被还原
0
0
+1
+1
本质:钠失电子,水电离产生的H+得电子
练习:写出钠与水反应的离子方程式
3、钠与酸溶液反应的探究
思考:钠能否与酸反应?
在此基础上请同学们继续思考:该反应的实质是什么?
思考讨论:
(1)、依据钠与水、酸反应的实质都是与H+反应思考:将两块钠投入酸溶液和水中,哪个反应更剧烈?为什么?
(2)、如果将过量的钠投入酸溶液中,会发生哪些反应?
4、钠与盐溶液反应的探究
预测:如果将钠投入盐溶液中,能否发生置换反应?
【实验探究】将一小块金属钠投入CuSO4溶液中,可观察到什么
现象?写出发生的化学方程式。
观察到现象:反应剧烈,钠熔成小球,浮在水面上,迅速游动,嘶嘶作响,溶液中同时出现蓝色沉淀。
立足于以上实验现象请思考:将钠投入盐溶液中,发生的是置换反应吗?
既然不是置换反应请问:反应中的氢氧化铜蓝色沉淀是如何生成的呢?
2Na+2H2O
=
2NaOH+H2↑,
CuSO4+2NaOH
=
Cu(OH)2↓+Na2SO4
钠与氯化铁溶液反应的现象是什么?产物有哪些?写出该反应的化学方程式。
推测:
规律:
钠与盐溶液反应时,先与水反应,生成的NaOH再与盐溶液反应(如果能反应),而不是钠去置换盐溶液里的金属。
思考:如果钠要与盐发生置换,必须遵循什么样的条件呢?
练习:课时跟踪检测134页第14题
至此我们对钠单质的化学性质进行了详细的探讨,结合探讨请思考:钠单质在反应中通常用作什么剂?为什么呢?其原因何在?
由此可见:我们在掌握物质的性质时,一定要树立起一个意识,就是结构决定性质。尤其是在单质性质的学习中,要善于根据构成该单质的原子结构去推测该单质在反应中到底是用作氧化剂还是用作还原剂。
至此我们对钠单质的化学性质进行了详细的探讨,在此基础上请同学们对所学的钠单质与铁单质的化学性质进行比较,找出它们在化学性质上有何相同之处?又有何不同之处?
由此可见:钠单质除了具有一般活泼金属单质所具有的共性外,还具有自身的特性。
在此基础上请同学们结合钠的性质思考:
四、钠单质的保存:保存在盛有煤油或石蜡的试剂瓶中。
1、自然界中可不可能有钠单质呢?为什么?
2、实验室应如何来保存钠的单质?
三、钠元素的存在:
只有化合态,没有游离态。
在此基础上请同学们继续结合钠的性质思考:
当在火灾现场有大量钠存在时,应怎样灭火?能用水灭火?
干燥的沙土灭火
至此我们对与钠单质有关的知识进行了详细的学习,那么立足于所学请思考:
通常我们应如何来建构一种物质的有关知识呢?其方法是什么?
建构物质的方法:
结构、类别→性质→元素在自然界中的存在、物质的保存、用途。
【谜团】的解释:
1、为什么装满金属钠的铁桶不下沉?
2、为什么打捞上来的桶打开盖子后,马上冒出白烟,而且一旦人们接触了桶内的物质,双手感到剧烈的疼痛?
3、为什么一遇到水,铁桶就会着火爆炸?
4、消防队员将打捞上来的铁桶如何处理?
巩固基础:学案31页第1题
拓展迁移:学案31页第3题、学案32页第3题、第4题
练习4:若m
g
Na在足量氯气中燃烧,生成固体的质量为(m+3.55
g),则m
g
Na与氧气反应,生成固体的质量为( )
①(m+0.8
g) ②(m+1.0
g) ③(m+1.2
g)
④(m+1.6
g) ⑤(m+1.4
g)
A.①④
B.①⑤
C.③④
D.①②③④⑤
D
能力提高:课时跟踪检测133页第7题、第10题
研究物质化学性质的一般步骤、方法
课堂小结
实验验证
预测性质
归纳总结
选择
代表物
设计
方案
Na
反应条件
反应装置
依据
物质的类别、
氧化还原理论
