广东省清远市2020-2021学年高一下学期期中质量检测化学试题 Word版含答案
文档属性
| 名称 | 广东省清远市2020-2021学年高一下学期期中质量检测化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 375.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-10 10:37:52 | ||
图片预览




文档简介
清远市12585700102997002020-2021学年度高一第二学期化学期中考试试题卷
(化学班)
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间60分钟。
2.请将各题答案填写在答题卡上。
3.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24
第Ⅰ卷 (选择题 共50分)
1.(本题3分)下列反应中,调节反应物的用量或浓度不会改变反应产物的是
A.硫粉在空气中燃烧 B.硝酸中加入铜片
C.炭与氧气反应 D.硫酸中加入锌粒
2.(本题3分)能使紫色石蕊溶液先变红后褪色的是
A.false固体 B.新制氯水 C.false D.活性炭
3.(本题3分)下列物质中属于硅酸盐材料的是
①水泥 ②玻璃 ③陶瓷 ④水晶
A.只有①③ B.②④ C.只有②③ D.①②③
4.(本题3分)下列试剂在实验室中的保存方法错误的是
A.金属钠在煤油中密封保存
B.液溴可用少量水液封保存
C.硝酸保存在棕色试剂瓶中
D.氢氧化钠溶液保存在带有玻璃塞的试剂瓶中
5.(本题3分)某些化学键的键能数据如表,若1molH2与1molCl2完全燃烧(H2+Cl2=2HCl),则下列说法正确的是
化学键
Cl-Cl
H-H
H-Cl
键能/kJ·mol?1
243
436
431
A.反应共吸收248kJ热量 B.反应共放出248kJ热量
C.反应共吸收183kJ热量 D.反应共放出183kJ热量
6.(本题3分)氢能是一种极具发展潜力的清洁能源,图中是一种以太阳能为热源,高效无污染的制氢方法
下列说法错误的是
A.该过程实现了太阳能向化学能的转化
B.反应Ⅰ的离子方程式为false
C.与电解水制备氢气相比,此过程更加优越
D.该过程的总反应为false
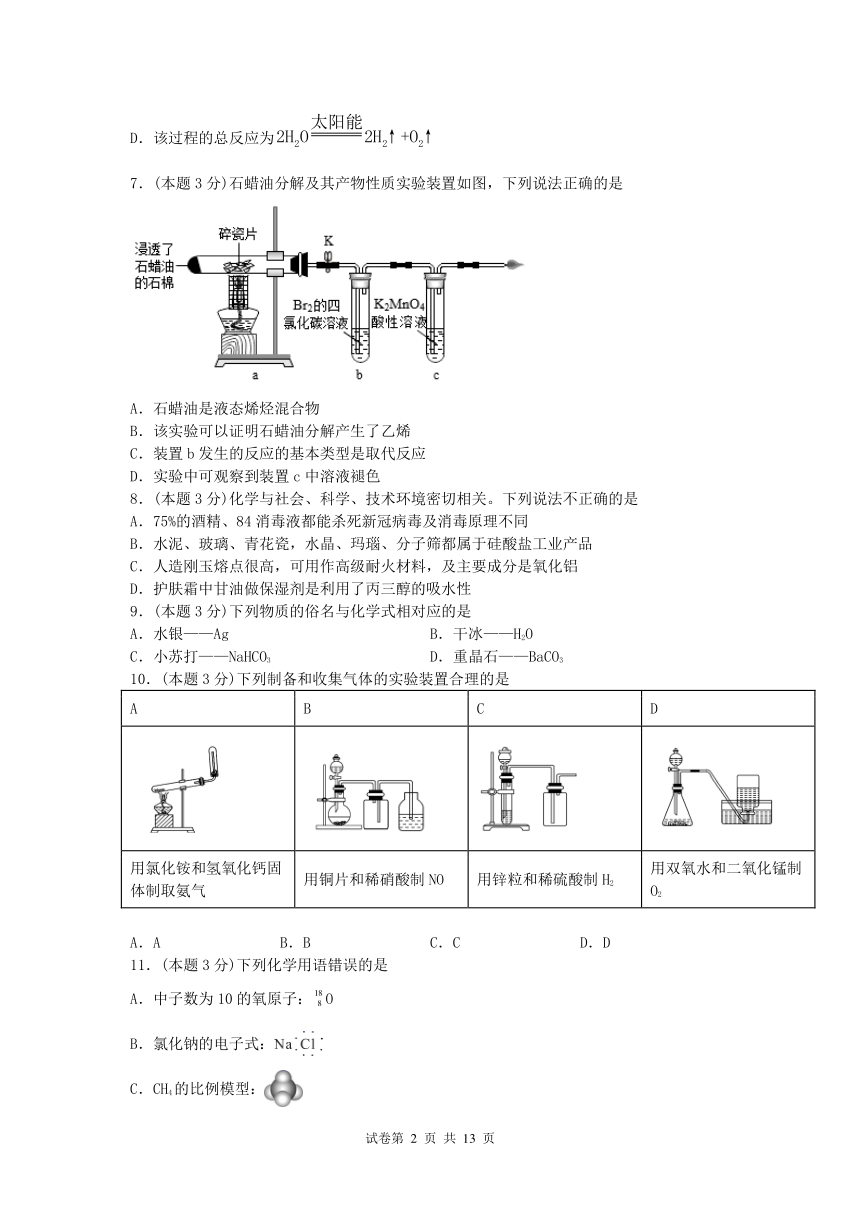
7.(本题3分)石蜡油分解及其产物性质实验装置如图,下列说法正确的是
A.石蜡油是液态烯烃混合物
B.该实验可以证明石蜡油分解产生了乙烯
C.装置b发生的反应的基本类型是取代反应
D.实验中可观察到装置c中溶液褪色
8.(本题3分)化学与社会、科学、技术环境密切相关。下列说法不正确的是
A.75%的酒精、84消毒液都能杀死新冠病毒及消毒原理不同
B.水泥、玻璃、青花瓷,水晶、玛瑙、分子筛都属于硅酸盐工业产品
C.人造刚玉熔点很高,可用作高级耐火材料,及主要成分是氧化铝
D.护肤霜中甘油做保湿剂是利用了丙三醇的吸水性
9.(本题3分)下列物质的俗名与化学式相对应的是
A.水银——Ag B.干冰——H2O
C.小苏打——NaHCO3 D.重晶石——BaCO3
10.(本题3分)下列制备和收集气体的实验装置合理的是
A
B
C
D
用氯化铵和氢氧化钙固体制取氨气
用铜片和稀硝酸制NO
用锌粒和稀硫酸制H2
用双氧水和二氧化锰制O2
A.A B.B C.C D.D
11.(本题3分)下列化学用语错误的是
A.中子数为10的氧原子:falseO
B.氯化钠的电子式:
C.CH4的比例模型:
D.乙炔的结构式:H—C≡C—H
12.(本题3分)下列应用不涉及氧化还原反应的是
A.工业上制粗硅并提纯 B.用FeCl3溶液作为“腐蚀液”刻蚀电路铜板
C.实验室制SO2 D.用Na2O2作潜水艇的供氧剂
13.(本题3分)金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系,不能均由一步反应实现的是
A.Na→NaOH→Na2CO3→NaHCO3
B.Al→Al2O3→AlCl3→Al(OH)3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
14.(本题3分)下列关于物质性质及用途的描述均正确且二者存在因果关系的是
false
氨气的水溶液能导电
氨气是电解质
false
次氯酸有强氧化性
漂白粉在空气中久置会变质
false
false能与false反应产生false
false常用作呼吸面罩中的供氧剂
false
常温下浓硫酸与铁、铝不发生反应
可用铁罐、铝罐储存或运输冷的浓硫酸
A.false B.false C.false D.false
15.(本题3分)科学家已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1molN—N吸收167kJ能量,断裂1mol N≡N吸收942kJ能量,下列说法正确的是
A.N4属于一种新型的化合物
B.N4(g)=4N(g)的过程中释放1002kJ能量
C.1molN4完全反应生成N2时要释放882kJ能量
D.1molN4中有4mol N-N键,都为非极性共价键
16.(本题3分)恒温下,物质的量之比为2:1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)false2SO3(g)(正反应为放热反应),n(SO2)随时间的变化如表:
时间/min
0
1
2
3
4
5
n(SO2)/mol
0.20
0.16
0.13
0.11
0.08
0.08
下列说法正确的是
A.当容器中气体的密度不变时,该反应达到平衡状态
B.该反应进行第3min时,逆反应速率小于正反应速率
C.前4min用SO3表示的平均反应速率为0.01mol/(L?min)
D.容器内达到平衡状态时的压强与起始时的压强之比为5:4
17.(本题3分)对于反应false,若反应速率分别用false、false、false、false(单位皆为false)表示,则下列式子中,正确的是
A.false B.false
C.false D.false
18.(本题3分)已知Na2S2O3 + H2SO4=Na2SO4 + SO2↑ + S↓ + H2O,下列实验中,化学反应速率最快的是
反应温度/oC
Na2S2O3
H2SO4
H2O
体积/mL
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A.A B.B C.C D.D
19.(本题3分)在给定条件下,下列选项所示的物质间转化不能一步实现的是
A.CaCO3falseCaOfalseCaSiO3
B.FefalseFeCl2溶液falseFeCl3溶液
C.NH3falseNOfalseNO2
D.SfalseH2SfalseSO3
20.(本题3分)锌银纽扣电池总反应为false,下列说法正确的是
A.false是负极,发生还原反应 B.false电极发生氧化反应
C.电子流入false极 D.每消耗false,负极失去false
第Ⅱ卷 (非选择题 共50分)
二、填空题(共12分)
21.(本题12分)某化学学习小组设计通过以下步骤用铜丝和硫酸制取胆矾晶体:
(1)固体A为___色;胆矾的化学式为___。
(2)为加快反应②,可采取的实验方法是___(写出一种即可)。
(3)操作①、操作②的具体实验操作名称是___。
(4)有同学提出可以将反应①和反应②合并,也就是将铜丝与浓硫酸直接混合加热即可得到蓝色溶液。该同学所提方案不足之处是__(写出一种即可)。
三、工业流程题(共14分)
22.(本题14分)硫铁矿(主要成分为FeS2)是重要的矿产资源,以硫铁矿为原料制备氯化铁晶体(FeCl3?6H2O)和亚硫酸钠和亚硫酸氢钠的工艺流程如下:
(1)已知:false,请写出配平的反应方程式____
(2)通氯气氧化的目的是____;
(3)气体的主要成份是false,实验室中可用false溶液回收将false气体通入到false溶液中,溶液中含硫元素的离子的物质的量与false的通入量的关系如图:实线A是__的变化曲线,虚线B是___的变化曲线(填离子符号)交点C处发生反应的离子方程式为___。
(4)实验室用false固体配制240mL0.100mol?L-1的false溶液,需要的仪器有___、烧杯、玻棒、天平。
(5)下列配制的溶液浓度偏高的是___;
A.称量false时,称量时间较长
B.配制前,容量瓶中有少量蒸馏水
C.配制时,false未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线F.加蒸馏水时不慎相过了刻度线
四、元素或物质推断题(共14分)
23.(本题14分)A、B、C、D、E为常见的单质或化合物,相互转化关系如图所示(部分产物略去)。
(1)若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种有毒气体。
①C的电子式为______________。
②写出反应Ⅰ的化学方程式____________________________。
③写出反应Ⅱ的化学方程式____________________________________。
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴阳离子均为10电子粒子。
①D的结构式为____________。
②写出反应Ⅰ的化学方程式_____________________________。
③写出反应Ⅱ的化学方程式_______________________________________________。
清远市2020~2021学年度高一第一学期期中考试答案
1.A
【详解】
A.硫粉在空气中燃烧只能生成二氧化硫,与反应物的用量或浓度无关,故A选;
B.铜和硝酸溶液反应,如果是浓硝酸,生成NO2,如果是稀硝酸,生成NO,与反应物浓度有关系,故B不选;
C.碳与少量氧气反应生成一氧化碳,过量生成二氧化碳,与反应物的用量有关,故C不选;
D.Zn和浓硫酸反应生成SO2,和稀硫酸反应生成H2,所以与反应物的浓度有关,故D不选;
故选A。
2.B
【详解】
A.Na2O2能和水反应生成NaOH,使溶液呈碱性,能使紫色石蕊试液变蓝;同时还生成H2O2,H2O2具有漂白性,可以使溶液褪色,故A不选;
B.新制氯水中有H+,能使紫色石蕊试液变红,氯水中还有HClO,具有漂白性,可以使溶液褪色,故B选;
C.SO2具有漂白性,但SO2不能使指示剂褪色,所以SO2只能使紫色石蕊试液变红,不褪色,故C不选;
D.活性炭具有吸附性,也具有漂白性,但不能使紫色石蕊试液变红,故D不选;
故选B。
【点睛】
Na2O2和水反应分两步进行:Na2O2+2H2O=2NaOH+H2O2,2H2O2=2H2O+O2↑。
3.D
【分析】
硅酸盐是由硅元素、氧元素和金属元素攥成的化合物的总称,硅酸盐材料如陶瓷、水泥、玻璃等,据此分析;
【详解】
①制造水泥的原料是石灰石和黏土,普通水泥的主要成分是硅酸三钙、硅酸二钙和铝酸三钙等,水泥为典型的硅酸盐,故①符合题意;
②玻璃是常见的硅酸盐材料,普通玻璃的主要原料是纯碱、石灰石、石英,普通玻璃成分是硅酸钙、硅酸钠和二氧化硅,故②符合题意;
③陶瓷材料是人类应用最早的硅酸盐材料,传统陶瓷是以黏土为原料制造,故③符合题意;
④水晶为SiO2,属于氧化物,不属于硅酸盐,故④不符合题意;
答案为D。
4.D
【详解】
A.钠化学性质活泼,易与空气中的氧气和水发生反应,需要隔绝空气密封保存,钠的密度大于煤油,可以保存在煤油中,故A不符合题意;
B.液溴具有挥发性,所以在保存液溴时在棕色瓶内加入适量蒸馏水,使挥发出的溴蒸气溶解在蒸馏水中形成饱和溴水,防止液溴挥发,故B不符合题意;
C.浓硝酸见光容易分解,需要避光保存,可以保存在棕色试剂瓶,故C不符合题意;
D.NaOH溶液与玻璃中的二氧化硅反应生成硅酸钠,具有粘合性,所以氢氧化钠溶液不能用带磨口玻璃塞的普通试剂瓶贮存,应选橡皮塞,故D符合题意;
答案选D。
5.D
【详解】
由化学反应能量变化与化学键键能的关系,得该反应的能量变化=反应物总键能-生成物总键能=(436+243-2×431) kJ/mol= -183 kJ/mol,即反应放出183 kJ能量,故答案选D。
6.B
【详解】
A.根据题意可知该方法是以太阳能为热源,高效无污染的制氢,实现了太阳能向化学能的转化,A正确;
B.HI为强酸,应写成离子形式,B错误;
C.该过程中利用太阳能得到氢气,而电解水的过程中还需消耗电能,电能为二次能源,产生电能的过程中还需要消耗能源,而太阳能为一次能源,所以此法更优越,C正确;
D.据图可知该过程的实质就是利用太阳能实现水的分解,总反应为false,D正确;
综上所述答案为B。
7.D
【详解】
A.石蜡油主要是液态烷烃烃混合物,而不是烯烃的混合物,故A错;
B.该实验可以证明石蜡油分解产生了不饱和烃,而不只是烯烃,故B错;
C.装置b中的溴水和石蜡油裂化生成的不饱和烃发生加成反应,故装置b发生的反应的基本类型是加成反应,故C错;
D.由于石蜡油裂化生成不饱和烃,当不饱和烃将b中的溴消耗完后进入c装置,使酸性高锰酸钾溶液褪色,故选D。
答案选D
8.B
【详解】
A.75%的酒精的消毒原理是使蛋白质变性,84消毒液的主要成分是次氯酸钠具有强氧化性,能起到杀菌消毒的作用,原理不同,A项正确;
B.水晶、玛瑙的主要成分是二氧化硅,属于氧化物,不是硅酸盐,不属于硅酸盐工业产品,B项错误;
C.人造刚玉的主要成分是氧化铝,C项正确;
D.甘油是含有羟基数目较多的多羟基醇,具有吸水性,可作护肤保湿剂,D项正确;
答案选B。
9.C
【详解】
A.Hg的俗名为水银,故A错误;
B. 固体CO2的俗名为干冰,故B错误;
C. NaHCO3的俗名为小苏打,故C正确;
D. BaSO4的俗名为重晶石,故D错误;
答案选C。
10.D
【详解】
A.用氯化铵和氢氧化钙固体制氨气时有水生成,试管口应向下倾斜,A错误;
B.NO能和空气中的氧气反应生成NO2,应用排水法收集,B错误;
C.氢气密度比空气小,收集氢气时导管应短进长出,C错误;
D.二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,D正确;
综上所述答案为D。
11.B
【详解】
A. 氧质子数为8,中子数为10的氧原子,质量数为18,则核素符号为:falseO,A正确;
B. 氯化钠是离子化合物,电子式:false,B错误;
C. CH4为正四面体结构、碳原子半径大于氢的,则比例模型:,C正确;
D. 乙炔分子内有碳碳叁键,则结构式:H—C≡C—H,D正确;
答案选B。
12.C
【详解】
A.工业上利用碳还原二氧化硅制粗硅并提纯,C、Si元素化合价发生变化,属于氧化还原反应,A项涉及氧化还原反应,A项错误;
B.FeCl3溶液作为“腐蚀液”刻蚀电路铜板,发生反应:2FeCl3+Cu=2FeCl2+CuCl2。Fe、Cu元素化合价发生变化,属于氧化还原反应,B项错误;
C.实验室制SO2发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。由化学反应方程式可知,过程中没有元素的化合价发生变化,故不涉及氧化还原反应,C项正确;
D.用Na2O2作潜水艇的供氧剂实际上是利用过氧化钠能与二氧化碳反应生成氧气的化学性质。在这个反应过程中过氧化钠中O元素化合价由-1价变为0价,化合价发生变化,属于氧化还原反应,D项涉及氧化还原反应,D项错误;
答案选C。
13.C
【详解】
A.Na与水反应生成NaOH,NaOH与二氧化碳反应生成Na2CO3,Na2CO3与二氧化碳、水反应生成NaHCO3,A与题意不符;
B.Al与氧气反应生成Al2O3,Al2O3与盐酸反应生成AlCl3,AlCl3与氨水反应生成Al(OH)3,B与题意不符;
C.Si与氧气反应生成SiO2,SiO2不能直接生成H2SiO3,C符合题意;
D.Fe与盐酸反应生成FeCl2,FeCl2与NaOH反应生成Fe(OH)2,Fe(OH)2与氧气、水反应生成Fe(OH)3,D与题意不符;
答案为C。
14.C
【详解】
A.?NH3溶于水能导电的原因不是因为NH3本身电离而是因为NH3·H2O电离,A错误;
B.漂白粉变质的原因是因为次氯酸钙有碱性,与空气中CO2、H2O反应生成HClO,HClO不稳定分解,B错误;
C.false会与二氧化碳反应生成碳酸钠和氧气,经常用作呼吸面罩中的供氧剂, C正确;
D.浓硫酸具有强氧化性,常温下铁、铝遇到浓硫酸发生钝化,并非不反应,D错误;
故选C。
15.C
【详解】
A.N4属于单质,不是化合物,故A错误;
B.N4(g)=4N(g)的过程中吸收167kJ ×6=1002kJ能量,故B错误;
C.1mol N4断键吸收167kJ ×6=1002kJ能量,生成2mol N2时942kJ×2=1884kJ能量,因此1molN4完全反应生成N2时要释放1884kJ-1002kJ= 882kJ能量,故C正确;
D.根据图中结构,1mol N4中有6mol N-N键,都为非极性共价键,故D错误。
综上所述,答案为C。
16.B
【详解】
A.容器容积不变,气体的总质量不变,则气体的密度始终不变,因此容器内气体的密度不变,不能说明反应达到平衡状态,A错误;
B.根据表中数据可知反应进行到第3min时没有达到平衡状态,反应向正反应方向进行,则逆反应速率小于正反应速率,B正确;
C.由表格中的数据可知,4min时消耗二氧化硫的物质的量为false,即生成SO3的物质的量为0.12mol,浓度是0.06mol/L,则用SO3表示的平均反应速率为false,C错误;
D.开始时SO2和O2的物质的量分别为0.2mol、0.1mol,由表格中的数据计算可知平衡时SO2、O2、SO3的物质的量分别为0.08mol、0.04mol、0.12mol,其他条件相同时,压强之比等于气体物质的量之比,达到平衡状态时的压强与起始时的压强之比为false,D错误;
答案选B。
17.D
【详解】
A.false,则false,A错误;
B.false,则falsefalse,B错误;
C.false,则false,C错误;
D.falsefalse,则false,D正确;
故选D。
18.D
【详解】
由表格中的数据可知,35℃>25℃,则C、D的反应速率大于A、B中的反应速率,又D中浓度大于C中的浓度,所以D中反应速率最大。
故选D。
19.D
【详解】
A.CaCO3在高温下分解生成CaO,CaO与SiO2在高温下反应生成CaSiO3,转化关系均可一步实现,故A不符合题意;
B.Fe和盐酸反应生成FeCl2溶液,FeCl2溶液与氯气反应生成FeCl3溶液,转化关系均可一步实现,故B不符合题意;
C.NH3在催化剂作用下与氧气发生催化氧化反应生成NO,NO与氧气化合生成NO2,转化关系均可一步实现,故C不符合题意;
D.S和氢气在点燃的条件下反应生成H2S,H2S与氧气在点燃的条件下反应生成SO2,则H2SfalseSO3不能一步实现,故D符合题意;
答案选D。
20.D
【详解】
A.锌失电子,是负极,发生氧化反应,故A错误;
B.false化合价降低得电子,发生还原反应,故B错误;
C.电子从负极流向正极,锌是负极,电子从锌流出,故C错误;
D.false是1mol,1mol锌可以失去false,故D正确。
故答案为D
21.黑 CuSO4?5H2O 搅拌 加热蒸发、冷却结晶 消耗更多硫酸
【分析】
铜丝在空气中加热,与空气中的氧气反应生成氧化铜,氧化铜与浓硫酸反应生成硫酸铜和水,得到的硫酸铜溶液经过蒸发浓缩,冷却结晶得到胆矾晶体,据此分析解答。
【详解】
(1) 铜丝在空气中加热,与空气中的氧气反应生成氧化铜,因此固体A为黑色;胆矾的化学式为CuSO4?5H2O,故答案为:黑;CuSO4?5H2O;
(2)为加快反应②,可采取的实验方法可以是搅拌,加热等,故答案为:搅拌(或加热);
(3)从硫酸铜溶液中获得胆矾晶体,需要经过的操作①、操作②为蒸发浓缩,冷却结晶,故答案为:加热蒸发(或蒸发浓缩)、冷却结晶;
(4)铜与浓硫酸反应会生成二氧化硫,硫酸的利用率降低,因此将铜丝与浓硫酸直接混合加热即可得到蓝色溶液,会消耗更多硫酸,同时会造成空气污染,故答案为:消耗更多硫酸(会污染空气)。
22.4FeS2+11O2false2Fe2O3+8SO2 使溶液中的Fe2+转化为Fe3+,提高产率 false false SO2+H2O+false=2false 250ml容量瓶、胶头滴管 CE
【分析】
根据题中工业流程,FeS2经过在空气中和氧气充分反应生成Fe2O3和SO2,其中SO2和氢氧化钠溶液反应制取Na2SO3和NaHSO3。Fe2O3和足量稀盐酸反应溶解,过滤不溶性杂质后得到FeCl3溶液,其中会有混有Fe2+杂质。再通入氯气进行氧化将Fe2+全部转化为Fe3+,经过后续的结晶得到产物FeCl3?6H2O晶体粗品。
【详解】
(1)根据氧化还原反应的配平方法配平得到化学反应方程式为:4FeS2+11O2false2Fe2O3+8SO2
(2)加酸溶解后的溶液中会存在Fe2+杂质,通入氯气将其氧化为Fe3+,提高产物的纯度,提高产率,故通氯气作用为:使溶液中的Fe2+转化为Fe3+,提高产率。
(3)氢氧化钠溶液分别与少量和过量二氧化硫反应的化学方程式是不同的,少量:false。过量:false,false,所以当有少量二氧化硫通入时先产生false,随着二氧化硫的量的增多,逐渐生成false,同时false的量减少。故A曲线为false,曲线B为false。C点为falsefalse共存,故正在发生false转化为false的反应,故离子方程式为SO2+H2O+false=2false。
(4) 配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、稀释、冷却、移液、洗涤、定容、摇匀、装瓶贴标签。用到的仪器:托盘天平、药匙、烧杯、玻璃杯、容量瓶、胶头滴管,配制240mL溶液应选择250mL容量瓶,所以还需要的仪器:250 mL容量瓶、胶头滴管;
(5)A.氢氧化钠固体在空气中容易吸水潮解变质,称量时间过长会使称量的氢氧化钠物质的量减少,溶质减少,浓度变低,故A错误;
B. 容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积均无影响,溶液的物质的量浓度不变,故B错误;
C.配制时,false未冷却直接定容因热涨冷缩的原因,导致所配制溶液的体积偏小,物质的量浓度偏大,故C正确;
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,导致溶质的物质的量偏小,所得溶液的浓度偏低,故D错误;
E. 定容时,俯视观察刻度线和液面,导致加入蒸馏水的体积偏小,所得溶液浓度偏高,故E正确;
F. 加蒸馏水时不慎超过了刻度,导致容量瓶中进入的蒸馏水体积偏大,配制的溶液体积偏大,溶液浓度偏低,需要重新配制,故F错误;
故选CE。
23.falseNfalsefalseNfalse 4NH3+5O2false4NO+6H2O 2NO+2CO=N2+2CO2 O=C=O 2Na2O2+2CO2=2Na2CO3+O2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【分析】
(1)A是能使湿的红色石蕊试纸变蓝的气体,推出A为NH3,C和D均为空气的主要成分,则可能为O2和N2,根据转化关系可以推出D为O2、C为N2,E是一种有毒气体,NO转化成N2,被还原,E为还原剂,化合价升高,E可能是CO或NH3,但A为NH3,因此E为CO;
(2)A是淡黄色化合物,即A为Na2O2,D为无色气体,根据Na2O2的化学性质,则D为CO2,发生2Na2O2+2CO2=2Na2CO3+O2,C是由阴阳离子构成,即C为离子化合物,阴阳离子又是10电子微粒,根据转化关系,推出B为Na2CO3,E为Ca(OH)2,C为NaOH。
【详解】
(1)①根据分析,A为N2,电子式为falseNfalsefalseNfalse;
②反应Ⅰ为氨的催化氧化,反应的化学方程式为4NH3+5O2false4NO+6H2O;
③反应Ⅱ为NO与CO的反应,反应方程式为2NO+2CO=N2+2CO2;
(2)①根据分析,D为CO2,结构式为O=C=O;
②反应Ⅰ为过氧化钠与CO2的反应,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
③反应Ⅱ为Na2CO3与Ca(OH)2的反应,反应方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(化学班)
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间60分钟。
2.请将各题答案填写在答题卡上。
3.可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24
第Ⅰ卷 (选择题 共50分)
1.(本题3分)下列反应中,调节反应物的用量或浓度不会改变反应产物的是
A.硫粉在空气中燃烧 B.硝酸中加入铜片
C.炭与氧气反应 D.硫酸中加入锌粒
2.(本题3分)能使紫色石蕊溶液先变红后褪色的是
A.false固体 B.新制氯水 C.false D.活性炭
3.(本题3分)下列物质中属于硅酸盐材料的是
①水泥 ②玻璃 ③陶瓷 ④水晶
A.只有①③ B.②④ C.只有②③ D.①②③
4.(本题3分)下列试剂在实验室中的保存方法错误的是
A.金属钠在煤油中密封保存
B.液溴可用少量水液封保存
C.硝酸保存在棕色试剂瓶中
D.氢氧化钠溶液保存在带有玻璃塞的试剂瓶中
5.(本题3分)某些化学键的键能数据如表,若1molH2与1molCl2完全燃烧(H2+Cl2=2HCl),则下列说法正确的是
化学键
Cl-Cl
H-H
H-Cl
键能/kJ·mol?1
243
436
431
A.反应共吸收248kJ热量 B.反应共放出248kJ热量
C.反应共吸收183kJ热量 D.反应共放出183kJ热量
6.(本题3分)氢能是一种极具发展潜力的清洁能源,图中是一种以太阳能为热源,高效无污染的制氢方法
下列说法错误的是
A.该过程实现了太阳能向化学能的转化
B.反应Ⅰ的离子方程式为false
C.与电解水制备氢气相比,此过程更加优越
D.该过程的总反应为false
7.(本题3分)石蜡油分解及其产物性质实验装置如图,下列说法正确的是
A.石蜡油是液态烯烃混合物
B.该实验可以证明石蜡油分解产生了乙烯
C.装置b发生的反应的基本类型是取代反应
D.实验中可观察到装置c中溶液褪色
8.(本题3分)化学与社会、科学、技术环境密切相关。下列说法不正确的是
A.75%的酒精、84消毒液都能杀死新冠病毒及消毒原理不同
B.水泥、玻璃、青花瓷,水晶、玛瑙、分子筛都属于硅酸盐工业产品
C.人造刚玉熔点很高,可用作高级耐火材料,及主要成分是氧化铝
D.护肤霜中甘油做保湿剂是利用了丙三醇的吸水性
9.(本题3分)下列物质的俗名与化学式相对应的是
A.水银——Ag B.干冰——H2O
C.小苏打——NaHCO3 D.重晶石——BaCO3
10.(本题3分)下列制备和收集气体的实验装置合理的是
A
B
C
D
用氯化铵和氢氧化钙固体制取氨气
用铜片和稀硝酸制NO
用锌粒和稀硫酸制H2
用双氧水和二氧化锰制O2
A.A B.B C.C D.D
11.(本题3分)下列化学用语错误的是
A.中子数为10的氧原子:falseO
B.氯化钠的电子式:
C.CH4的比例模型:
D.乙炔的结构式:H—C≡C—H
12.(本题3分)下列应用不涉及氧化还原反应的是
A.工业上制粗硅并提纯 B.用FeCl3溶液作为“腐蚀液”刻蚀电路铜板
C.实验室制SO2 D.用Na2O2作潜水艇的供氧剂
13.(本题3分)金属及其化合物的转化关系是化学学习的重要内容之一。下列各组物质的转化关系,不能均由一步反应实现的是
A.Na→NaOH→Na2CO3→NaHCO3
B.Al→Al2O3→AlCl3→Al(OH)3
C.Si→SiO2→H2SiO3→Na2SiO3
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
14.(本题3分)下列关于物质性质及用途的描述均正确且二者存在因果关系的是
false
氨气的水溶液能导电
氨气是电解质
false
次氯酸有强氧化性
漂白粉在空气中久置会变质
false
false能与false反应产生false
false常用作呼吸面罩中的供氧剂
false
常温下浓硫酸与铁、铝不发生反应
可用铁罐、铝罐储存或运输冷的浓硫酸
A.false B.false C.false D.false
15.(本题3分)科学家已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1molN—N吸收167kJ能量,断裂1mol N≡N吸收942kJ能量,下列说法正确的是
A.N4属于一种新型的化合物
B.N4(g)=4N(g)的过程中释放1002kJ能量
C.1molN4完全反应生成N2时要释放882kJ能量
D.1molN4中有4mol N-N键,都为非极性共价键
16.(本题3分)恒温下,物质的量之比为2:1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)false2SO3(g)(正反应为放热反应),n(SO2)随时间的变化如表:
时间/min
0
1
2
3
4
5
n(SO2)/mol
0.20
0.16
0.13
0.11
0.08
0.08
下列说法正确的是
A.当容器中气体的密度不变时,该反应达到平衡状态
B.该反应进行第3min时,逆反应速率小于正反应速率
C.前4min用SO3表示的平均反应速率为0.01mol/(L?min)
D.容器内达到平衡状态时的压强与起始时的压强之比为5:4
17.(本题3分)对于反应false,若反应速率分别用false、false、false、false(单位皆为false)表示,则下列式子中,正确的是
A.false B.false
C.false D.false
18.(本题3分)已知Na2S2O3 + H2SO4=Na2SO4 + SO2↑ + S↓ + H2O,下列实验中,化学反应速率最快的是
反应温度/oC
Na2S2O3
H2SO4
H2O
体积/mL
浓度/mol·L-1
体积/mL
浓度/mol·L-1
体积/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A.A B.B C.C D.D
19.(本题3分)在给定条件下,下列选项所示的物质间转化不能一步实现的是
A.CaCO3falseCaOfalseCaSiO3
B.FefalseFeCl2溶液falseFeCl3溶液
C.NH3falseNOfalseNO2
D.SfalseH2SfalseSO3
20.(本题3分)锌银纽扣电池总反应为false,下列说法正确的是
A.false是负极,发生还原反应 B.false电极发生氧化反应
C.电子流入false极 D.每消耗false,负极失去false
第Ⅱ卷 (非选择题 共50分)
二、填空题(共12分)
21.(本题12分)某化学学习小组设计通过以下步骤用铜丝和硫酸制取胆矾晶体:
(1)固体A为___色;胆矾的化学式为___。
(2)为加快反应②,可采取的实验方法是___(写出一种即可)。
(3)操作①、操作②的具体实验操作名称是___。
(4)有同学提出可以将反应①和反应②合并,也就是将铜丝与浓硫酸直接混合加热即可得到蓝色溶液。该同学所提方案不足之处是__(写出一种即可)。
三、工业流程题(共14分)
22.(本题14分)硫铁矿(主要成分为FeS2)是重要的矿产资源,以硫铁矿为原料制备氯化铁晶体(FeCl3?6H2O)和亚硫酸钠和亚硫酸氢钠的工艺流程如下:
(1)已知:false,请写出配平的反应方程式____
(2)通氯气氧化的目的是____;
(3)气体的主要成份是false,实验室中可用false溶液回收将false气体通入到false溶液中,溶液中含硫元素的离子的物质的量与false的通入量的关系如图:实线A是__的变化曲线,虚线B是___的变化曲线(填离子符号)交点C处发生反应的离子方程式为___。
(4)实验室用false固体配制240mL0.100mol?L-1的false溶液,需要的仪器有___、烧杯、玻棒、天平。
(5)下列配制的溶液浓度偏高的是___;
A.称量false时,称量时间较长
B.配制前,容量瓶中有少量蒸馏水
C.配制时,false未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线F.加蒸馏水时不慎相过了刻度线
四、元素或物质推断题(共14分)
23.(本题14分)A、B、C、D、E为常见的单质或化合物,相互转化关系如图所示(部分产物略去)。
(1)若A是能使湿润红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种有毒气体。
①C的电子式为______________。
②写出反应Ⅰ的化学方程式____________________________。
③写出反应Ⅱ的化学方程式____________________________________。
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴阳离子均为10电子粒子。
①D的结构式为____________。
②写出反应Ⅰ的化学方程式_____________________________。
③写出反应Ⅱ的化学方程式_______________________________________________。
清远市2020~2021学年度高一第一学期期中考试答案
1.A
【详解】
A.硫粉在空气中燃烧只能生成二氧化硫,与反应物的用量或浓度无关,故A选;
B.铜和硝酸溶液反应,如果是浓硝酸,生成NO2,如果是稀硝酸,生成NO,与反应物浓度有关系,故B不选;
C.碳与少量氧气反应生成一氧化碳,过量生成二氧化碳,与反应物的用量有关,故C不选;
D.Zn和浓硫酸反应生成SO2,和稀硫酸反应生成H2,所以与反应物的浓度有关,故D不选;
故选A。
2.B
【详解】
A.Na2O2能和水反应生成NaOH,使溶液呈碱性,能使紫色石蕊试液变蓝;同时还生成H2O2,H2O2具有漂白性,可以使溶液褪色,故A不选;
B.新制氯水中有H+,能使紫色石蕊试液变红,氯水中还有HClO,具有漂白性,可以使溶液褪色,故B选;
C.SO2具有漂白性,但SO2不能使指示剂褪色,所以SO2只能使紫色石蕊试液变红,不褪色,故C不选;
D.活性炭具有吸附性,也具有漂白性,但不能使紫色石蕊试液变红,故D不选;
故选B。
【点睛】
Na2O2和水反应分两步进行:Na2O2+2H2O=2NaOH+H2O2,2H2O2=2H2O+O2↑。
3.D
【分析】
硅酸盐是由硅元素、氧元素和金属元素攥成的化合物的总称,硅酸盐材料如陶瓷、水泥、玻璃等,据此分析;
【详解】
①制造水泥的原料是石灰石和黏土,普通水泥的主要成分是硅酸三钙、硅酸二钙和铝酸三钙等,水泥为典型的硅酸盐,故①符合题意;
②玻璃是常见的硅酸盐材料,普通玻璃的主要原料是纯碱、石灰石、石英,普通玻璃成分是硅酸钙、硅酸钠和二氧化硅,故②符合题意;
③陶瓷材料是人类应用最早的硅酸盐材料,传统陶瓷是以黏土为原料制造,故③符合题意;
④水晶为SiO2,属于氧化物,不属于硅酸盐,故④不符合题意;
答案为D。
4.D
【详解】
A.钠化学性质活泼,易与空气中的氧气和水发生反应,需要隔绝空气密封保存,钠的密度大于煤油,可以保存在煤油中,故A不符合题意;
B.液溴具有挥发性,所以在保存液溴时在棕色瓶内加入适量蒸馏水,使挥发出的溴蒸气溶解在蒸馏水中形成饱和溴水,防止液溴挥发,故B不符合题意;
C.浓硝酸见光容易分解,需要避光保存,可以保存在棕色试剂瓶,故C不符合题意;
D.NaOH溶液与玻璃中的二氧化硅反应生成硅酸钠,具有粘合性,所以氢氧化钠溶液不能用带磨口玻璃塞的普通试剂瓶贮存,应选橡皮塞,故D符合题意;
答案选D。
5.D
【详解】
由化学反应能量变化与化学键键能的关系,得该反应的能量变化=反应物总键能-生成物总键能=(436+243-2×431) kJ/mol= -183 kJ/mol,即反应放出183 kJ能量,故答案选D。
6.B
【详解】
A.根据题意可知该方法是以太阳能为热源,高效无污染的制氢,实现了太阳能向化学能的转化,A正确;
B.HI为强酸,应写成离子形式,B错误;
C.该过程中利用太阳能得到氢气,而电解水的过程中还需消耗电能,电能为二次能源,产生电能的过程中还需要消耗能源,而太阳能为一次能源,所以此法更优越,C正确;
D.据图可知该过程的实质就是利用太阳能实现水的分解,总反应为false,D正确;
综上所述答案为B。
7.D
【详解】
A.石蜡油主要是液态烷烃烃混合物,而不是烯烃的混合物,故A错;
B.该实验可以证明石蜡油分解产生了不饱和烃,而不只是烯烃,故B错;
C.装置b中的溴水和石蜡油裂化生成的不饱和烃发生加成反应,故装置b发生的反应的基本类型是加成反应,故C错;
D.由于石蜡油裂化生成不饱和烃,当不饱和烃将b中的溴消耗完后进入c装置,使酸性高锰酸钾溶液褪色,故选D。
答案选D
8.B
【详解】
A.75%的酒精的消毒原理是使蛋白质变性,84消毒液的主要成分是次氯酸钠具有强氧化性,能起到杀菌消毒的作用,原理不同,A项正确;
B.水晶、玛瑙的主要成分是二氧化硅,属于氧化物,不是硅酸盐,不属于硅酸盐工业产品,B项错误;
C.人造刚玉的主要成分是氧化铝,C项正确;
D.甘油是含有羟基数目较多的多羟基醇,具有吸水性,可作护肤保湿剂,D项正确;
答案选B。
9.C
【详解】
A.Hg的俗名为水银,故A错误;
B. 固体CO2的俗名为干冰,故B错误;
C. NaHCO3的俗名为小苏打,故C正确;
D. BaSO4的俗名为重晶石,故D错误;
答案选C。
10.D
【详解】
A.用氯化铵和氢氧化钙固体制氨气时有水生成,试管口应向下倾斜,A错误;
B.NO能和空气中的氧气反应生成NO2,应用排水法收集,B错误;
C.氢气密度比空气小,收集氢气时导管应短进长出,C错误;
D.二氧化锰可以催化双氧水分解产生氧气,氧气难溶于水,可以用排水法收集,D正确;
综上所述答案为D。
11.B
【详解】
A. 氧质子数为8,中子数为10的氧原子,质量数为18,则核素符号为:falseO,A正确;
B. 氯化钠是离子化合物,电子式:false,B错误;
C. CH4为正四面体结构、碳原子半径大于氢的,则比例模型:,C正确;
D. 乙炔分子内有碳碳叁键,则结构式:H—C≡C—H,D正确;
答案选B。
12.C
【详解】
A.工业上利用碳还原二氧化硅制粗硅并提纯,C、Si元素化合价发生变化,属于氧化还原反应,A项涉及氧化还原反应,A项错误;
B.FeCl3溶液作为“腐蚀液”刻蚀电路铜板,发生反应:2FeCl3+Cu=2FeCl2+CuCl2。Fe、Cu元素化合价发生变化,属于氧化还原反应,B项错误;
C.实验室制SO2发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。由化学反应方程式可知,过程中没有元素的化合价发生变化,故不涉及氧化还原反应,C项正确;
D.用Na2O2作潜水艇的供氧剂实际上是利用过氧化钠能与二氧化碳反应生成氧气的化学性质。在这个反应过程中过氧化钠中O元素化合价由-1价变为0价,化合价发生变化,属于氧化还原反应,D项涉及氧化还原反应,D项错误;
答案选C。
13.C
【详解】
A.Na与水反应生成NaOH,NaOH与二氧化碳反应生成Na2CO3,Na2CO3与二氧化碳、水反应生成NaHCO3,A与题意不符;
B.Al与氧气反应生成Al2O3,Al2O3与盐酸反应生成AlCl3,AlCl3与氨水反应生成Al(OH)3,B与题意不符;
C.Si与氧气反应生成SiO2,SiO2不能直接生成H2SiO3,C符合题意;
D.Fe与盐酸反应生成FeCl2,FeCl2与NaOH反应生成Fe(OH)2,Fe(OH)2与氧气、水反应生成Fe(OH)3,D与题意不符;
答案为C。
14.C
【详解】
A.?NH3溶于水能导电的原因不是因为NH3本身电离而是因为NH3·H2O电离,A错误;
B.漂白粉变质的原因是因为次氯酸钙有碱性,与空气中CO2、H2O反应生成HClO,HClO不稳定分解,B错误;
C.false会与二氧化碳反应生成碳酸钠和氧气,经常用作呼吸面罩中的供氧剂, C正确;
D.浓硫酸具有强氧化性,常温下铁、铝遇到浓硫酸发生钝化,并非不反应,D错误;
故选C。
15.C
【详解】
A.N4属于单质,不是化合物,故A错误;
B.N4(g)=4N(g)的过程中吸收167kJ ×6=1002kJ能量,故B错误;
C.1mol N4断键吸收167kJ ×6=1002kJ能量,生成2mol N2时942kJ×2=1884kJ能量,因此1molN4完全反应生成N2时要释放1884kJ-1002kJ= 882kJ能量,故C正确;
D.根据图中结构,1mol N4中有6mol N-N键,都为非极性共价键,故D错误。
综上所述,答案为C。
16.B
【详解】
A.容器容积不变,气体的总质量不变,则气体的密度始终不变,因此容器内气体的密度不变,不能说明反应达到平衡状态,A错误;
B.根据表中数据可知反应进行到第3min时没有达到平衡状态,反应向正反应方向进行,则逆反应速率小于正反应速率,B正确;
C.由表格中的数据可知,4min时消耗二氧化硫的物质的量为false,即生成SO3的物质的量为0.12mol,浓度是0.06mol/L,则用SO3表示的平均反应速率为false,C错误;
D.开始时SO2和O2的物质的量分别为0.2mol、0.1mol,由表格中的数据计算可知平衡时SO2、O2、SO3的物质的量分别为0.08mol、0.04mol、0.12mol,其他条件相同时,压强之比等于气体物质的量之比,达到平衡状态时的压强与起始时的压强之比为false,D错误;
答案选B。
17.D
【详解】
A.false,则false,A错误;
B.false,则falsefalse,B错误;
C.false,则false,C错误;
D.falsefalse,则false,D正确;
故选D。
18.D
【详解】
由表格中的数据可知,35℃>25℃,则C、D的反应速率大于A、B中的反应速率,又D中浓度大于C中的浓度,所以D中反应速率最大。
故选D。
19.D
【详解】
A.CaCO3在高温下分解生成CaO,CaO与SiO2在高温下反应生成CaSiO3,转化关系均可一步实现,故A不符合题意;
B.Fe和盐酸反应生成FeCl2溶液,FeCl2溶液与氯气反应生成FeCl3溶液,转化关系均可一步实现,故B不符合题意;
C.NH3在催化剂作用下与氧气发生催化氧化反应生成NO,NO与氧气化合生成NO2,转化关系均可一步实现,故C不符合题意;
D.S和氢气在点燃的条件下反应生成H2S,H2S与氧气在点燃的条件下反应生成SO2,则H2SfalseSO3不能一步实现,故D符合题意;
答案选D。
20.D
【详解】
A.锌失电子,是负极,发生氧化反应,故A错误;
B.false化合价降低得电子,发生还原反应,故B错误;
C.电子从负极流向正极,锌是负极,电子从锌流出,故C错误;
D.false是1mol,1mol锌可以失去false,故D正确。
故答案为D
21.黑 CuSO4?5H2O 搅拌 加热蒸发、冷却结晶 消耗更多硫酸
【分析】
铜丝在空气中加热,与空气中的氧气反应生成氧化铜,氧化铜与浓硫酸反应生成硫酸铜和水,得到的硫酸铜溶液经过蒸发浓缩,冷却结晶得到胆矾晶体,据此分析解答。
【详解】
(1) 铜丝在空气中加热,与空气中的氧气反应生成氧化铜,因此固体A为黑色;胆矾的化学式为CuSO4?5H2O,故答案为:黑;CuSO4?5H2O;
(2)为加快反应②,可采取的实验方法可以是搅拌,加热等,故答案为:搅拌(或加热);
(3)从硫酸铜溶液中获得胆矾晶体,需要经过的操作①、操作②为蒸发浓缩,冷却结晶,故答案为:加热蒸发(或蒸发浓缩)、冷却结晶;
(4)铜与浓硫酸反应会生成二氧化硫,硫酸的利用率降低,因此将铜丝与浓硫酸直接混合加热即可得到蓝色溶液,会消耗更多硫酸,同时会造成空气污染,故答案为:消耗更多硫酸(会污染空气)。
22.4FeS2+11O2false2Fe2O3+8SO2 使溶液中的Fe2+转化为Fe3+,提高产率 false false SO2+H2O+false=2false 250ml容量瓶、胶头滴管 CE
【分析】
根据题中工业流程,FeS2经过在空气中和氧气充分反应生成Fe2O3和SO2,其中SO2和氢氧化钠溶液反应制取Na2SO3和NaHSO3。Fe2O3和足量稀盐酸反应溶解,过滤不溶性杂质后得到FeCl3溶液,其中会有混有Fe2+杂质。再通入氯气进行氧化将Fe2+全部转化为Fe3+,经过后续的结晶得到产物FeCl3?6H2O晶体粗品。
【详解】
(1)根据氧化还原反应的配平方法配平得到化学反应方程式为:4FeS2+11O2false2Fe2O3+8SO2
(2)加酸溶解后的溶液中会存在Fe2+杂质,通入氯气将其氧化为Fe3+,提高产物的纯度,提高产率,故通氯气作用为:使溶液中的Fe2+转化为Fe3+,提高产率。
(3)氢氧化钠溶液分别与少量和过量二氧化硫反应的化学方程式是不同的,少量:false。过量:false,false,所以当有少量二氧化硫通入时先产生false,随着二氧化硫的量的增多,逐渐生成false,同时false的量减少。故A曲线为false,曲线B为false。C点为falsefalse共存,故正在发生false转化为false的反应,故离子方程式为SO2+H2O+false=2false。
(4) 配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、稀释、冷却、移液、洗涤、定容、摇匀、装瓶贴标签。用到的仪器:托盘天平、药匙、烧杯、玻璃杯、容量瓶、胶头滴管,配制240mL溶液应选择250mL容量瓶,所以还需要的仪器:250 mL容量瓶、胶头滴管;
(5)A.氢氧化钠固体在空气中容易吸水潮解变质,称量时间过长会使称量的氢氧化钠物质的量减少,溶质减少,浓度变低,故A错误;
B. 容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液的体积均无影响,溶液的物质的量浓度不变,故B错误;
C.配制时,false未冷却直接定容因热涨冷缩的原因,导致所配制溶液的体积偏小,物质的量浓度偏大,故C正确;
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,导致溶质的物质的量偏小,所得溶液的浓度偏低,故D错误;
E. 定容时,俯视观察刻度线和液面,导致加入蒸馏水的体积偏小,所得溶液浓度偏高,故E正确;
F. 加蒸馏水时不慎超过了刻度,导致容量瓶中进入的蒸馏水体积偏大,配制的溶液体积偏大,溶液浓度偏低,需要重新配制,故F错误;
故选CE。
23.falseNfalsefalseNfalse 4NH3+5O2false4NO+6H2O 2NO+2CO=N2+2CO2 O=C=O 2Na2O2+2CO2=2Na2CO3+O2 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
【分析】
(1)A是能使湿的红色石蕊试纸变蓝的气体,推出A为NH3,C和D均为空气的主要成分,则可能为O2和N2,根据转化关系可以推出D为O2、C为N2,E是一种有毒气体,NO转化成N2,被还原,E为还原剂,化合价升高,E可能是CO或NH3,但A为NH3,因此E为CO;
(2)A是淡黄色化合物,即A为Na2O2,D为无色气体,根据Na2O2的化学性质,则D为CO2,发生2Na2O2+2CO2=2Na2CO3+O2,C是由阴阳离子构成,即C为离子化合物,阴阳离子又是10电子微粒,根据转化关系,推出B为Na2CO3,E为Ca(OH)2,C为NaOH。
【详解】
(1)①根据分析,A为N2,电子式为falseNfalsefalseNfalse;
②反应Ⅰ为氨的催化氧化,反应的化学方程式为4NH3+5O2false4NO+6H2O;
③反应Ⅱ为NO与CO的反应,反应方程式为2NO+2CO=N2+2CO2;
(2)①根据分析,D为CO2,结构式为O=C=O;
②反应Ⅰ为过氧化钠与CO2的反应,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;
③反应Ⅱ为Na2CO3与Ca(OH)2的反应,反应方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
同课章节目录
