2.2 金属的化学性质(第4课时)课件(共16张PPT)
文档属性
| 名称 | 2.2 金属的化学性质(第4课时)课件(共16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 406.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-07-09 00:00:00 | ||
图片预览






文档简介
2.2 金属的化学性质
思考与讨论:
如何设计实验比较镁、锌、铜的活动性,并从大到小列出它们的活动性顺序。
方案一:镁、锌、铜三种金属分别投入稀硫酸中,观察实验现象。
结论:Mg> Zn > H >Cu
方案二:镁、锌、铜三种金属分别在氧气中灼烧,观察实验现象。
结论:Mg> Zn > Cu
方案三:镁条和锌粒分别放入硫酸锌、硫酸铜溶液中观察实验现象
结论:Mg> Zn > Cu
动动脑
只选择三种试剂,能比较镁、锌、铜的活动性?
镁条、硝酸锌溶液、铜片
一头一尾金属中间盐溶液
硝酸镁溶液、锌粒、硝酸铜溶液
一头一尾盐溶液中间金属
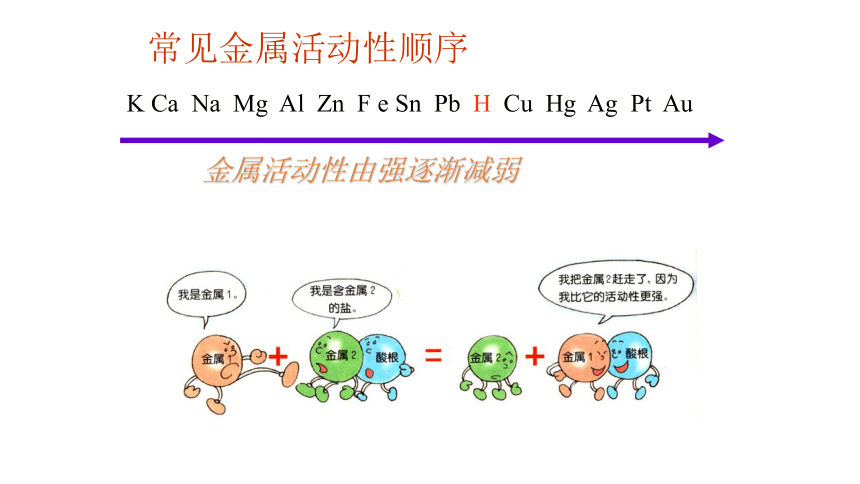
K Ca Na Mg Al Zn F e Sn Pb H Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
常见金属活动性顺序
归纳:金属与盐发生反应的条件
1、排在前面的金属可以把排在它后面的金属从其盐溶液中置换出来。 (简单说:前金置后金)
2、参加反应的盐必须是可溶性的盐溶液。
如:Zn+AgCl 反应吗?
讨论:下列反应能否发生?为什么?
① ZnSO4+Cu ② Cu+H2SO4 ③ Zn+AgNO3 ④ Ag+HCl ⑤ Al+ZnCl2 ⑥ Fe+Hg(NO3)2 ⑦ Cu+AgCl ⑧ Sn+HCl
思考
1、金属钠保存在哪种液体中?
煤油中
2、为什么要浸在煤油中?
极易被氧化
3、为什么不保存在水中?
钠会和水发生反应
实验1
从煤油中取一小块金属钠,用小刀切去一端的外皮,观察实验现象.
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
将金属钠放入水中,发现钠漂浮在水面上,并在水面四处“游走”发出“咝咝”的声音,片刻后熔成一个银白色小球,酚酞试液变红
实验2:把1块绿豆大小的金属钠放入1小杯滴有酚酞的水中。
注意:该实验反应剧烈,实验操作时要小心,避免沾到溅起的液体。
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
物理性质:密度比煤油大,比水小;
硬度小;银白色,熔点低。
化学性质:极易与氧气、水反应,且反应放出大量的热。
方程式:
2Na+H2O==2NaOH+H2 ↑
你知道还有哪些金属可以和水反应?
K、Ca、Ba
实验3:
把1块绿豆大小的金属钠放入1小杯硫酸铜溶液中。
方程式:
2Na+H2O==2NaOH+H2 ↑
现象:
产生气泡,溶液中出现蓝色沉淀,溶液逐渐由蓝色变为无色。
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
黑色固体产生
Cu(OH)2=CuO+H2O
归纳:金属与盐发生反应的条件
3、金属单质(K、Ca、Na、 Ba除外)
注意:特别活泼金属 K、Ca、Na、Ba与金属盐溶液反应时先与水反应生成碱和氢气,然后是碱与盐反应。
1、排在前面的金属可以把排在它后面的金属从其盐溶液中置换出来。 (简单说:前金置后金)
2、参加反应的盐必须是可溶性的盐溶液。
金属活动性的应用:
1、一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。
金属 + 可溶性的盐 = 金属 + 盐
2、排在氢前面的金属可以把酸里的氢置换出来,排在氢后面的金属不能。
金属 + 酸 = 盐 + 氢气
Zn + FeSO4 =
Zn + H2SO4 =
均指元素
1.根据金属活动性顺序表判断能否用锡壶装酸性物质, 并说出理由。
2.能否用铁制的容器配制浸种用的波尔多液 (含硫酸铜) ?为什么?
不能,因为锡在氢之前能跟酸反应。
Sn + 2HCl = SnCl2 + H2↑
不能,铁能跟波尔多液反应。
Fe + CuSO4 = FeSO4 + Cu
阅读:化学反应中的电子转移(课本p45)
思考:为什么铜离子会从溶液中析出变成金属铜,而金属锌则变成锌离子进入溶液?
在上述的化学反应中,金属锌失去电子变成锌离子进入溶液,而铜离子从金属锌表面得到了电子变成了金属铜,上述反应的过程实际上是电子转移的过程。
Zn + CuSO4 = Zn SO4 + Cu
2e
练习与活动
1、设计实验除去杂质:?铜粉中含有的少量铁粉;?FeCl2溶液中含有的少量CuCl2 。
a1.加入过量稀盐酸,过滤得滤渣,用水冲洗烘干。
b.加入过量铁粉,过滤得滤液
a2.加入过量氯化铜溶液,过滤得滤渣
a3.用磁铁吸引除去铁粉
化工颜料商店出售的涂料添加剂“银粉”是什么金属,通过实验做出初步分析和判断,并提交调查分析报告。
调查
“银粉”是铝粉。将“银粉”放入稀硫酸中,有气泡产生。
小 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀HCl或稀H2SO4反应
(3)部分金属能与盐溶液反应
2、判断常见金属活泼性的方法
(1)金属与酸反应的剧烈程度
(2)金属与能否与盐溶液反应
(3)金属与氧气反应的难易程度
思考与讨论:
如何设计实验比较镁、锌、铜的活动性,并从大到小列出它们的活动性顺序。
方案一:镁、锌、铜三种金属分别投入稀硫酸中,观察实验现象。
结论:Mg> Zn > H >Cu
方案二:镁、锌、铜三种金属分别在氧气中灼烧,观察实验现象。
结论:Mg> Zn > Cu
方案三:镁条和锌粒分别放入硫酸锌、硫酸铜溶液中观察实验现象
结论:Mg> Zn > Cu
动动脑
只选择三种试剂,能比较镁、锌、铜的活动性?
镁条、硝酸锌溶液、铜片
一头一尾金属中间盐溶液
硝酸镁溶液、锌粒、硝酸铜溶液
一头一尾盐溶液中间金属
K Ca Na Mg Al Zn F e Sn Pb H Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
常见金属活动性顺序
归纳:金属与盐发生反应的条件
1、排在前面的金属可以把排在它后面的金属从其盐溶液中置换出来。 (简单说:前金置后金)
2、参加反应的盐必须是可溶性的盐溶液。
如:Zn+AgCl 反应吗?
讨论:下列反应能否发生?为什么?
① ZnSO4+Cu ② Cu+H2SO4 ③ Zn+AgNO3 ④ Ag+HCl ⑤ Al+ZnCl2 ⑥ Fe+Hg(NO3)2 ⑦ Cu+AgCl ⑧ Sn+HCl
思考
1、金属钠保存在哪种液体中?
煤油中
2、为什么要浸在煤油中?
极易被氧化
3、为什么不保存在水中?
钠会和水发生反应
实验1
从煤油中取一小块金属钠,用小刀切去一端的外皮,观察实验现象.
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
将金属钠放入水中,发现钠漂浮在水面上,并在水面四处“游走”发出“咝咝”的声音,片刻后熔成一个银白色小球,酚酞试液变红
实验2:把1块绿豆大小的金属钠放入1小杯滴有酚酞的水中。
注意:该实验反应剧烈,实验操作时要小心,避免沾到溅起的液体。
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
物理性质:密度比煤油大,比水小;
硬度小;银白色,熔点低。
化学性质:极易与氧气、水反应,且反应放出大量的热。
方程式:
2Na+H2O==2NaOH+H2 ↑
你知道还有哪些金属可以和水反应?
K、Ca、Ba
实验3:
把1块绿豆大小的金属钠放入1小杯硫酸铜溶液中。
方程式:
2Na+H2O==2NaOH+H2 ↑
现象:
产生气泡,溶液中出现蓝色沉淀,溶液逐渐由蓝色变为无色。
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
黑色固体产生
Cu(OH)2=CuO+H2O
归纳:金属与盐发生反应的条件
3、金属单质(K、Ca、Na、 Ba除外)
注意:特别活泼金属 K、Ca、Na、Ba与金属盐溶液反应时先与水反应生成碱和氢气,然后是碱与盐反应。
1、排在前面的金属可以把排在它后面的金属从其盐溶液中置换出来。 (简单说:前金置后金)
2、参加反应的盐必须是可溶性的盐溶液。
金属活动性的应用:
1、一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。
金属 + 可溶性的盐 = 金属 + 盐
2、排在氢前面的金属可以把酸里的氢置换出来,排在氢后面的金属不能。
金属 + 酸 = 盐 + 氢气
Zn + FeSO4 =
Zn + H2SO4 =
均指元素
1.根据金属活动性顺序表判断能否用锡壶装酸性物质, 并说出理由。
2.能否用铁制的容器配制浸种用的波尔多液 (含硫酸铜) ?为什么?
不能,因为锡在氢之前能跟酸反应。
Sn + 2HCl = SnCl2 + H2↑
不能,铁能跟波尔多液反应。
Fe + CuSO4 = FeSO4 + Cu
阅读:化学反应中的电子转移(课本p45)
思考:为什么铜离子会从溶液中析出变成金属铜,而金属锌则变成锌离子进入溶液?
在上述的化学反应中,金属锌失去电子变成锌离子进入溶液,而铜离子从金属锌表面得到了电子变成了金属铜,上述反应的过程实际上是电子转移的过程。
Zn + CuSO4 = Zn SO4 + Cu
2e
练习与活动
1、设计实验除去杂质:?铜粉中含有的少量铁粉;?FeCl2溶液中含有的少量CuCl2 。
a1.加入过量稀盐酸,过滤得滤渣,用水冲洗烘干。
b.加入过量铁粉,过滤得滤液
a2.加入过量氯化铜溶液,过滤得滤渣
a3.用磁铁吸引除去铁粉
化工颜料商店出售的涂料添加剂“银粉”是什么金属,通过实验做出初步分析和判断,并提交调查分析报告。
调查
“银粉”是铝粉。将“银粉”放入稀硫酸中,有气泡产生。
小 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀HCl或稀H2SO4反应
(3)部分金属能与盐溶液反应
2、判断常见金属活泼性的方法
(1)金属与酸反应的剧烈程度
(2)金属与能否与盐溶液反应
(3)金属与氧气反应的难易程度
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
