化学反应与能量
图片预览






文档简介
(共24张PPT)
南京市天印高级中学
高一化学备课组 李道武
本章知识体系
2.利用化学反应中产生的能量.
人类利用化学反应的目的:
1.获取新的物质
如热能、电能、光能等
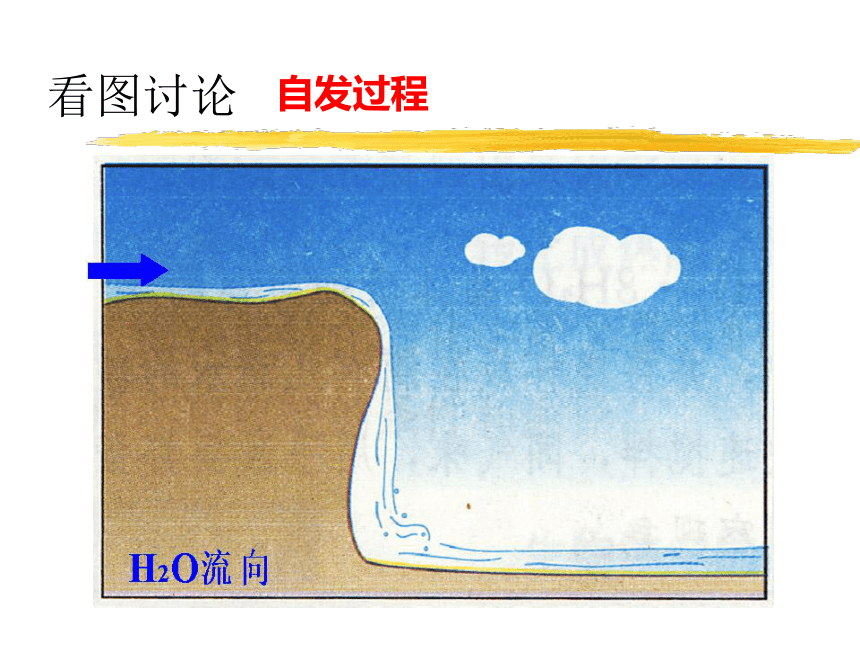
看图讨论
自发过程
化学反应
放出能量
【小资料】化学能
化学能是物体发生化学反应时所释放的能量,是一种很隐蔽的能量,它不能直接用来做功,只有在发生化学变化的时候才释放出来,变成热能或者其他形式的能量。像石油和煤的燃烧,炸药爆炸以及人吃的食物在体内发生化学变化时候所放出的能量,都属于化学能。
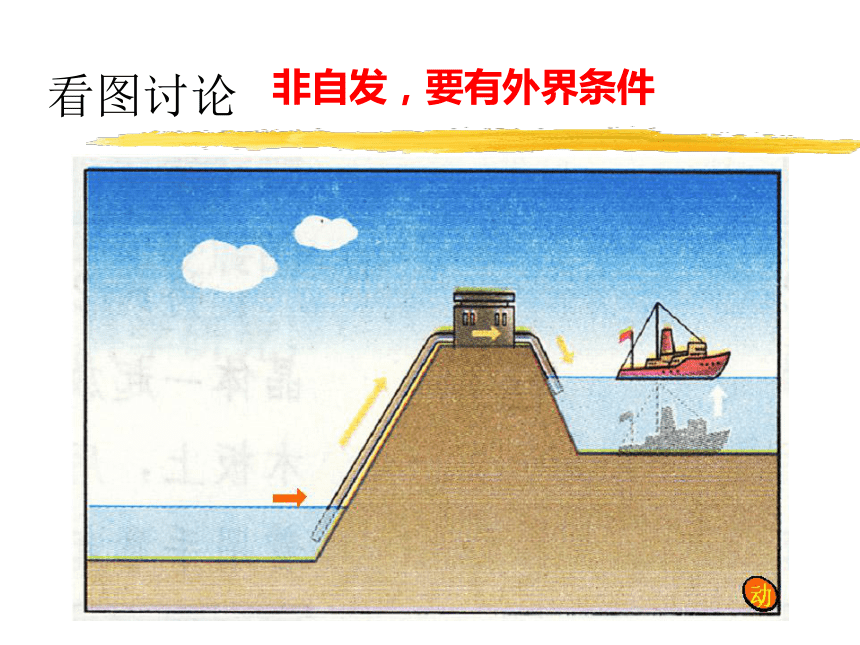
看图讨论
非自发,要有外界条件
化学反应
吸收能量
能量
反应过程
反应过程
反应物
生成物
能量
放出能 量
吸收能 量
反应物
生成物
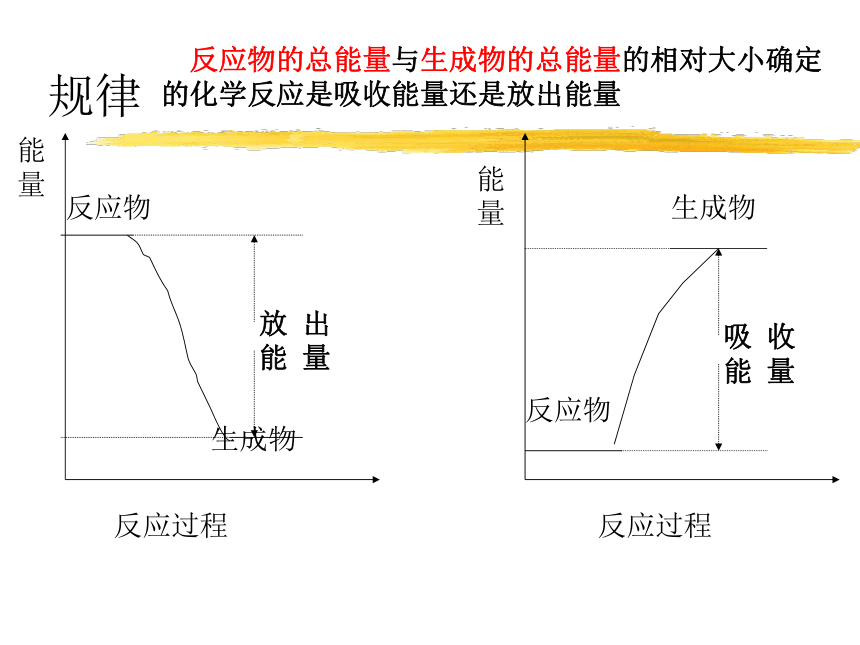
规律
反应物的总能量与生成物的总能量的相对大小确定的化学反应是吸收能量还是放出能量
【练习】已知反应2H2+O2=2H2O该反应放出能量,下列说法中正确的是 ( )
A 产物H2O的总能量高于反应物H2和O2的总能量
B反应物H2和O2的总能量等于产物H2O的总能量
C反应物H2和O2的总能量高于产物H2O的总能量
D反应物H2和O2的能量相等
C
二、化学能与热能的相互转化
(二)化学反应中的能量变化
通常主要表现为热量的变化。
1.质量守恒定律
2.能量守恒定律:P33页
(一)两个基本自然定律
1. 吸热反应
2.放热反应
遵守
(三)常见的放热反应和吸热反应(练习册P31页)
放热反应
燃烧反应
中和反 应
金属与酸或水的反应
大多数化合反应
物质的缓慢氧化
吸热反应
Ba(OH)2.8H2O+NH4Cl
大部分分解反应
C+CO2
以C、H2、CO为还原剂的氧化还原反应
记忆
【练习1】已知反应A+B=C+D为放热反应,对该反应的下 列说法中正确的是 ( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定能发生
C
2.下列说法不正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
C
3. 下列物质加入水中是放热反应是 ( )
A.生石灰 B.酒精
C.固体NaCl D.固体NaOH
4. 下列反应中既属于氧化还原反应同时又是吸热反应的是 ( )
A.Ba(OH)2 · 8H2O与NH4Cl反应
B.镁与稀盐酸 C.灼热的炭与CO2
D.甲烷与O2反应
A
C
5. 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”) 镁片和盐酸的总能量.
用化学键的观点来分析化学反应的本质过程是什么?
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
由氢原子形成1molH-H,需要_____(填吸收或放出)436KJ能量,断开1molH-H,需要_____(填吸收或放出)436KJ能量。
吸收
放出
1 molCH4中含有 C-H键,断开1 molC—H键要吸收415KJ的能量,断开1 molCH4中所有C-H键则要吸收 KJ的能量。形成1mol则要放出 KJ的能量。
1.化学反应中能量变化的主要原因
化学键的断裂和形成
2摩H2和1摩O2生成2摩H2O的能量变化?
(已知断开1molH-H键需要吸收是436KJ能量,断开1mol O-O键需要吸收是496KJ能量,断开1molH-O键需要吸收是463KJ能量)
计算:
【小结】
(1)断开化学键吸收的能量>形成化学键放出的能量————则化学反应__________能量
吸收
(2)断开化学键吸收的能量<形成化学键放出的能量————则化学反应__________能量
放出
(四)化学能与热能转化的应用
利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
如:
科学视野
1、生物体中的能量转化
柴草时期。
化石燃料时期
多能源结构时期
2、人类利用能源的三个阶段
小结
能量变化
化学能转化为热能
放热反应
吸热反应
类型
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
遵循能量守恒原理
能量利用
燃料充分燃烧
新能源的开发
减少污染
南京市天印高级中学
高一化学备课组 李道武
本章知识体系
2.利用化学反应中产生的能量.
人类利用化学反应的目的:
1.获取新的物质
如热能、电能、光能等
看图讨论
自发过程
化学反应
放出能量
【小资料】化学能
化学能是物体发生化学反应时所释放的能量,是一种很隐蔽的能量,它不能直接用来做功,只有在发生化学变化的时候才释放出来,变成热能或者其他形式的能量。像石油和煤的燃烧,炸药爆炸以及人吃的食物在体内发生化学变化时候所放出的能量,都属于化学能。
看图讨论
非自发,要有外界条件
化学反应
吸收能量
能量
反应过程
反应过程
反应物
生成物
能量
放出能 量
吸收能 量
反应物
生成物
规律
反应物的总能量与生成物的总能量的相对大小确定的化学反应是吸收能量还是放出能量
【练习】已知反应2H2+O2=2H2O该反应放出能量,下列说法中正确的是 ( )
A 产物H2O的总能量高于反应物H2和O2的总能量
B反应物H2和O2的总能量等于产物H2O的总能量
C反应物H2和O2的总能量高于产物H2O的总能量
D反应物H2和O2的能量相等
C
二、化学能与热能的相互转化
(二)化学反应中的能量变化
通常主要表现为热量的变化。
1.质量守恒定律
2.能量守恒定律:P33页
(一)两个基本自然定律
1. 吸热反应
2.放热反应
遵守
(三)常见的放热反应和吸热反应(练习册P31页)
放热反应
燃烧反应
中和反 应
金属与酸或水的反应
大多数化合反应
物质的缓慢氧化
吸热反应
Ba(OH)2.8H2O+NH4Cl
大部分分解反应
C+CO2
以C、H2、CO为还原剂的氧化还原反应
记忆
【练习1】已知反应A+B=C+D为放热反应,对该反应的下 列说法中正确的是 ( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定能发生
C
2.下列说法不正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.物质燃烧和中和反应均放出热量
C.分解反应肯定是吸热反应
D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量
C
3. 下列物质加入水中是放热反应是 ( )
A.生石灰 B.酒精
C.固体NaCl D.固体NaOH
4. 下列反应中既属于氧化还原反应同时又是吸热反应的是 ( )
A.Ba(OH)2 · 8H2O与NH4Cl反应
B.镁与稀盐酸 C.灼热的炭与CO2
D.甲烷与O2反应
A
C
5. 如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”、“小于”、“等于”) 镁片和盐酸的总能量.
用化学键的观点来分析化学反应的本质过程是什么?
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
由氢原子形成1molH-H,需要_____(填吸收或放出)436KJ能量,断开1molH-H,需要_____(填吸收或放出)436KJ能量。
吸收
放出
1 molCH4中含有 C-H键,断开1 molC—H键要吸收415KJ的能量,断开1 molCH4中所有C-H键则要吸收 KJ的能量。形成1mol则要放出 KJ的能量。
1.化学反应中能量变化的主要原因
化学键的断裂和形成
2摩H2和1摩O2生成2摩H2O的能量变化?
(已知断开1molH-H键需要吸收是436KJ能量,断开1mol O-O键需要吸收是496KJ能量,断开1molH-O键需要吸收是463KJ能量)
计算:
【小结】
(1)断开化学键吸收的能量>形成化学键放出的能量————则化学反应__________能量
吸收
(2)断开化学键吸收的能量<形成化学键放出的能量————则化学反应__________能量
放出
(四)化学能与热能转化的应用
利用热量进行生活、生产和科研。
利用热能使很多化学反应得以发生。
如:
科学视野
1、生物体中的能量转化
柴草时期。
化石燃料时期
多能源结构时期
2、人类利用能源的三个阶段
小结
能量变化
化学能转化为热能
放热反应
吸热反应
类型
反应物的总能量大于生成物的总能量
反应物的总能量小于生成物的总能量
遵循能量守恒原理
能量利用
燃料充分燃烧
新能源的开发
减少污染
