物质结构和元素周期律
图片预览





文档简介
(共21张PPT)
第一章 物质结构和元素周期律
单元复习
南京市天印高级中学 高一化学备课组
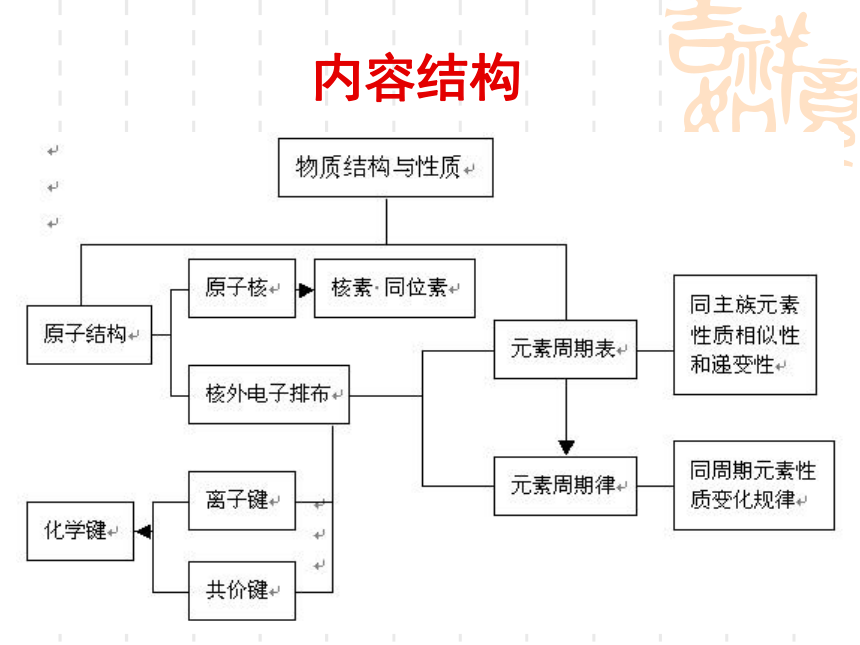
内容结构
一、原子结构
1.原子的构成
原子核
核外电子 Z个
质子 Z个
中子 (A- Z)个
(2)原子中:原子序数=核电荷数=质子数=核外电子数
(1)质子数(Z)+中子数(N)=质量数(A)
2.两个关系
【练习1】某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是 ( )
A. B.
C. D.
A+m
(A-N+m)mol
a
a
A
(A-N)mol
a
A+m
(A-N)mol
a
A
(A-N+m)mol
A
3.核素和同位素
核素:把具有一定数目质子和一定数目中子的一种原子称为核素。如
同位素:具有相同数目质子和不同数目中子的同一元素的不同核素互称为同位素。如
【练习2】下列说法错误的是 ( )
A.H、D、T、H+和H2是氢元素的五种不同粒子
B.石墨和金刚石互为同位素,化学性质相似
C.H和D是两种不同的核素
D. 12C和13C互为同位素,物理性质不同,但化学性质几乎完全相同
B
4.核外电子排布
(1).排布规律
① 电子总是尽先排布在能量最低的电子层里。
② 每个电子层最多只能排布2n2个电子。
③ 最外层最多只能容纳8个电子,K层为最外层 时,最多只能容纳2个电子。
④ 次外层最多不超过18个电子,倒数第三层不超过32个电子。
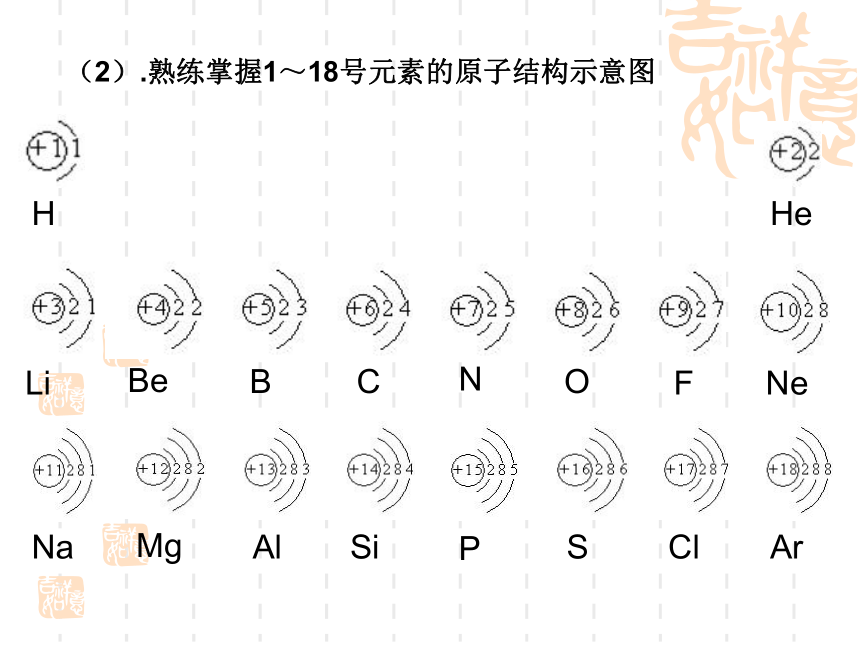
(2).熟练掌握1~18号元素的原子结构示意图
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
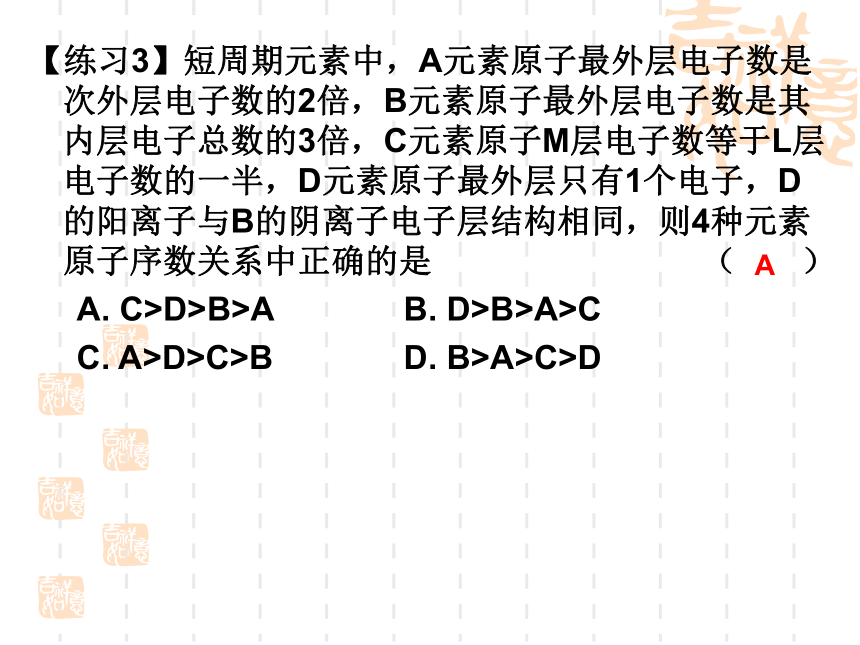
【练习3】短周期元素中,A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数是其内层电子总数的3倍,C元素原子M层电子数等于L层电子数的一半,D元素原子最外层只有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是 ( )
A. C>D>B>A B. D>B>A>C
C. A>D>C>B D. B>A>C>D
A
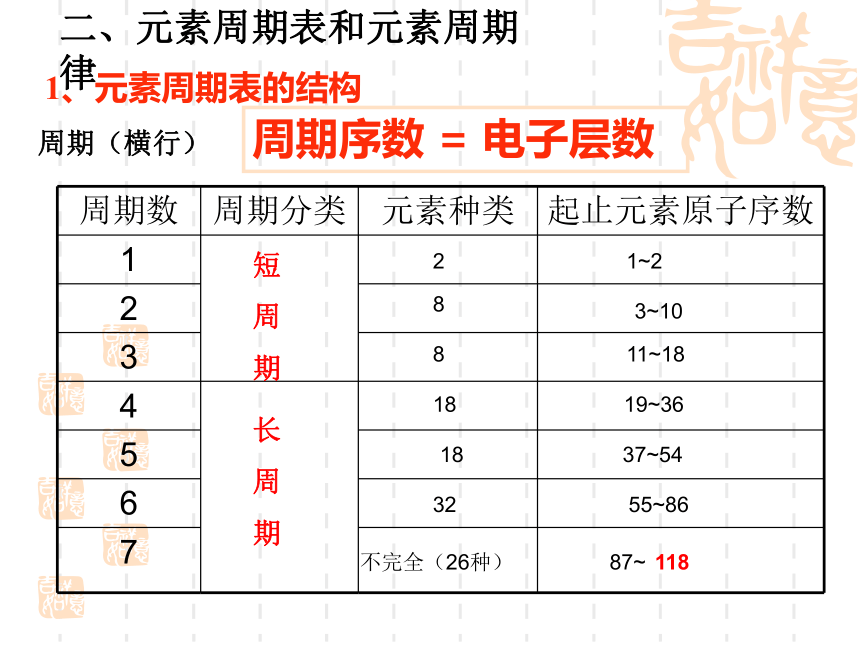
1、元素周期表的结构
周期序数 = 电子层数
二、元素周期表和元素周期律
周期数 周期分类 元素种类 起止元素原子序数
1
2
3
4
5
6
7
周期(横行)
短
周
期
长
周
期
2
1~2
8
3~10
8
11~18
18
19~36
18
37~54
32
55~86
不完全(26种)
87~
118
主族序数=最外层电子数(价电子)=最高正价
族
主族
副族
(7个)
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
(7个)
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB 、 ⅠB、ⅡB
第Ⅷ族
零族
(纵向)
包括8、9、10三个纵行
指稀有气体
纵行 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
族
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
【练习】
2.同周期ⅡA和ⅢA原子序数相差可能的数据是____或_____或_____.
1
11
25
3.同主族相邻周期元素原子序数相差可能的数据是____或_____或_____或_____.
2
8
18
32
【提升题】A、B为相邻周期的同族元素(A在上一周期),A的原子序数为x,A和B所在周期包含的元素种类分别为m种和n种。
(1)如果A和B同在ⅠA族,B的原子序数为_____________。
(2)如果A和B同在ⅦA族,B的原子序数为_____________。
1. ____族所含的元素种类最多
ⅢB
X+m
X+n
2.元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律。
1. 随着原子序数的递增,元素原子最外层电子排布、原子半径、元素的化合价呈周期性变化。
3.元素周期律的实质:元素原子的____________随着原子序数的递增而呈周期性变化。
2、元素周期律
核外电子排布
3 元素周期表的应用
(一)元素原子得失电子能力强弱的判断方法
1.原子失电子能力(金属性)的相对强弱判断方法
(1)金属单质与水或酸反应置换出H2的难易
(2)金属最高价氧化物对应的水化物碱性强弱
2.原子得电子能力(非金属性)的相对强弱判断方法
(1)非金属单质与H2化合的难易及气态氢化物的稳定性
(2)最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
(二)同周期元素性质的递变性
Na Mg Al Si P S Cl
核电荷数依次增多
原子半径依次减小
原子核对外层电子的吸引能力依次增强
原子失电子能力依次减弱
原子得电子能力依次增强
元素金属性依次减弱
元素非金属性依次增强
记忆方法:(金属性)前大
(三)同主族元素性质的变化规律
记忆方法:(金属性)下大
Li
Na
K
Rb
Cs
F
Cl
Br
I
ⅠA
ⅦA
核电荷数依次增多
原子半径依次增大
原子核对外层电子的吸引能力依次减小
原子失电子能力依次增强
原子得电子能力依次减弱
元素金属性依次增强
元素非金属性依次减弱
电子层数依次增多
【练习】
1.关于铯及其化合物的以下各说法中不正确的是( )
A、氢氧化铯是一种强碱,比KOH的碱性强
B、铯与水或酸溶液反应剧烈,都生成氢气
C、铯的还原性比钠强,故铯可置换出氯化钠溶液中的钠
D、无水硫酸铯的化学式为Cs2SO4
C
2.下列排序错误的是 ( )
A 离子半径:S2->Cl->K+>Ca2+
B 热稳定性:HI<HBr<HCl<HF
C 最高正化合价:C<N<O<F
D 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH
C
原子结构
表中位置
元素性质
原子序数= 核电荷数
周期数= 电子层数
主族序数=最外层电子数
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数 = 最高正价
最外层电子数-8 = 负价
4.位、构、性三者的关系
【练习】
1.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是 ( )
A 离子的还原性: Y2->Z- B 质子数:c>b
C 氢化物的稳定性:H2Y>HZ D 原子半径:X<W
A
2.根据元素周期律对角线规律,金属Be和Al单质及其化合物的性质相似。试回答下列问题
(1)Be和NaOH溶液反应有Na2BeO2生成,其反应的离子方程式为______________________________
(2)Be(OH)2和Mg(OH)2可用___________溶液鉴别
(3)Li和Mg根据对角线规律,性质也相似,则Li在空气中燃烧。主要产物的化学式为___________
(4)Li2CO3加热时_______(填能或不能)分解。
Be+2OH-=BeO2-+H2↑
NaOH
Li2O
能
三.化学键
1.化学键的分类
离子键
共价键
极性键
非极性键
A-B
A-A
3.化学反应的本质
(一)化学键
旧键的断裂和新键的形成过程
2.离子键和共价键的区别
离子键 共价键
成键微粒
成键元素
作用力
阴、阳离子
原子(间)
活泼的金属元素和活泼的非金属元素
非金属元素(同种或不同种)
静电作用
共用电子对
(二)电子式
1.电子式的书写
原子
离子
阳离子
阴离子
离子化合物(仅含离子键)
共价化合物或非金属单质
含共价键的离子化合物
NH4+
NaOH Na2O2 NH4Cl
HClO N2 H2O2CO2
2.用电子式表示物质的形成过程
(1)含离子键的化合物
(2)含共价键的化合物或单质
(三)结构式
OH-
【练习】
1.下列说法中正确的是 ( )
A.由非金属元素形成的化合物一定是共价化合物
B.共价键一定存在于共价化合物中
C.离子键一定存在于离子化合物中
D.HCl属于离子化合物
C
2.按下列要求填空(学序号填写)①MgCl2 、②NaOH、③Na2O2、④N2、⑤CO2、⑥H2O2、⑦NH4Cl、⑧HClO
(1)属于离子化合物且只含离子键的是______,属于离子化合物且含极性键的是______,属于离子化合物且含非极性键的是______,
(2)只含有极共价键的化合物的是______,只含共价键但不是共价化合物的是______,既含有非极键又含极性键化合物的是______。
①
②⑦
③
⑤⑧
④
⑥
第一章 物质结构和元素周期律
单元复习
南京市天印高级中学 高一化学备课组
内容结构
一、原子结构
1.原子的构成
原子核
核外电子 Z个
质子 Z个
中子 (A- Z)个
(2)原子中:原子序数=核电荷数=质子数=核外电子数
(1)质子数(Z)+中子数(N)=质量数(A)
2.两个关系
【练习1】某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子,在ag HmX中所含质子的物质的量是 ( )
A. B.
C. D.
A+m
(A-N+m)mol
a
a
A
(A-N)mol
a
A+m
(A-N)mol
a
A
(A-N+m)mol
A
3.核素和同位素
核素:把具有一定数目质子和一定数目中子的一种原子称为核素。如
同位素:具有相同数目质子和不同数目中子的同一元素的不同核素互称为同位素。如
【练习2】下列说法错误的是 ( )
A.H、D、T、H+和H2是氢元素的五种不同粒子
B.石墨和金刚石互为同位素,化学性质相似
C.H和D是两种不同的核素
D. 12C和13C互为同位素,物理性质不同,但化学性质几乎完全相同
B
4.核外电子排布
(1).排布规律
① 电子总是尽先排布在能量最低的电子层里。
② 每个电子层最多只能排布2n2个电子。
③ 最外层最多只能容纳8个电子,K层为最外层 时,最多只能容纳2个电子。
④ 次外层最多不超过18个电子,倒数第三层不超过32个电子。
(2).熟练掌握1~18号元素的原子结构示意图
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
【练习3】短周期元素中,A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数是其内层电子总数的3倍,C元素原子M层电子数等于L层电子数的一半,D元素原子最外层只有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素原子序数关系中正确的是 ( )
A. C>D>B>A B. D>B>A>C
C. A>D>C>B D. B>A>C>D
A
1、元素周期表的结构
周期序数 = 电子层数
二、元素周期表和元素周期律
周期数 周期分类 元素种类 起止元素原子序数
1
2
3
4
5
6
7
周期(横行)
短
周
期
长
周
期
2
1~2
8
3~10
8
11~18
18
19~36
18
37~54
32
55~86
不完全(26种)
87~
118
主族序数=最外层电子数(价电子)=最高正价
族
主族
副族
(7个)
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
(7个)
ⅢB、ⅣB、ⅤB、ⅥB、ⅦB 、 ⅠB、ⅡB
第Ⅷ族
零族
(纵向)
包括8、9、10三个纵行
指稀有气体
纵行 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
族
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
【练习】
2.同周期ⅡA和ⅢA原子序数相差可能的数据是____或_____或_____.
1
11
25
3.同主族相邻周期元素原子序数相差可能的数据是____或_____或_____或_____.
2
8
18
32
【提升题】A、B为相邻周期的同族元素(A在上一周期),A的原子序数为x,A和B所在周期包含的元素种类分别为m种和n种。
(1)如果A和B同在ⅠA族,B的原子序数为_____________。
(2)如果A和B同在ⅦA族,B的原子序数为_____________。
1. ____族所含的元素种类最多
ⅢB
X+m
X+n
2.元素的性质随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律。
1. 随着原子序数的递增,元素原子最外层电子排布、原子半径、元素的化合价呈周期性变化。
3.元素周期律的实质:元素原子的____________随着原子序数的递增而呈周期性变化。
2、元素周期律
核外电子排布
3 元素周期表的应用
(一)元素原子得失电子能力强弱的判断方法
1.原子失电子能力(金属性)的相对强弱判断方法
(1)金属单质与水或酸反应置换出H2的难易
(2)金属最高价氧化物对应的水化物碱性强弱
2.原子得电子能力(非金属性)的相对强弱判断方法
(1)非金属单质与H2化合的难易及气态氢化物的稳定性
(2)最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
(二)同周期元素性质的递变性
Na Mg Al Si P S Cl
核电荷数依次增多
原子半径依次减小
原子核对外层电子的吸引能力依次增强
原子失电子能力依次减弱
原子得电子能力依次增强
元素金属性依次减弱
元素非金属性依次增强
记忆方法:(金属性)前大
(三)同主族元素性质的变化规律
记忆方法:(金属性)下大
Li
Na
K
Rb
Cs
F
Cl
Br
I
ⅠA
ⅦA
核电荷数依次增多
原子半径依次增大
原子核对外层电子的吸引能力依次减小
原子失电子能力依次增强
原子得电子能力依次减弱
元素金属性依次增强
元素非金属性依次减弱
电子层数依次增多
【练习】
1.关于铯及其化合物的以下各说法中不正确的是( )
A、氢氧化铯是一种强碱,比KOH的碱性强
B、铯与水或酸溶液反应剧烈,都生成氢气
C、铯的还原性比钠强,故铯可置换出氯化钠溶液中的钠
D、无水硫酸铯的化学式为Cs2SO4
C
2.下列排序错误的是 ( )
A 离子半径:S2->Cl->K+>Ca2+
B 热稳定性:HI<HBr<HCl<HF
C 最高正化合价:C<N<O<F
D 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH
C
原子结构
表中位置
元素性质
原子序数= 核电荷数
周期数= 电子层数
主族序数=最外层电子数
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
(主族)最外层电子数 = 最高正价
最外层电子数-8 = 负价
4.位、构、性三者的关系
【练习】
1.已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是 ( )
A 离子的还原性: Y2->Z- B 质子数:c>b
C 氢化物的稳定性:H2Y>HZ D 原子半径:X<W
A
2.根据元素周期律对角线规律,金属Be和Al单质及其化合物的性质相似。试回答下列问题
(1)Be和NaOH溶液反应有Na2BeO2生成,其反应的离子方程式为______________________________
(2)Be(OH)2和Mg(OH)2可用___________溶液鉴别
(3)Li和Mg根据对角线规律,性质也相似,则Li在空气中燃烧。主要产物的化学式为___________
(4)Li2CO3加热时_______(填能或不能)分解。
Be+2OH-=BeO2-+H2↑
NaOH
Li2O
能
三.化学键
1.化学键的分类
离子键
共价键
极性键
非极性键
A-B
A-A
3.化学反应的本质
(一)化学键
旧键的断裂和新键的形成过程
2.离子键和共价键的区别
离子键 共价键
成键微粒
成键元素
作用力
阴、阳离子
原子(间)
活泼的金属元素和活泼的非金属元素
非金属元素(同种或不同种)
静电作用
共用电子对
(二)电子式
1.电子式的书写
原子
离子
阳离子
阴离子
离子化合物(仅含离子键)
共价化合物或非金属单质
含共价键的离子化合物
NH4+
NaOH Na2O2 NH4Cl
HClO N2 H2O2CO2
2.用电子式表示物质的形成过程
(1)含离子键的化合物
(2)含共价键的化合物或单质
(三)结构式
OH-
【练习】
1.下列说法中正确的是 ( )
A.由非金属元素形成的化合物一定是共价化合物
B.共价键一定存在于共价化合物中
C.离子键一定存在于离子化合物中
D.HCl属于离子化合物
C
2.按下列要求填空(学序号填写)①MgCl2 、②NaOH、③Na2O2、④N2、⑤CO2、⑥H2O2、⑦NH4Cl、⑧HClO
(1)属于离子化合物且只含离子键的是______,属于离子化合物且含极性键的是______,属于离子化合物且含非极性键的是______,
(2)只含有极共价键的化合物的是______,只含共价键但不是共价化合物的是______,既含有非极键又含极性键化合物的是______。
①
②⑦
③
⑤⑧
④
⑥
