氧化还原反应
图片预览



文档简介
(共20张PPT)
第三节 氧化还原反应
临沂一中高一化学组
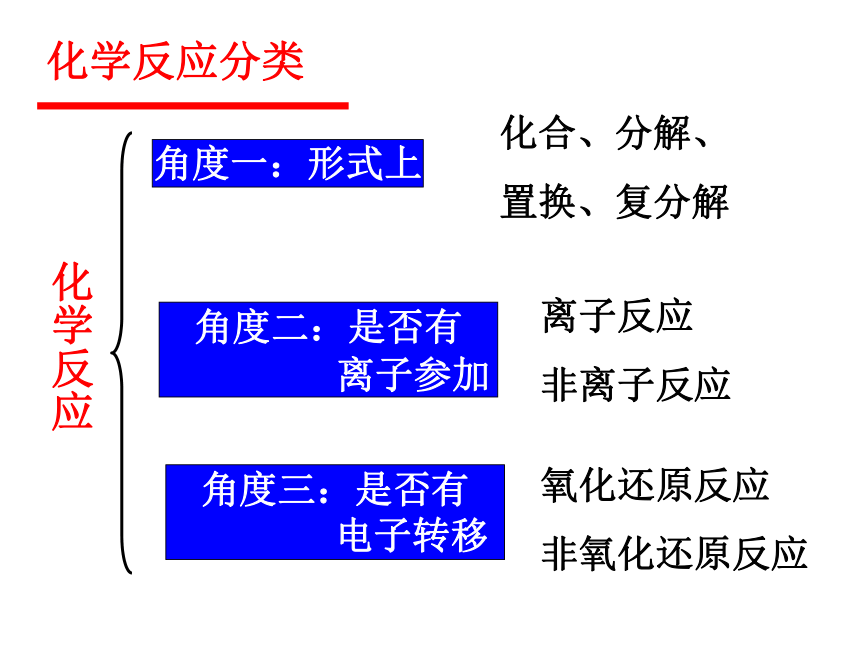
化学反应分类
化学反应
角度一:形式上
化合、分解、
置换、复分解
角度二:是否有
离子参加
离子反应
非离子反应
角度三:是否有
电子转移
氧化还原反应
非氧化还原反应
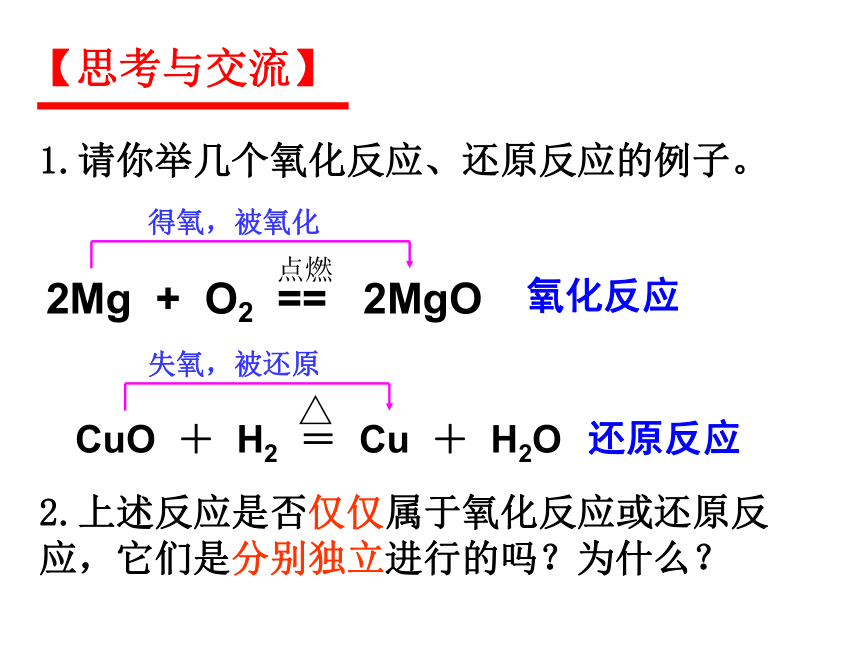
【思考与交流】
1.请你举几个氧化反应、还原反应的例子。
2Mg + O2 == 2MgO
点燃
氧化反应
得氧,被氧化
CuO + H2 = Cu + H2O
△
失氧,被还原
还原反应
2.上述反应是否仅仅属于氧化反应或还原反应,它们是分别独立进行的吗?为什么?
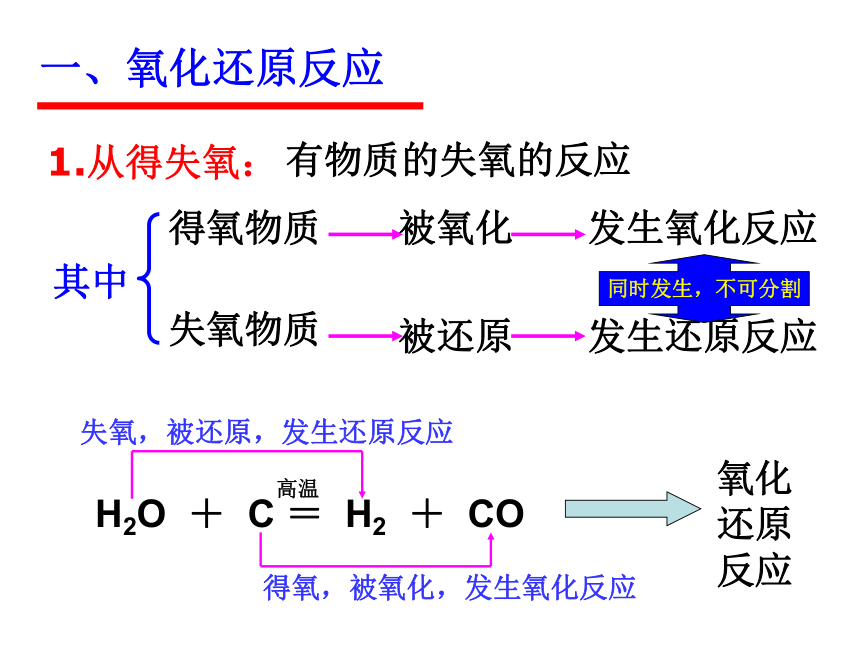
一、氧化还原反应
1.从得失氧:
有物质的失氧的反应
其中
得氧物质
被氧化
发生氧化反应
失氧物质
被还原
发生还原反应
同时发生,不可分割
失氧,被还原,发生还原反应
H2O + C = H2 + CO
高温
得氧,被氧化,发生氧化反应
氧化还原反应
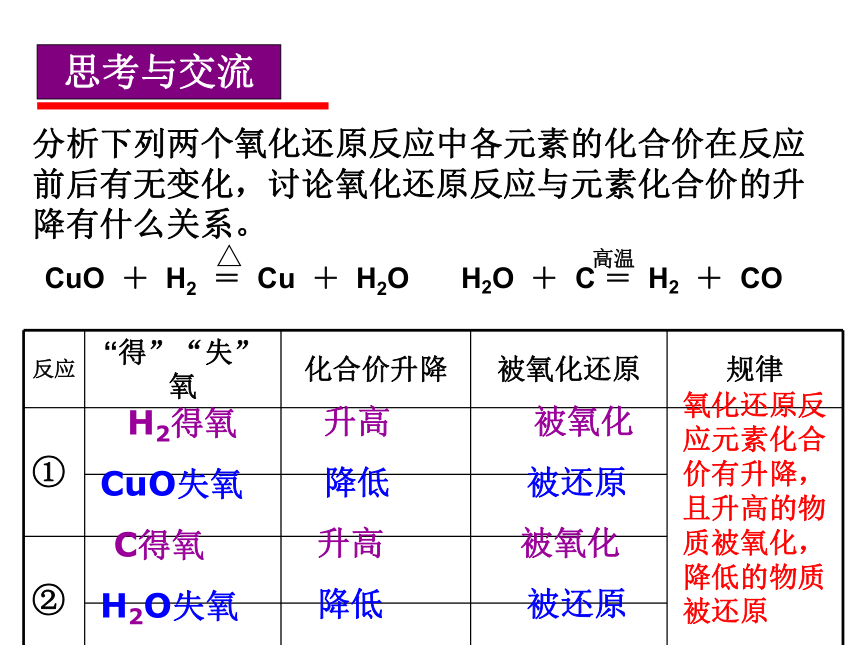
思考与交流
分析下列两个氧化还原反应中各元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。
H2O + C = H2 + CO
高温
CuO + H2 = Cu + H2O
△
反应 “得”“失”氧 化合价升降 被氧化还原 规律
①
②
H2得氧
升高
被氧化
CuO失氧
降低
升高
降低
被还原
被氧化
被还原
C得氧
H2O失氧
氧化还原反应元素化合价有升降,且升高的物质被氧化,降低的物质被还原
一、氧化还原反应
1.从得失氧:
有物质的失氧的反应
2.从化合价:
有化合价升降的反应
其中
化合价升高物质
被氧化
发生氧化反应
化合价降低物质
被还原
发生还原反应
同时发生,不可分割
判断:
2Na + Cl2 = 2NaCl
点燃
Fe2O3 + 3CO = 2Fe + 3CO2
高温
一、氧化还原反应
1.从得失氧:
有物质的失氧的反应
2.从化合价:
有化合价升降的反应
可见,从化合价升降角度不但包括有得氧失氧的
化学反应,也包括没有得氧失氧的但化合价有
升降的反应,扩大了概念的适用范围。
所以以后判断一个反应是否是氧化反应只要看该 反应中是否有元素化合价发生变化,只要化合价
发生变化就是氧化还原反应。也就是说化合价升降
是氧化还原反应的特征。
狭隘的
广义的
1.【练习】下列反应属于氧化还原反应的有
①2Na+Cl2 2NaCl
②CaCO3 CaO+CO2↑
③CH4+2O2 CO2+2H2O
④Cu(OH)2+H2SO4=CuSO4+2H2O
⑤2KMnO4 K2MnO4+MnO2+O2↑
点燃
点燃
△
△
√
√
√
小试牛刀:
2 . 在反应MnO2+4HCl = MnCl2+2H2O+Cl2↑中,
元素化合价升高,被 ,发生 反应;
元素化合价降低,被 ,发生 反应。
+4 -1 +2 0
Cl
氧化
氧化
Mn
还原
还原
小试牛刀:
D
电解
3.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl CaCl2 + CO2↑ + H2O
B. Na2O + H2O 2NaOH
C. 2H2O 2H2 + O2
2Fe(OH)3 Fe2O3 + 3H2O
思考与交流
化合价升降是氧化还原反应的特征,那么氧化还原反应其元素的化合价为什么会发生变化呢,本质原因是什么?(阅读P36页)
化合价变化本质原因的分析:以NaCl、和HCI形成为例
⑴2Na + Cl2 = 2NaCl
点燃
⑵H2 + Cl2 = 2HCl
点燃
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降原因之一
——电子的得失
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
0
0
+1
-1
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价的升降的原因
之二:
共用电子对的偏移
化合价变化本质原因
的分析:以HCl为例
0
0
+1-1
电子对偏离,化合价升高,被氧化
H2 + Cl2 2 H Cl
电子对偏向,化合价降低,被还原
一、氧化还原反应
1.从化合价(特征):
有化合价升降的反应
2.从电子转移(本质):
有电子转移(得失或电子对的偏移)的反应
被氧化
发生氧化反应
化合价
降低
被还原
发生还原反应
同时发生,不可分割
失去电子
化合价
升高
得到电子
本质
特征
思考与交流
既然氧化还原反应化合价之所以会变化其本质是因为电子转移,那么化合价升降数和得失电子数又有什么关系呢?(发散思维)
一、氧化还原反应
3:化合价升高数目=失去电子数
化合价降低数目=得到电子数
双线桥表示方法
(1)标明元素反应前后的化合价。
(2)箭头指向又反应物到生成物化合价变化的同种元素。
箭头上注明得失电子数目,被氧化被还原情况等
(3)注意a*be-与b*ae-区别。
(4)得失电子总数相等。
+2
0
0
+4
2CuO + C 2 Cu + CO2
高温
失去4e-,化合价升高,被氧化
得到2× 2e-,化合价降低,被还原
双线桥
+4 -1 +2 0
价升高 失2×e- 被氧化
价降低 得2e- 被还原
分析:
△
MnO2+4HCl=MnCl2+Cl2↑+2H2O
3S + 4HNO3 = 3SO2 +4NO +2H2O
0 +5 +4 +2
价降低 得4×3e- 被还原
价升高 失3×4e- 被氧化
分析说明参加反应的4分子HCl中,只有2分子HCl被氧化.
注意
一、氧化还原反应
单线桥
氧化还原反应的变化过程还可用单线桥表示,箭头直接由反应物失去电子的元素指向反应物得到电子的元素,并在单箭头上注明转移电子的数目。
4e-
高温
2CuO + C 2 Cu + CO2
课堂练习1
课堂练习
用双线桥表示:
失去2×3e-
2 Fe + 3 Cl2 = 2 FeCl3
得到3×2e-
0
+3
0
-1
0
+3
0
-1
2 Fe + 3 Cl2 = 2 FeCl3
2×3e- (或 6e-)
用单线桥表示:
课堂练习2
课堂练习
用双线桥表示:
得到2×6e-
用单线桥表示:
12e-
+5 -2
-1
0
2 KClO3 = 2 KCl +3 O2
+5 -2
-1
0
2 KClO3 = 2 KCl +3 O2
失去2×3×2e-
第三节 氧化还原反应
临沂一中高一化学组
化学反应分类
化学反应
角度一:形式上
化合、分解、
置换、复分解
角度二:是否有
离子参加
离子反应
非离子反应
角度三:是否有
电子转移
氧化还原反应
非氧化还原反应
【思考与交流】
1.请你举几个氧化反应、还原反应的例子。
2Mg + O2 == 2MgO
点燃
氧化反应
得氧,被氧化
CuO + H2 = Cu + H2O
△
失氧,被还原
还原反应
2.上述反应是否仅仅属于氧化反应或还原反应,它们是分别独立进行的吗?为什么?
一、氧化还原反应
1.从得失氧:
有物质的失氧的反应
其中
得氧物质
被氧化
发生氧化反应
失氧物质
被还原
发生还原反应
同时发生,不可分割
失氧,被还原,发生还原反应
H2O + C = H2 + CO
高温
得氧,被氧化,发生氧化反应
氧化还原反应
思考与交流
分析下列两个氧化还原反应中各元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价的升降有什么关系。
H2O + C = H2 + CO
高温
CuO + H2 = Cu + H2O
△
反应 “得”“失”氧 化合价升降 被氧化还原 规律
①
②
H2得氧
升高
被氧化
CuO失氧
降低
升高
降低
被还原
被氧化
被还原
C得氧
H2O失氧
氧化还原反应元素化合价有升降,且升高的物质被氧化,降低的物质被还原
一、氧化还原反应
1.从得失氧:
有物质的失氧的反应
2.从化合价:
有化合价升降的反应
其中
化合价升高物质
被氧化
发生氧化反应
化合价降低物质
被还原
发生还原反应
同时发生,不可分割
判断:
2Na + Cl2 = 2NaCl
点燃
Fe2O3 + 3CO = 2Fe + 3CO2
高温
一、氧化还原反应
1.从得失氧:
有物质的失氧的反应
2.从化合价:
有化合价升降的反应
可见,从化合价升降角度不但包括有得氧失氧的
化学反应,也包括没有得氧失氧的但化合价有
升降的反应,扩大了概念的适用范围。
所以以后判断一个反应是否是氧化反应只要看该 反应中是否有元素化合价发生变化,只要化合价
发生变化就是氧化还原反应。也就是说化合价升降
是氧化还原反应的特征。
狭隘的
广义的
1.【练习】下列反应属于氧化还原反应的有
①2Na+Cl2 2NaCl
②CaCO3 CaO+CO2↑
③CH4+2O2 CO2+2H2O
④Cu(OH)2+H2SO4=CuSO4+2H2O
⑤2KMnO4 K2MnO4+MnO2+O2↑
点燃
点燃
△
△
√
√
√
小试牛刀:
2 . 在反应MnO2+4HCl = MnCl2+2H2O+Cl2↑中,
元素化合价升高,被 ,发生 反应;
元素化合价降低,被 ,发生 反应。
+4 -1 +2 0
Cl
氧化
氧化
Mn
还原
还原
小试牛刀:
D
电解
3.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl CaCl2 + CO2↑ + H2O
B. Na2O + H2O 2NaOH
C. 2H2O 2H2 + O2
2Fe(OH)3 Fe2O3 + 3H2O
思考与交流
化合价升降是氧化还原反应的特征,那么氧化还原反应其元素的化合价为什么会发生变化呢,本质原因是什么?(阅读P36页)
化合价变化本质原因的分析:以NaCl、和HCI形成为例
⑴2Na + Cl2 = 2NaCl
点燃
⑵H2 + Cl2 = 2HCl
点燃
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降原因之一
——电子的得失
失e-,化合价升高,被氧化
得e-,化合价降低,被还原
0
0
+1
-1
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价的升降的原因
之二:
共用电子对的偏移
化合价变化本质原因
的分析:以HCl为例
0
0
+1-1
电子对偏离,化合价升高,被氧化
H2 + Cl2 2 H Cl
电子对偏向,化合价降低,被还原
一、氧化还原反应
1.从化合价(特征):
有化合价升降的反应
2.从电子转移(本质):
有电子转移(得失或电子对的偏移)的反应
被氧化
发生氧化反应
化合价
降低
被还原
发生还原反应
同时发生,不可分割
失去电子
化合价
升高
得到电子
本质
特征
思考与交流
既然氧化还原反应化合价之所以会变化其本质是因为电子转移,那么化合价升降数和得失电子数又有什么关系呢?(发散思维)
一、氧化还原反应
3:化合价升高数目=失去电子数
化合价降低数目=得到电子数
双线桥表示方法
(1)标明元素反应前后的化合价。
(2)箭头指向又反应物到生成物化合价变化的同种元素。
箭头上注明得失电子数目,被氧化被还原情况等
(3)注意a*be-与b*ae-区别。
(4)得失电子总数相等。
+2
0
0
+4
2CuO + C 2 Cu + CO2
高温
失去4e-,化合价升高,被氧化
得到2× 2e-,化合价降低,被还原
双线桥
+4 -1 +2 0
价升高 失2×e- 被氧化
价降低 得2e- 被还原
分析:
△
MnO2+4HCl=MnCl2+Cl2↑+2H2O
3S + 4HNO3 = 3SO2 +4NO +2H2O
0 +5 +4 +2
价降低 得4×3e- 被还原
价升高 失3×4e- 被氧化
分析说明参加反应的4分子HCl中,只有2分子HCl被氧化.
注意
一、氧化还原反应
单线桥
氧化还原反应的变化过程还可用单线桥表示,箭头直接由反应物失去电子的元素指向反应物得到电子的元素,并在单箭头上注明转移电子的数目。
4e-
高温
2CuO + C 2 Cu + CO2
课堂练习1
课堂练习
用双线桥表示:
失去2×3e-
2 Fe + 3 Cl2 = 2 FeCl3
得到3×2e-
0
+3
0
-1
0
+3
0
-1
2 Fe + 3 Cl2 = 2 FeCl3
2×3e- (或 6e-)
用单线桥表示:
课堂练习2
课堂练习
用双线桥表示:
得到2×6e-
用单线桥表示:
12e-
+5 -2
-1
0
2 KClO3 = 2 KCl +3 O2
+5 -2
-1
0
2 KClO3 = 2 KCl +3 O2
失去2×3×2e-
