物质的分类
图片预览






文档简介
(共26张PPT)
第一节 物质的分类
图书馆
网络中的信息分类
一、简单分类法及其应用
1.单一分类法:将物质按一种标准进行分类的方法
2.交叉分类法:同一事物以不同标准进行分类
3.树状分类法:对同类事物进行再分类的方法
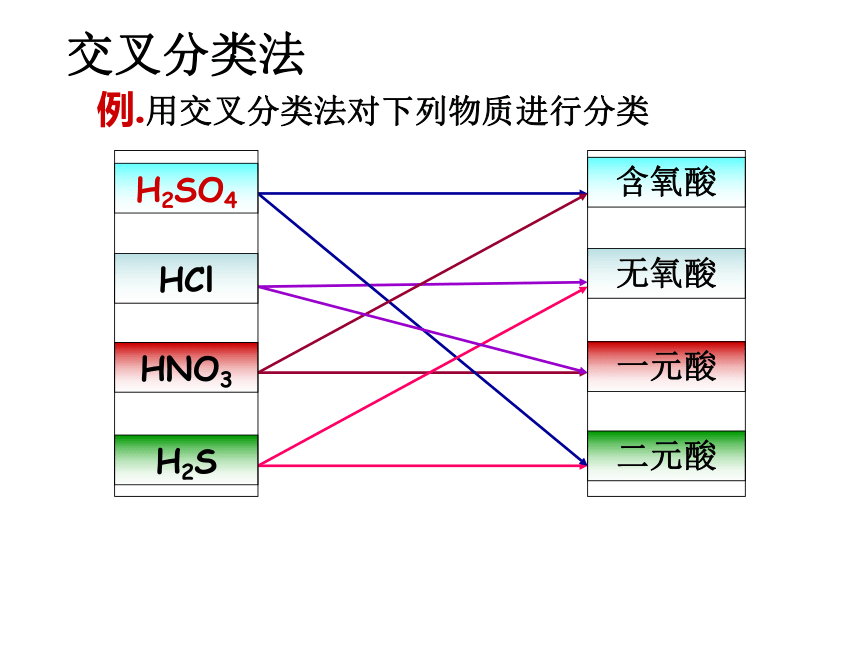
例.用交叉分类法对下列物质进行分类
交叉分类法
H2SO4
HCl
HNO3
H2S
含氧酸
无氧酸
一元酸
二元酸
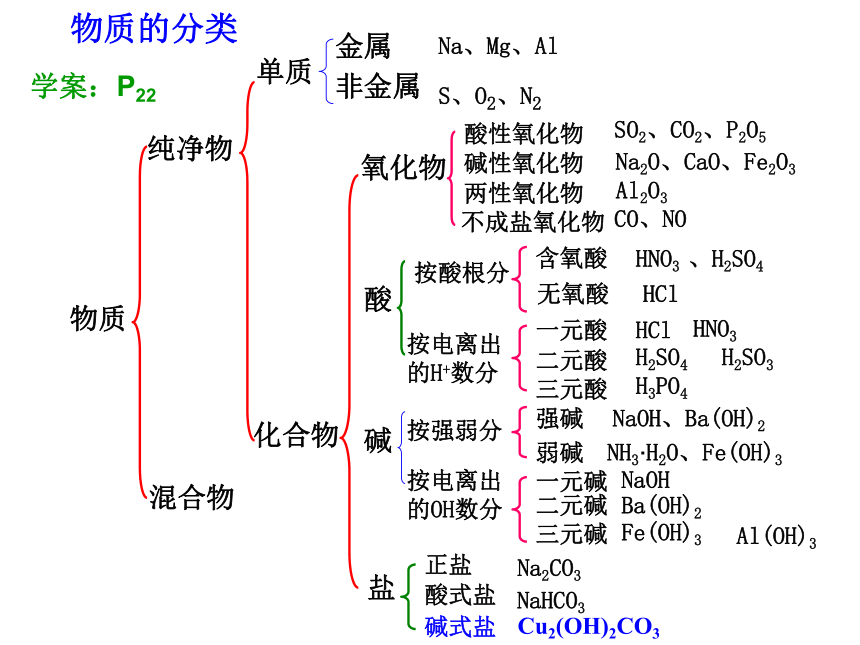
物质的分类
物质
纯净物
混合物
单质
化合物
金属
非金属
Na、Mg、Al
S、O2、N2
氧化物
酸
碱
盐
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
Al2O3
CO、NO
按酸根分
含氧酸
无氧酸
HNO3 、H2SO4
HCl
按电离出
的H+数分
一元酸
二元酸
三元酸
HCl
HNO3
H2SO4
H2SO3
H3PO4
按强弱分
强碱
弱碱
NaOH、Ba(OH)2
NH3·H2O、Fe(OH)3
按电离出
的OH数分
一元碱
二元碱
三元碱
NaOH
Ba(OH)2
Fe(OH)3
正盐
酸式盐
碱式盐
Na2CO3
NaHCO3
Cu2(OH)2CO3
Al(OH)3
学案:P22
练习:学案P22
练习1——练习5
【思考与交流】
★氯化钠溶液是怎么得到的?
★泥水浊液是怎么得到的?
氯化钠固体分散在水中形成的混合体系
泥分散在水中所形成的混合体系
二、分散系及其分类
1.分散系:
把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系
分散质:被分散的物质
分散剂:容纳分散质的物质
(量少)
(量多)
根据分散质或分散剂所处的状态(气态、液态、固态),分散系可分为哪几种?
二、分散系及其分类
根据分散质与分散剂状态
分散质
分散剂
气 态
液 态
固 态
固 态
液 态
气 态
9种
固
实 例
空气
云、雾
烟、灰尘
泡沫
牛奶、酒精的水溶液
糖水、油漆
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
固
固
液
固
气
液
固
液
液
液
气
气
固
气
液
气
气
分散剂
分散质
思考与交流:请试着举出几种分散系的实例
2、分散系分类
当分散剂是液体时,按分散质粒子大小
分散质粒子大小 所属分散系 外观现象
d<1nm
1nm<d<100nm
d>100nm
溶液
浊液
胶体
均匀、透明、稳定
不均匀、不透明、不稳定
均匀、透明、介稳定
★胶体本质特征:
分散质粒子直径位于1~100nm的分散系
思考:溶液、胶体、浊液的本质区别是什么?
3、胶体
(1)胶体制备
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
★注意: ②加热至溶液呈红褐色后停止加热
★注意:④不用“↓”,写胶体
★注意: ③不能用自来水,也不能搅拌
★注意:①沸水、饱和FeCl3溶液
硫酸铜溶液
无光亮的“通路”
有光亮的”通路“
氢氧化铁胶体
丁达尔效应
这条光亮的“通路”是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,叫做丁达尔效应。
粒子小,全透射
溶液
粒子较大,散射
胶体
粒子很大,全反射
浊液
2、胶体性质——丁达尔效应
区分胶体和溶液
应用:
(胶体特有的性质)
夜晚用手电筒照射夜空
放电影时,放映室射到银幕上的光柱
光线
透过树叶间
的缝隙射入
密林中
?空气也是胶体吗
是的。叫气溶胶
讨论:
如果没有丁达尔效应我们的生活将会将会怎样?
常见的胶体:
烟、云、雾,血液、豆浆、果冻、米粥汤、蛋清、墨水、肥皂水、有色玻璃、土壤胶体、蛋白质、淀粉溶液
将Fe(OH)3胶体和泥水分别进行过滤
没得到滤渣,滤液还是红褐色。
在滤纸上得到泥沙,滤液
澄清、透明。
过滤后的现象
Fe(OH)3胶体
泥水
科学探究
结论:胶体可以透过滤纸,浊液不可以透过滤纸
分散系
举例
均一
透明
盐水、
酒精的水溶液
<1nm
1~100nm
均一
透明
豆浆
能
>100nm
不均一
不透明
不能
泥水
溶液
胶体
浊液
分散质粒子大小
外观
能否透过滤纸
能
稳定性
稳定
较稳定
不稳定
小结:
能力拓展
1. “纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B. ②③④
C.②③⑤ D. ①③④⑥
B
练习:
学案:P24 练习6
P25 4、9、10、12
知识拓展:
胶体的净化方法——渗析法
将胶体放入半透膜袋里,再将此袋放入水中,胶体粒子不能透过半透膜,而分 子,离子可以通过半透膜,从而使杂质分子或离子进入水中而除去。
半透膜如动物肠衣、鸡蛋克膜,羊皮纸、胶棉薄膜、玻璃纸等)。
渗析
渗析
分离胶体和溶液
胶体的性质——
更多胶体的性质请大家阅读学案P25了解
第一节 物质的分类
图书馆
网络中的信息分类
一、简单分类法及其应用
1.单一分类法:将物质按一种标准进行分类的方法
2.交叉分类法:同一事物以不同标准进行分类
3.树状分类法:对同类事物进行再分类的方法
例.用交叉分类法对下列物质进行分类
交叉分类法
H2SO4
HCl
HNO3
H2S
含氧酸
无氧酸
一元酸
二元酸
物质的分类
物质
纯净物
混合物
单质
化合物
金属
非金属
Na、Mg、Al
S、O2、N2
氧化物
酸
碱
盐
酸性氧化物
碱性氧化物
两性氧化物
不成盐氧化物
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
Al2O3
CO、NO
按酸根分
含氧酸
无氧酸
HNO3 、H2SO4
HCl
按电离出
的H+数分
一元酸
二元酸
三元酸
HCl
HNO3
H2SO4
H2SO3
H3PO4
按强弱分
强碱
弱碱
NaOH、Ba(OH)2
NH3·H2O、Fe(OH)3
按电离出
的OH数分
一元碱
二元碱
三元碱
NaOH
Ba(OH)2
Fe(OH)3
正盐
酸式盐
碱式盐
Na2CO3
NaHCO3
Cu2(OH)2CO3
Al(OH)3
学案:P22
练习:学案P22
练习1——练习5
【思考与交流】
★氯化钠溶液是怎么得到的?
★泥水浊液是怎么得到的?
氯化钠固体分散在水中形成的混合体系
泥分散在水中所形成的混合体系
二、分散系及其分类
1.分散系:
把一种(或多种)物质分散在另一种
(或多种)物质中所得到的体系
分散质:被分散的物质
分散剂:容纳分散质的物质
(量少)
(量多)
根据分散质或分散剂所处的状态(气态、液态、固态),分散系可分为哪几种?
二、分散系及其分类
根据分散质与分散剂状态
分散质
分散剂
气 态
液 态
固 态
固 态
液 态
气 态
9种
固
实 例
空气
云、雾
烟、灰尘
泡沫
牛奶、酒精的水溶液
糖水、油漆
泡沫塑料
珍珠(包藏着水的碳酸钙)
有色玻璃、合金
固
固
液
固
气
液
固
液
液
液
气
气
固
气
液
气
气
分散剂
分散质
思考与交流:请试着举出几种分散系的实例
2、分散系分类
当分散剂是液体时,按分散质粒子大小
分散质粒子大小 所属分散系 外观现象
d<1nm
1nm<d<100nm
d>100nm
溶液
浊液
胶体
均匀、透明、稳定
不均匀、不透明、不稳定
均匀、透明、介稳定
★胶体本质特征:
分散质粒子直径位于1~100nm的分散系
思考:溶液、胶体、浊液的本质区别是什么?
3、胶体
(1)胶体制备
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
△
★注意: ②加热至溶液呈红褐色后停止加热
★注意:④不用“↓”,写胶体
★注意: ③不能用自来水,也不能搅拌
★注意:①沸水、饱和FeCl3溶液
硫酸铜溶液
无光亮的“通路”
有光亮的”通路“
氢氧化铁胶体
丁达尔效应
这条光亮的“通路”是由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,叫做丁达尔效应。
粒子小,全透射
溶液
粒子较大,散射
胶体
粒子很大,全反射
浊液
2、胶体性质——丁达尔效应
区分胶体和溶液
应用:
(胶体特有的性质)
夜晚用手电筒照射夜空
放电影时,放映室射到银幕上的光柱
光线
透过树叶间
的缝隙射入
密林中
?空气也是胶体吗
是的。叫气溶胶
讨论:
如果没有丁达尔效应我们的生活将会将会怎样?
常见的胶体:
烟、云、雾,血液、豆浆、果冻、米粥汤、蛋清、墨水、肥皂水、有色玻璃、土壤胶体、蛋白质、淀粉溶液
将Fe(OH)3胶体和泥水分别进行过滤
没得到滤渣,滤液还是红褐色。
在滤纸上得到泥沙,滤液
澄清、透明。
过滤后的现象
Fe(OH)3胶体
泥水
科学探究
结论:胶体可以透过滤纸,浊液不可以透过滤纸
分散系
举例
均一
透明
盐水、
酒精的水溶液
<1nm
1~100nm
均一
透明
豆浆
能
>100nm
不均一
不透明
不能
泥水
溶液
胶体
浊液
分散质粒子大小
外观
能否透过滤纸
能
稳定性
稳定
较稳定
不稳定
小结:
能力拓展
1. “纳米材料”是粒子直径为1~ 100nm的材料,纳米碳就是其中的一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B. ②③④
C.②③⑤ D. ①③④⑥
B
练习:
学案:P24 练习6
P25 4、9、10、12
知识拓展:
胶体的净化方法——渗析法
将胶体放入半透膜袋里,再将此袋放入水中,胶体粒子不能透过半透膜,而分 子,离子可以通过半透膜,从而使杂质分子或离子进入水中而除去。
半透膜如动物肠衣、鸡蛋克膜,羊皮纸、胶棉薄膜、玻璃纸等)。
渗析
渗析
分离胶体和溶液
胶体的性质——
更多胶体的性质请大家阅读学案P25了解
