2021-2022学年高一化学人教版(2019)必修第一册1.1.1 物质的分类 课件(34张ppt)
文档属性
| 名称 | 2021-2022学年高一化学人教版(2019)必修第一册1.1.1 物质的分类 课件(34张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-10 00:00:00 | ||
图片预览







文档简介
(共34张PPT)
第一章
物质及其变化
第一节
物质的分类及转化
第1课时
物质的分类
在日常生活中我们会在什么地方用到分类的方法?
图书馆
超市
图书馆、超市、药房、书店、快递公司等地方都利用了分类的手段,可以提高日常生活、学习和工作的效率
图书馆里有许许多多的书籍,为什么你很快就能找到你需要的书呢?
100多种元素组成的物质世界,现在世界上已发现或合成的物质有多少种?
已超过1亿5千万种
分类是认识和研究物质及其变化的一种常用的科学方法。
一、物质的分类:
1、分类的概念:
是根据研究对象的共同点和差异点,将它们区分为不同类别和层次的科学方法。(按照一定的标准对事物进行划分的方法。)
分类的关键:
分类“标准”的确定
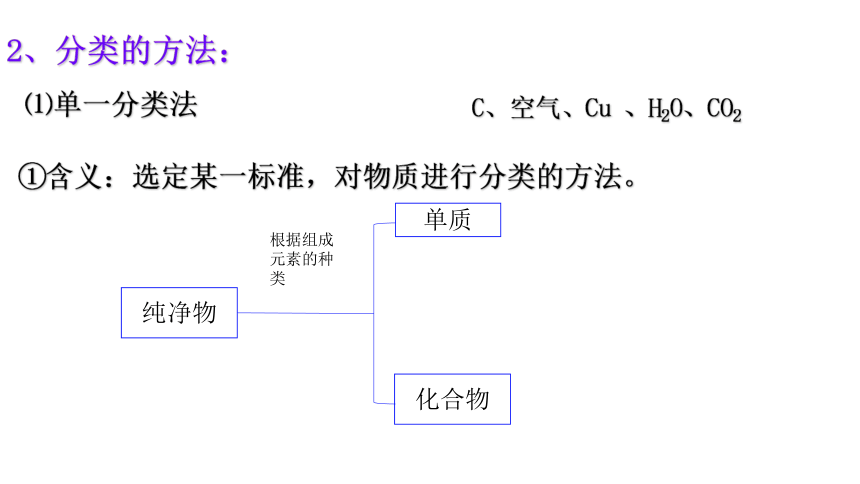
⑴单一分类法
①含义:选定某一标准,对物质进行分类的方法。
2、分类的方法:
纯净物
化合物
单质
根据组成元素的种类
C、空气、Cu
、H2O、CO2
【思考与交流】通过物质分类认识物质的性质
同一种元素组成的单质性质都一样吗?
新概念:
由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
不一定,结构不同,性质不同。比如金刚石和石墨。
例子:金刚石、石墨和C60是碳元素的同素异形体;
氧气和臭氧(O3)是氧元素的同素异形体。。。
方法导引:学习物质的化学性质时可先从通性入手,再掌握它的特性。
CO和CO2互为同素异形体吗?为什么?
对于多达1亿多种的物质和更多的化学反应,我们要想认识它们的规律性,就必须运用分类的方法,按照事先设定的“标准”进行分类。
请同学们根据初中学习的化学知识,尝试将化学物质进行分类,画出图示,说一说分类的标准。
初高中知识衔接:
那么在我们化学学习过程中如何利用分类的方法提高我们的学习效率呢?
物质
纯净物
混合物
化合物
单质
非金属单质
金属单质
氧化物
酸
碱
盐
根据组成物质的种类
根据组成元素的种类
根据组成元素的性质
根据组成元素的种类及物质的性质
有机物
无机物
(2)树状分类法:对同类事物进行再分类的方法。
树状分类法
(2)树状分类法:对同类事物进行再分类的方法。
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
根据组成的阳离子分
根据组成的阴离子分
特征:不同类别的物质有交集。
【思考与交流】通过物质分类了解物质的转化。
请同学们对下列物质进行分类,并说说你的分类标准。
(3)交叉分类法:对一种事物用两种或两种以上标准进行分类的方法。
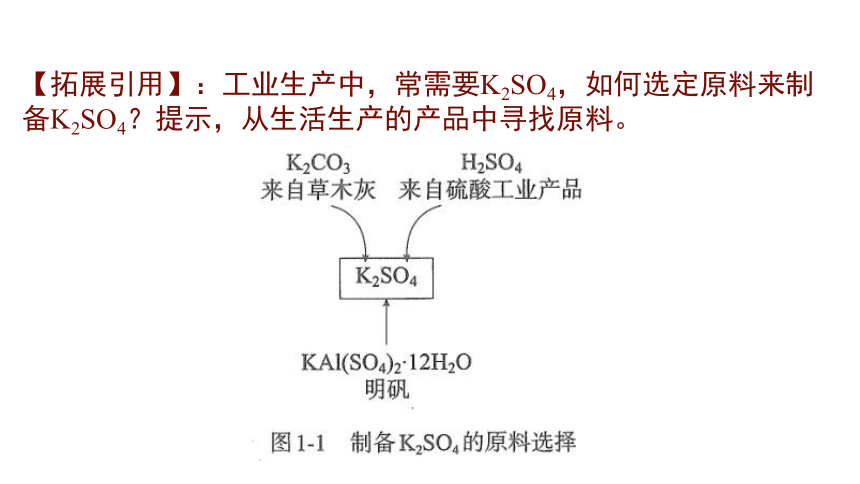
【拓展引用】:工业生产中,常需要K2SO4,如何选定原料来制备K2SO4?提示,从生活生产的产品中寻找原料。
【思考与交流】通过分类认识同类物质的化学通性
根据元素的组成可以将下列物质:CO2、Na2O、SO2、MgO、SO3、CaO
分为金属氧化物和非金属氧化物,试分析它们的化学性质。
CO2
+
Ca(OH)2
==
CaCO3↓
+
H2O
MgO
+
2HCl
==
MgCl2
+
H2O
SO2、SO3
CaO、Na2O
CO2+H2O=H2CO3
SO2+H2O=H2SO3
SO3+H2O=H2SO4
CaO+H2O=Ca(OH)2
Na2O+H2O=2NaOH
是不是所有的非金属氧化物都能和碱反应?是不是所有的金属氧化物都能和酸反应?从化学角度分析,对于氧化物是否有更合理的分类方法?
CO不能和碱反应。
新概念:
酸性氧化物:
与碱反应生成相应的盐和水的氧化物
碱性氧化物:与酸反应生成相应的盐和水的氧化物
酸性氧化物
+
碱
盐+水
碱性氧化物
+
酸
盐+水
能与碱反应只生成盐和水的氧化物(如果能与水反应只生成相应酸)
酸性氧化物
SiO2+2NaOH=2Na2SiO3+H2O
CO2+H2O=H2CO3
SO2+H2O=H2SO3
Mn2O7+2NaOH=2NaMnO4+H2O
所以:CO2
SO2
SiO2
Mn2O7为酸性氧化物
3NO2+H2O=2HNO3+NO
生成物中不只有酸,所以NO2不是酸性氧化物
思考辨析:
⑴酸性氧化物不一定是非金属氧化物
⑵非金属氧化物也不一定是酸性氧化物
如:Mn2O7
如:NO2
CO
Mn2O7+H2O=2HMnO4
能与酸反应只生成盐和水的氧化物。(若能与水反应只生成碱)
碱性氧化物
CuO+H2SO4=CuSO4+2H2O
CaO+H2O=Ca(OH)2
Na2O+H2O=2NaOH
Fe2O3+6HCl=2FeCl3+3H2O
所以:CaO
CuO
Na2O
Fe2O3为碱性氧化物
2Na2O2+2H2O=4NaOH+O2↑
生成物中不只有碱,所以Na2O2不是碱性氧化物
思考辨析:碱性氧化物都是金属氧化物但是金属氧化物不一定是碱性氧化物
如:Mn2O7
概念辨析
1、金属氧化物一定是碱性氧化物?
2、非金属氧化物一定是酸性氧化物?
2、酸性氧化物都能溶于水生成相应的酸?
Mn2O7是酸性氧化物
NO、CO
×
×
知识拓展:NO、CO等氧化物既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物
×
SiO2
温馨提示:
⑴
部分酸性氧化物能与水反应生成相应的酸
如:SO3+H2O=H2SO4
;酸性氧化物通常能与碱性氧化物反应生成相应的盐
如:SO2+CaO=CaSO3
⑵
部分碱性氧化物能与水反应生成相应的碱
如:CaO+H2O=Ca(OH)2
;碱性氧化物通常能与酸性氧化物反应生成相应的盐
如:CaO+CO2=CaCO3
小结:
1、分类是一种科学的学习方法,科学分类的前提是有准确的分类标准
3、用树状分类法,按物质组成对物质进行分类;按物质性质对氧化物进行分类
4、酸性氧化物、碱性氧化物的概念
2、单一分类法,同素异形体的概念
物质的分类
练习1、下列每组中的两种物质之间的关系为同素异形体的一组是(
)
A.CaO和CaS
B.
和
C.C60和C70
D.HCNO和HOCN
C
学习评价一
练习2、现有下列物质:①H2O
②空气
③Mg
④CaO
⑤H2SO4
⑥Ca(OH)2
⑦CuSO4·5H2O
⑧碘酒
⑨C2H5OH和⑩NaHCO3。其中属于混合物的是_____(填序号,下同);属于酸的是________;属于盐的是________;属于氧化物的是______;
①④
②⑧
⑤
⑦⑩
3.阅读下列科普短文并填空。
燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如,氢氧燃料电池在工作时,从负极连续通入H2
①
,从正极连续通人O2②,二者在电池内部(含有H2SO4
③或KOH
④等物质的溶液)发生反应生成H2O⑤,同时产生电能。除了H2,CH4⑥、C2H5OH⑦等也可以作为燃料电池的燃料。目前已研制成功Al
⑧
--
空气⑨燃料电池,它可以代替汽油⑩为汽车提供动力,也可以用作照明电源等。
(
1)在上述短文标有序号的物质中,属于混合物的是_____
(填序号,下同);属于氧化物的是_______;属于酸的是______
;属于碱的是_______属于有机物的是_______
(2)从物质的类别来看,
H2、O2和Al都属于_____
;请写出与O2互为同素异形体的物质的化学式______:
体验新高考:真实情境下的考题
⑨⑩
⑤
③
④
⑥⑦
单质
O3
练习4:对下列酸用交叉分类法进行分类,并说出你的分类标准。
H2SO4、HCl、H2S、H3PO4、
HNO3
是否含氧
酸性强弱
酸分子电离出H+个数
分类标准:
【方法导引】
分类
分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入研究。
分类有一定的标准,根据不同的标准,人们对研究对象进行不同的分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。
物质的分类
单质
金属单质
非金属单质
C、P、S、Si
固态非金属单质
液态非金属单质
气态非金属单质
Br2
O2、O3、N2
Na、Mg、Al、Zn
同素异形体:
由同一种元素形成的几种不同的单质,叫做这种元素的同素异形体。
例如:金刚石、石墨、C60互为碳元素的同素异形体
思考:CO和CO2互为同素异形体吗?为什么?
单质的分类
金属
非金属
单
质
活泼金属:
较活泼金属:
不活泼金属:
由分子构成:
由原子直接构成:
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金刚石、石墨、
H2、Cl2、P4、O3
单质的分类
氧化物
酸性氧化物
碱性氧化物
(其它氧化物)
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3
CaO、CuO、K2O
CO、H2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物的分类
两性氧化物
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物
如:Al2O3等
Al2O3+3H2SO4=Al2(SO4)3+3H2O
Al2O3+2NaOH=NaAlO2+H2O
不成盐氧化物
既不能与酸反应生成盐和水,又不能与碱反应生成盐和水的氧化物
如:CO
、NO等
氧化物的分类
温馨提示:
⑴
部分酸性氧化物能与水反应生成相应的酸
如:SO3+H2O=H2SO4
;酸性氧化物通常能与碱性氧化物反应生成相应的盐
如:SO2+CaO=CaSO3
⑵
部分碱性氧化物能与水反应生成相应的碱
如:CaO+H2O=Ca(OH)2
;碱性氧化物通常能与酸性氧化物反应生成相应的盐
如:CaO+CO2=CaCO3
氧化物的分类
酸
组成
性质
变化
沸点
酸性
稳定性
含氧酸
无氧酸
一元酸
二元酸
多元酸
易挥发
难挥发
易分解
难分解
强酸
弱酸
HNO3
H2S
HCl
H2SO4
H3PO4
H2SiO3
H2CO3
H2SO3
HCl0
H2SO4
H3PO4
HCl
HClO4高氯酸
HCl
HNO3
H2SO4
CH3COOH
H2CO3
H2SiO3
HF
H2SO4
HNO3
HClO
H2S
HCl
HF
HClO
HNO3
HCl
H2SO4
H2CO3
H2S
H3PO4
H3BO3
酸的分类
可溶性碱
难溶性碱
强碱
弱碱
一元碱
二元碱
多元碱
溶解性
碱性
性质
变化
碱
NaOH
Ba(OH)2
Mg(OH)2
Cu(OH)2
NaOH
KOH
Ba(OH)2
Fe(OH)2
Cu(OH)2
NH3·H2O
NaOH
KOH
Fe(OH)2
Ca(OH)2
Fe(OH)3
Al(OH)3
说明:二元碱属于多元碱
碱的分类
盐
酸根
含氧酸盐
无氧酸盐
形成
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
弱酸弱碱盐
溶解性
可溶性盐
难溶性盐
Na2SO4
KNO3
CaCl2
NaCl
NaCl
Na2SO4
AlCl3
MgSO4
Na2CO3
NaClO
(NH4)2CO3
Na2CO3
KNO3
CaCO3
BaSO4
盐的分类
2.按是否可溶于水:
可溶性盐:
难溶性盐:
K+
Na+
NH4+
NO3-
SO42--
(大部分)
Cl--
(大部分)
CO32--
AgCl
BaSO4
1.按阴、阳离子来分:
阳离子:
阴离子:
K+
(钾盐)
Na+(钠盐)
NH4+(铵盐)
Cu2+(铜盐)
Ca2+
(钙盐)
NO3--(硝酸盐)
SO42--
(硫酸盐)
CO32—(碳酸盐
)
PO43--
(磷酸盐)Cl-(氯化物)
3.组成中是否有可电离的H+、OH-
正盐
(Na2CO3
、NaCl)
酸式盐
NaHSO4
碱式盐
Cu2(OH)2CO3
(碱式碳酸铜俗称孔雀石)
盐的分类
第一章
物质及其变化
第一节
物质的分类及转化
第1课时
物质的分类
在日常生活中我们会在什么地方用到分类的方法?
图书馆
超市
图书馆、超市、药房、书店、快递公司等地方都利用了分类的手段,可以提高日常生活、学习和工作的效率
图书馆里有许许多多的书籍,为什么你很快就能找到你需要的书呢?
100多种元素组成的物质世界,现在世界上已发现或合成的物质有多少种?
已超过1亿5千万种
分类是认识和研究物质及其变化的一种常用的科学方法。
一、物质的分类:
1、分类的概念:
是根据研究对象的共同点和差异点,将它们区分为不同类别和层次的科学方法。(按照一定的标准对事物进行划分的方法。)
分类的关键:
分类“标准”的确定
⑴单一分类法
①含义:选定某一标准,对物质进行分类的方法。
2、分类的方法:
纯净物
化合物
单质
根据组成元素的种类
C、空气、Cu
、H2O、CO2
【思考与交流】通过物质分类认识物质的性质
同一种元素组成的单质性质都一样吗?
新概念:
由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
不一定,结构不同,性质不同。比如金刚石和石墨。
例子:金刚石、石墨和C60是碳元素的同素异形体;
氧气和臭氧(O3)是氧元素的同素异形体。。。
方法导引:学习物质的化学性质时可先从通性入手,再掌握它的特性。
CO和CO2互为同素异形体吗?为什么?
对于多达1亿多种的物质和更多的化学反应,我们要想认识它们的规律性,就必须运用分类的方法,按照事先设定的“标准”进行分类。
请同学们根据初中学习的化学知识,尝试将化学物质进行分类,画出图示,说一说分类的标准。
初高中知识衔接:
那么在我们化学学习过程中如何利用分类的方法提高我们的学习效率呢?
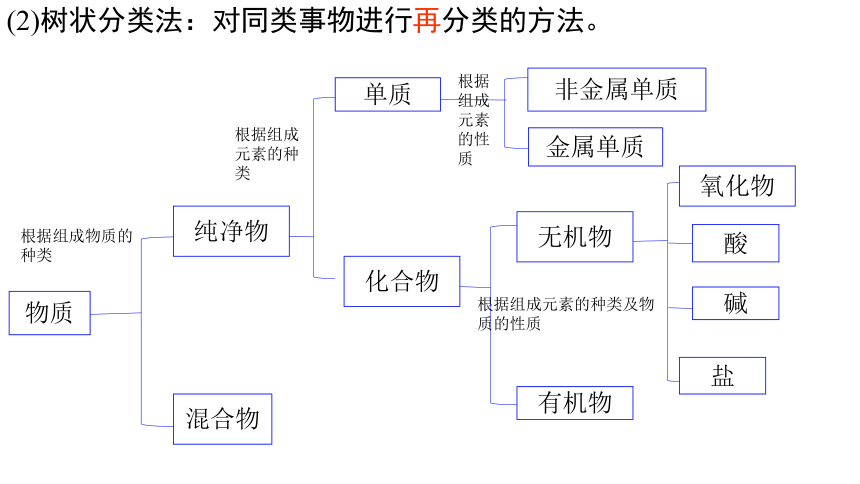
物质
纯净物
混合物
化合物
单质
非金属单质
金属单质
氧化物
酸
碱
盐
根据组成物质的种类
根据组成元素的种类
根据组成元素的性质
根据组成元素的种类及物质的性质
有机物
无机物
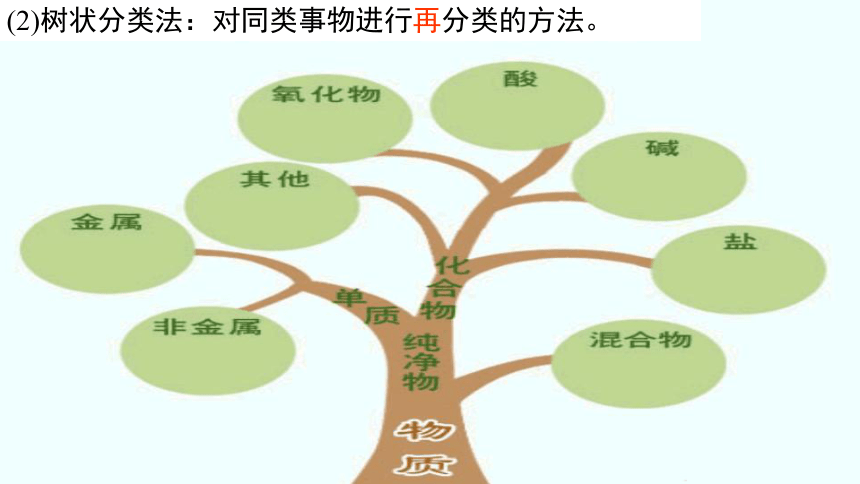
(2)树状分类法:对同类事物进行再分类的方法。
树状分类法
(2)树状分类法:对同类事物进行再分类的方法。
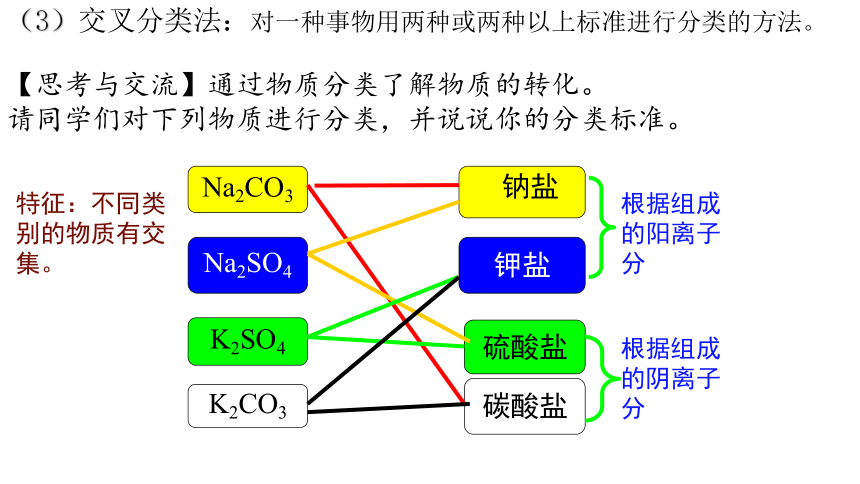
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
根据组成的阳离子分
根据组成的阴离子分
特征:不同类别的物质有交集。
【思考与交流】通过物质分类了解物质的转化。
请同学们对下列物质进行分类,并说说你的分类标准。
(3)交叉分类法:对一种事物用两种或两种以上标准进行分类的方法。
【拓展引用】:工业生产中,常需要K2SO4,如何选定原料来制备K2SO4?提示,从生活生产的产品中寻找原料。
【思考与交流】通过分类认识同类物质的化学通性
根据元素的组成可以将下列物质:CO2、Na2O、SO2、MgO、SO3、CaO
分为金属氧化物和非金属氧化物,试分析它们的化学性质。
CO2
+
Ca(OH)2
==
CaCO3↓
+
H2O
MgO
+
2HCl
==
MgCl2
+
H2O
SO2、SO3
CaO、Na2O
CO2+H2O=H2CO3
SO2+H2O=H2SO3
SO3+H2O=H2SO4
CaO+H2O=Ca(OH)2
Na2O+H2O=2NaOH
是不是所有的非金属氧化物都能和碱反应?是不是所有的金属氧化物都能和酸反应?从化学角度分析,对于氧化物是否有更合理的分类方法?
CO不能和碱反应。
新概念:
酸性氧化物:
与碱反应生成相应的盐和水的氧化物
碱性氧化物:与酸反应生成相应的盐和水的氧化物
酸性氧化物
+
碱
盐+水
碱性氧化物
+
酸
盐+水
能与碱反应只生成盐和水的氧化物(如果能与水反应只生成相应酸)
酸性氧化物
SiO2+2NaOH=2Na2SiO3+H2O
CO2+H2O=H2CO3
SO2+H2O=H2SO3
Mn2O7+2NaOH=2NaMnO4+H2O
所以:CO2
SO2
SiO2
Mn2O7为酸性氧化物
3NO2+H2O=2HNO3+NO
生成物中不只有酸,所以NO2不是酸性氧化物
思考辨析:
⑴酸性氧化物不一定是非金属氧化物
⑵非金属氧化物也不一定是酸性氧化物
如:Mn2O7
如:NO2
CO
Mn2O7+H2O=2HMnO4
能与酸反应只生成盐和水的氧化物。(若能与水反应只生成碱)
碱性氧化物
CuO+H2SO4=CuSO4+2H2O
CaO+H2O=Ca(OH)2
Na2O+H2O=2NaOH
Fe2O3+6HCl=2FeCl3+3H2O
所以:CaO
CuO
Na2O
Fe2O3为碱性氧化物
2Na2O2+2H2O=4NaOH+O2↑
生成物中不只有碱,所以Na2O2不是碱性氧化物
思考辨析:碱性氧化物都是金属氧化物但是金属氧化物不一定是碱性氧化物
如:Mn2O7
概念辨析
1、金属氧化物一定是碱性氧化物?
2、非金属氧化物一定是酸性氧化物?
2、酸性氧化物都能溶于水生成相应的酸?
Mn2O7是酸性氧化物
NO、CO
×
×
知识拓展:NO、CO等氧化物既不能与酸反应又不能与碱反应生成相应的盐和水,属于不成盐氧化物
×
SiO2
温馨提示:
⑴
部分酸性氧化物能与水反应生成相应的酸
如:SO3+H2O=H2SO4
;酸性氧化物通常能与碱性氧化物反应生成相应的盐
如:SO2+CaO=CaSO3
⑵
部分碱性氧化物能与水反应生成相应的碱
如:CaO+H2O=Ca(OH)2
;碱性氧化物通常能与酸性氧化物反应生成相应的盐
如:CaO+CO2=CaCO3
小结:
1、分类是一种科学的学习方法,科学分类的前提是有准确的分类标准
3、用树状分类法,按物质组成对物质进行分类;按物质性质对氧化物进行分类
4、酸性氧化物、碱性氧化物的概念
2、单一分类法,同素异形体的概念
物质的分类
练习1、下列每组中的两种物质之间的关系为同素异形体的一组是(
)
A.CaO和CaS
B.
和
C.C60和C70
D.HCNO和HOCN
C
学习评价一
练习2、现有下列物质:①H2O
②空气
③Mg
④CaO
⑤H2SO4
⑥Ca(OH)2
⑦CuSO4·5H2O
⑧碘酒
⑨C2H5OH和⑩NaHCO3。其中属于混合物的是_____(填序号,下同);属于酸的是________;属于盐的是________;属于氧化物的是______;
①④
②⑧
⑤
⑦⑩
3.阅读下列科普短文并填空。
燃料电池是一种化学电池,具有能量转化率高、对环境友好等优点。例如,氢氧燃料电池在工作时,从负极连续通入H2
①
,从正极连续通人O2②,二者在电池内部(含有H2SO4
③或KOH
④等物质的溶液)发生反应生成H2O⑤,同时产生电能。除了H2,CH4⑥、C2H5OH⑦等也可以作为燃料电池的燃料。目前已研制成功Al
⑧
--
空气⑨燃料电池,它可以代替汽油⑩为汽车提供动力,也可以用作照明电源等。
(
1)在上述短文标有序号的物质中,属于混合物的是_____
(填序号,下同);属于氧化物的是_______;属于酸的是______
;属于碱的是_______属于有机物的是_______
(2)从物质的类别来看,
H2、O2和Al都属于_____
;请写出与O2互为同素异形体的物质的化学式______:
体验新高考:真实情境下的考题
⑨⑩
⑤
③
④
⑥⑦
单质
O3
练习4:对下列酸用交叉分类法进行分类,并说出你的分类标准。
H2SO4、HCl、H2S、H3PO4、
HNO3
是否含氧
酸性强弱
酸分子电离出H+个数
分类标准:
【方法导引】
分类
分类是根据研究对象的共同点和差异点,将它们区分为不同种类和层次的科学方法。科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入研究。
分类有一定的标准,根据不同的标准,人们对研究对象进行不同的分类。在高中化学的学习中,对物质及其变化的分类标准将从物质的组成和性质等宏观视角,拓展到物质的构成、结构和参加化学反应的粒子等微观视角。
运用分类的方法,可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。
物质的分类
单质
金属单质
非金属单质
C、P、S、Si
固态非金属单质
液态非金属单质
气态非金属单质
Br2
O2、O3、N2
Na、Mg、Al、Zn
同素异形体:
由同一种元素形成的几种不同的单质,叫做这种元素的同素异形体。
例如:金刚石、石墨、C60互为碳元素的同素异形体
思考:CO和CO2互为同素异形体吗?为什么?
单质的分类
金属
非金属
单
质
活泼金属:
较活泼金属:
不活泼金属:
由分子构成:
由原子直接构成:
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金刚石、石墨、
H2、Cl2、P4、O3
单质的分类
氧化物
酸性氧化物
碱性氧化物
(其它氧化物)
CuO、Fe2O3、Na2O
CO、P2O5、H2O
CO2、P2O5、SO3
CaO、CuO、K2O
CO、H2O
从组成元素分
非金属氧化物
金属氧化物
从性质分
氧化物的分类
两性氧化物
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物
如:Al2O3等
Al2O3+3H2SO4=Al2(SO4)3+3H2O
Al2O3+2NaOH=NaAlO2+H2O
不成盐氧化物
既不能与酸反应生成盐和水,又不能与碱反应生成盐和水的氧化物
如:CO
、NO等
氧化物的分类
温馨提示:
⑴
部分酸性氧化物能与水反应生成相应的酸
如:SO3+H2O=H2SO4
;酸性氧化物通常能与碱性氧化物反应生成相应的盐
如:SO2+CaO=CaSO3
⑵
部分碱性氧化物能与水反应生成相应的碱
如:CaO+H2O=Ca(OH)2
;碱性氧化物通常能与酸性氧化物反应生成相应的盐
如:CaO+CO2=CaCO3
氧化物的分类
酸
组成
性质
变化
沸点
酸性
稳定性
含氧酸
无氧酸
一元酸
二元酸
多元酸
易挥发
难挥发
易分解
难分解
强酸
弱酸
HNO3
H2S
HCl
H2SO4
H3PO4
H2SiO3
H2CO3
H2SO3
HCl0
H2SO4
H3PO4
HCl
HClO4高氯酸
HCl
HNO3
H2SO4
CH3COOH
H2CO3
H2SiO3
HF
H2SO4
HNO3
HClO
H2S
HCl
HF
HClO
HNO3
HCl
H2SO4
H2CO3
H2S
H3PO4
H3BO3
酸的分类
可溶性碱
难溶性碱
强碱
弱碱
一元碱
二元碱
多元碱
溶解性
碱性
性质
变化
碱
NaOH
Ba(OH)2
Mg(OH)2
Cu(OH)2
NaOH
KOH
Ba(OH)2
Fe(OH)2
Cu(OH)2
NH3·H2O
NaOH
KOH
Fe(OH)2
Ca(OH)2
Fe(OH)3
Al(OH)3
说明:二元碱属于多元碱
碱的分类
盐
酸根
含氧酸盐
无氧酸盐
形成
强酸强碱盐
强酸弱碱盐
弱酸强碱盐
弱酸弱碱盐
溶解性
可溶性盐
难溶性盐
Na2SO4
KNO3
CaCl2
NaCl
NaCl
Na2SO4
AlCl3
MgSO4
Na2CO3
NaClO
(NH4)2CO3
Na2CO3
KNO3
CaCO3
BaSO4
盐的分类
2.按是否可溶于水:
可溶性盐:
难溶性盐:
K+
Na+
NH4+
NO3-
SO42--
(大部分)
Cl--
(大部分)
CO32--
AgCl
BaSO4
1.按阴、阳离子来分:
阳离子:
阴离子:
K+
(钾盐)
Na+(钠盐)
NH4+(铵盐)
Cu2+(铜盐)
Ca2+
(钙盐)
NO3--(硝酸盐)
SO42--
(硫酸盐)
CO32—(碳酸盐
)
PO43--
(磷酸盐)Cl-(氯化物)
3.组成中是否有可电离的H+、OH-
正盐
(Na2CO3
、NaCl)
酸式盐
NaHSO4
碱式盐
Cu2(OH)2CO3
(碱式碳酸铜俗称孔雀石)
盐的分类
