2021-2022学年高一上学期化学人教版(2019)必修第一册1.1.3物质的转化(第3课时)课件(20张ppt)
文档属性
| 名称 | 2021-2022学年高一上学期化学人教版(2019)必修第一册1.1.3物质的转化(第3课时)课件(20张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-10 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第一章
物质及其变化
第一节
物质的分类及转化
第3课时
物质的转化
化学反应
按反应物和生成物的类别以及反应前后物质的多少
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应(A+BC=AC+B)
复分解反应(AB+CD=AD+BC)
化合反应:反应物不止一种,生成物只有一种(多变一)
复习四大基本化学反应类型
分解反应:反应物质有一种,生成物不止一种(一变多)
置换反应:一种单质与一种化合物反应,生成另一种单质和另一种化合物(属于氧化还原反应,有化合价升降,伴随电子得失)
复分解反应:两种化合物互相交换成分,生成另外两种化合物(一般会生成
沉淀、气体、水等)
一、酸、碱、盐的化学性质
(1)酸的通性。
(2)酸具有通性的原因:所有的酸溶液中都含有大量H+。
【微思考1】能使紫色石蕊溶液变红的一定是酸吗?
提示:不一定。如NaHSO4属于酸式盐,其溶液呈强酸性,也可使紫色石蕊变成红色。
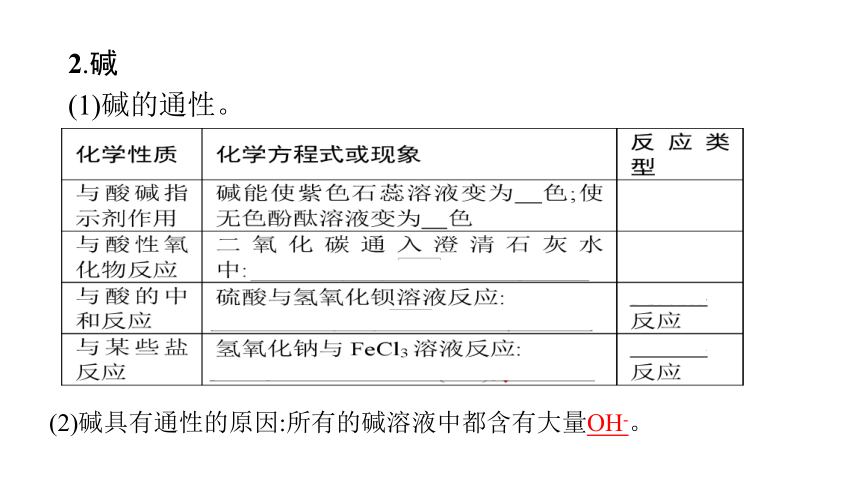
2.碱
(1)碱的通性。
(2)碱具有通性的原因:所有的碱溶液中都含有大量OH-。
3.盐
(1)盐的通性
(2)盐具有某些通性的原因:不同的盐溶液中都含有金属离子(或N
)和酸根离子。
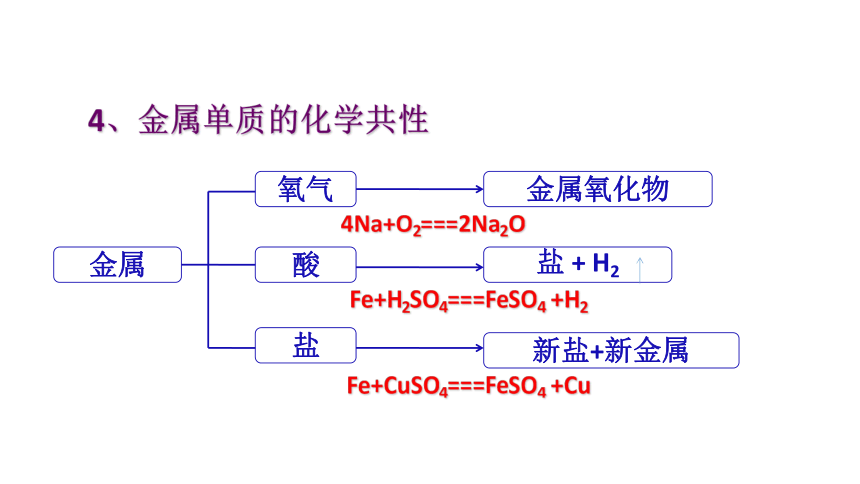
4、金属单质的化学共性
金属
氧气
酸
盐
金属氧化物
盐
+
H2
新盐+新金属
4Na+O2===2Na2O
Fe+H2SO4===FeSO4
+H2
Fe+CuSO4===FeSO4
+Cu
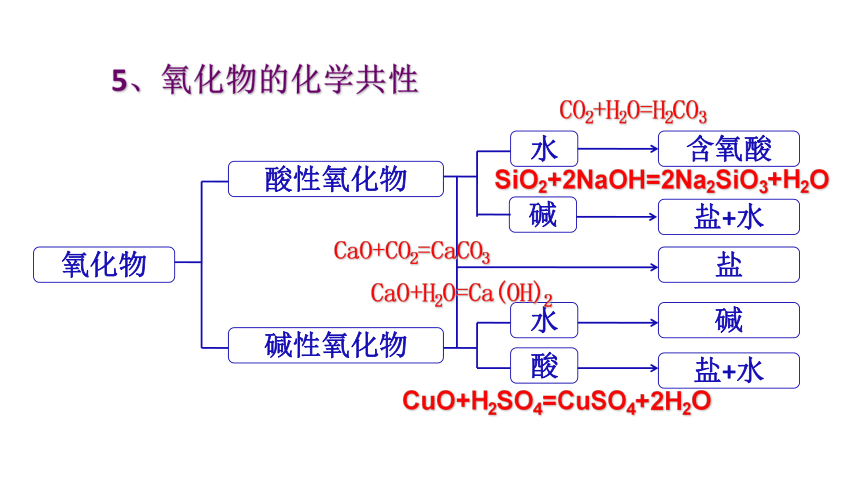
5、氧化物的化学共性
氧化物
酸性氧化物
碱性氧化物
水
碱
含氧酸
盐+水
水
酸
碱
盐+水
盐
CO2+H2O=H2CO3
SiO2+2NaOH=2Na2SiO3+H2O
CaO+H2O=Ca(OH)2
CuO+H2SO4=CuSO4+2H2O
CaO+CO2=CaCO3
1.判断物质发生化学变化的基本依据:原子重新组合生成新物质;化学变化中元素种类不发生改变。
2.根据物质的组成和性质,通过化学变化可实现物质间的转化。
化学方程式分别为:
①
;?
②
;?
③
。?
碱
碱
酸
酸
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4↓+2H2O
二、物质的转化
化学方程式分别为:
④
;?
⑤
;?
⑥
。?
酸
碱
酸
碱
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
【思考】对于上述转化关系,从分类的角度看,你发现了什么规律?
单质到盐的转化关系。根据物质的组成和性质,以及物质之间的转化关系,我们可以确定制取某类物质的可能方法。
【思考】对于上述转化关系,从分类的角度看,你发现了什么规律?
3.工业生产中制取某物质需考虑的问题
除要考虑反应进行的可能性外,还要考虑原料来源、成本高低和设备要求等因素。
如制备NaOH主要采用的方法为电解饱和食盐水,过去也曾采用盐与碱反应的方法,如反应Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,一般不采用反应Na2O+H2O=2NaOH,原因是Na2O来源少、成本高。
单质、氧化物、酸、碱、盐之间的相互转化
问题探究
写出上述反应的化学方程式,并判断反应类型。
深化拓展
单质、氧化物、酸、碱、盐的转化关系
1.已知存在化学反应:H2+Cl2
2HCl。下列说法不正确的是( )
A.该反应涉及的物质转化类型为单质
化合物
B.该反应属于化合反应
C.HCl属于无氧酸
D.液态Cl2属于混合物
答案:D
解析:液态Cl2为纯净物。
2.下列物质可以与其他物质直接反应生成盐的是( )
①金属 ②碱性氧化物 ③碱 ④酸性氧化物 ⑤酸
A.只有①②③
B.只有①④
C.只有②⑤
D.①②③④⑤
答案:D
解析:金属、碱性氧化物、碱与酸反应均会生成盐;酸性氧化物、酸与碱反应均会生成盐。
3.某同学在奥运五连环中填入了5种物质,相连环中物质间能发生反应,不相连环中物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型是( )
A.复分解反应
B.分解反应
C.化合反应
D.置换反应
答案:B
解析:Fe与稀盐酸发生置换反应;NaOH溶液与稀盐酸的反应为复分解反应;CO2与C能够发生化合反应。没有涉及的基本反应类型是分解反应。
4.分类法是一种重要的学习方法。下列4组物质中均有一种物质的类别与其他三种不同,请分别写出其化学式。
甲:Na、H2、O2、Cl2;
乙:CO、Na2O、CO2、SO2;
丙:NaOH、K2CO3、KHCO3、K2SO4;
丁:NaOH、Ca(OH)2、KOH、NaCl。
(1)甲
?,乙
?,?
丙
?,丁
?。?
(2)根据下图写出序号所示反应的化学方程式:
①
;?
②
;?
③
。?
Na
Na2O
NaCl
NaOH
答案:(1)Na Na2O NaOH NaCl
(2)①4Na+O2=2Na2O
②Na2O+H2O=2NaOH
③NaOH+HCl=NaCl+H2O
解析:(1)甲组物质中只有Na是金属单质,其余是非金属单质;乙组物质中只有Na2O是金属氧化物,其余是非金属氧化物;丙组中只有NaOH是碱,其余是盐;丁组中只有NaCl是盐,其余是碱。
第一章
物质及其变化
第一节
物质的分类及转化
第3课时
物质的转化
化学反应
按反应物和生成物的类别以及反应前后物质的多少
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应(A+BC=AC+B)
复分解反应(AB+CD=AD+BC)
化合反应:反应物不止一种,生成物只有一种(多变一)
复习四大基本化学反应类型
分解反应:反应物质有一种,生成物不止一种(一变多)
置换反应:一种单质与一种化合物反应,生成另一种单质和另一种化合物(属于氧化还原反应,有化合价升降,伴随电子得失)
复分解反应:两种化合物互相交换成分,生成另外两种化合物(一般会生成
沉淀、气体、水等)
一、酸、碱、盐的化学性质
(1)酸的通性。
(2)酸具有通性的原因:所有的酸溶液中都含有大量H+。
【微思考1】能使紫色石蕊溶液变红的一定是酸吗?
提示:不一定。如NaHSO4属于酸式盐,其溶液呈强酸性,也可使紫色石蕊变成红色。
2.碱
(1)碱的通性。
(2)碱具有通性的原因:所有的碱溶液中都含有大量OH-。
3.盐
(1)盐的通性
(2)盐具有某些通性的原因:不同的盐溶液中都含有金属离子(或N
)和酸根离子。
4、金属单质的化学共性
金属
氧气
酸
盐
金属氧化物
盐
+
H2
新盐+新金属
4Na+O2===2Na2O
Fe+H2SO4===FeSO4
+H2
Fe+CuSO4===FeSO4
+Cu
5、氧化物的化学共性
氧化物
酸性氧化物
碱性氧化物
水
碱
含氧酸
盐+水
水
酸
碱
盐+水
盐
CO2+H2O=H2CO3
SiO2+2NaOH=2Na2SiO3+H2O
CaO+H2O=Ca(OH)2
CuO+H2SO4=CuSO4+2H2O
CaO+CO2=CaCO3
1.判断物质发生化学变化的基本依据:原子重新组合生成新物质;化学变化中元素种类不发生改变。
2.根据物质的组成和性质,通过化学变化可实现物质间的转化。
化学方程式分别为:
①
;?
②
;?
③
。?
碱
碱
酸
酸
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4↓+2H2O
二、物质的转化
化学方程式分别为:
④
;?
⑤
;?
⑥
。?
酸
碱
酸
碱
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
【思考】对于上述转化关系,从分类的角度看,你发现了什么规律?
单质到盐的转化关系。根据物质的组成和性质,以及物质之间的转化关系,我们可以确定制取某类物质的可能方法。
【思考】对于上述转化关系,从分类的角度看,你发现了什么规律?
3.工业生产中制取某物质需考虑的问题
除要考虑反应进行的可能性外,还要考虑原料来源、成本高低和设备要求等因素。
如制备NaOH主要采用的方法为电解饱和食盐水,过去也曾采用盐与碱反应的方法,如反应Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,一般不采用反应Na2O+H2O=2NaOH,原因是Na2O来源少、成本高。
单质、氧化物、酸、碱、盐之间的相互转化
问题探究
写出上述反应的化学方程式,并判断反应类型。
深化拓展
单质、氧化物、酸、碱、盐的转化关系
1.已知存在化学反应:H2+Cl2
2HCl。下列说法不正确的是( )
A.该反应涉及的物质转化类型为单质
化合物
B.该反应属于化合反应
C.HCl属于无氧酸
D.液态Cl2属于混合物
答案:D
解析:液态Cl2为纯净物。
2.下列物质可以与其他物质直接反应生成盐的是( )
①金属 ②碱性氧化物 ③碱 ④酸性氧化物 ⑤酸
A.只有①②③
B.只有①④
C.只有②⑤
D.①②③④⑤
答案:D
解析:金属、碱性氧化物、碱与酸反应均会生成盐;酸性氧化物、酸与碱反应均会生成盐。
3.某同学在奥运五连环中填入了5种物质,相连环中物质间能发生反应,不相连环中物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型是( )
A.复分解反应
B.分解反应
C.化合反应
D.置换反应
答案:B
解析:Fe与稀盐酸发生置换反应;NaOH溶液与稀盐酸的反应为复分解反应;CO2与C能够发生化合反应。没有涉及的基本反应类型是分解反应。
4.分类法是一种重要的学习方法。下列4组物质中均有一种物质的类别与其他三种不同,请分别写出其化学式。
甲:Na、H2、O2、Cl2;
乙:CO、Na2O、CO2、SO2;
丙:NaOH、K2CO3、KHCO3、K2SO4;
丁:NaOH、Ca(OH)2、KOH、NaCl。
(1)甲
?,乙
?,?
丙
?,丁
?。?
(2)根据下图写出序号所示反应的化学方程式:
①
;?
②
;?
③
。?
Na
Na2O
NaCl
NaOH
答案:(1)Na Na2O NaOH NaCl
(2)①4Na+O2=2Na2O
②Na2O+H2O=2NaOH
③NaOH+HCl=NaCl+H2O
解析:(1)甲组物质中只有Na是金属单质,其余是非金属单质;乙组物质中只有Na2O是金属氧化物,其余是非金属氧化物;丙组中只有NaOH是碱,其余是盐;丁组中只有NaCl是盐,其余是碱。
