化学能与热能课件---上课用
文档属性
| 名称 | 化学能与热能课件---上课用 |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-03 19:24:55 | ||
图片预览





文档简介
(共18张PPT)
2、化学反应的本质是什么?
化学反应的本质是旧化学键的断裂和新化学键的形成。
1、什么是化学键?
使离子相结合或原子相结合的强烈的作用力。统称为化学键。
煤、石油、天然气的主要化学成分是烃类等有机物,它们燃烧所产生的热能从何而来?这种热能与化学物质及化学反应有什么关系?石灰石要经过高温煅烧才能变成生石灰,高温提供的热能在石灰石的分解反应中起什么作用?
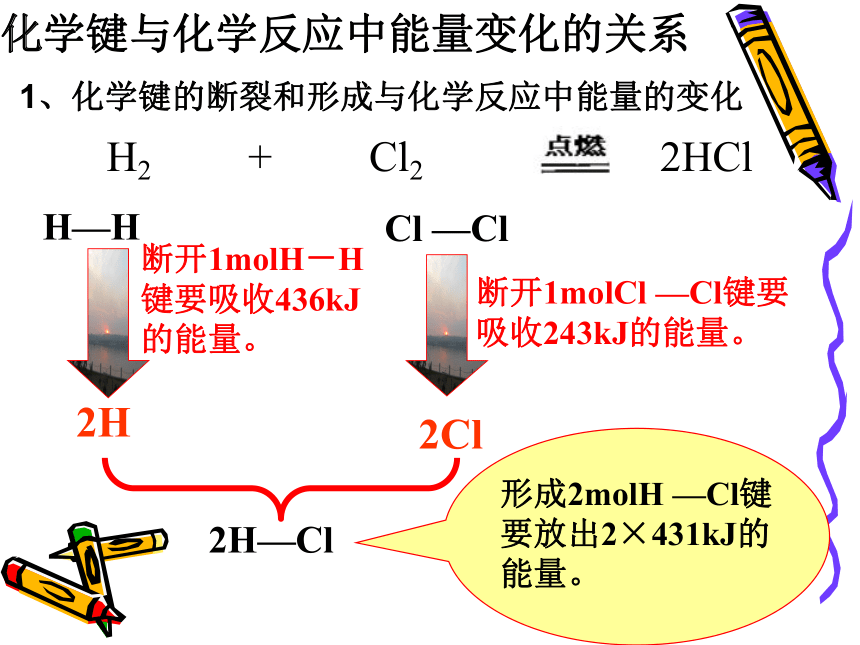
化学键与化学反应中能量变化的关系
1、化学键的断裂和形成与化学反应中能量的变化
2H
H—H
Cl —Cl
H2 + Cl2 2HCl
断开1molH-H键要吸收436kJ的能量。
断开1molCl —Cl键要吸收243kJ的能量。
2Cl
2H—Cl
形成2molH —Cl键要放出2×431kJ的能量。
化学键的断裂和形成是化学反应中能量变化的主要原因。
1、化学反应中能量变化的主要原因是什么?
2、化学反应中能量变化与化学键的关系是什么呢?
化学反应中是吸收能量还是放出能量要看断键时吸收的能量多还是成键时放出能量得多。
2、化学反应中能量变化的原因
(1)从化学反应的本质角度考虑(微观)
断键吸收的总能量 < 成键放出的总能量
在化学反应中:
断键吸收的总能量 > 成键放出的总能量
化学反应放出能量
化学反应吸收能量
水由高处向低处流要释放能量(势能转换为动能)
分析化学反应:
反应物的总能量
>生成物的总能量
化学反应放出能量
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
分析化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放热反应
吸热反应
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量=反应物的总能量+吸收的热量
化学反应的过程,可以看成是能量
的“贮存”或“释放”的过程
断键吸收总能量 <成键放出总能量
断键吸收总能量 > 成键放出总能量
反应物的总能量 >生成物的总能量
反应物的总能量 <生成物的总能量
反应放出能量
反应吸收能量
化学反应中能量变化原因
(1)宏观:化学反应中,化学反应中能量变化主要取决于反应物的总能量和生成物的总能量的相对大小。
(2)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
1.下面是有关化学能和热能的叙述,其中正确的是
( )
A.化学反应中不一定伴随着能量的变化
B.只要有能量变化的反应一定是化学反应
C. 需要加热才能发生的反应一定是吸热反应
D.燃烧反应都可以看成物质内部的化学能转变为热能的放热
反应
2. A+B=C+D是化学反应,已知该反应为放热反应,对该反应的说法正确的是 ( )
A.A的能量一定高于C 的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
D
D
3.下列说法中正确的是 ( )
A.吸热反应只有在在点燃条件下才能发生
B.在化学键的断裂过程中,肯定伴随着能量的变化
C.在一个确定的化学反应关系中,反应物的总能量
与生成物的总能量一定不同
D.在化学键的断裂过程中,肯定放出能量
BC
再见!
2、化学反应的本质是什么?
化学反应的本质是旧化学键的断裂和新化学键的形成。
1、什么是化学键?
使离子相结合或原子相结合的强烈的作用力。统称为化学键。
煤、石油、天然气的主要化学成分是烃类等有机物,它们燃烧所产生的热能从何而来?这种热能与化学物质及化学反应有什么关系?石灰石要经过高温煅烧才能变成生石灰,高温提供的热能在石灰石的分解反应中起什么作用?
化学键与化学反应中能量变化的关系
1、化学键的断裂和形成与化学反应中能量的变化
2H
H—H
Cl —Cl
H2 + Cl2 2HCl
断开1molH-H键要吸收436kJ的能量。
断开1molCl —Cl键要吸收243kJ的能量。
2Cl
2H—Cl
形成2molH —Cl键要放出2×431kJ的能量。
化学键的断裂和形成是化学反应中能量变化的主要原因。
1、化学反应中能量变化的主要原因是什么?
2、化学反应中能量变化与化学键的关系是什么呢?
化学反应中是吸收能量还是放出能量要看断键时吸收的能量多还是成键时放出能量得多。
2、化学反应中能量变化的原因
(1)从化学反应的本质角度考虑(微观)
断键吸收的总能量 < 成键放出的总能量
在化学反应中:
断键吸收的总能量 > 成键放出的总能量
化学反应放出能量
化学反应吸收能量
水由高处向低处流要释放能量(势能转换为动能)
分析化学反应:
反应物的总能量
>生成物的总能量
化学反应放出能量
将水由低处抽向高处需提供能量(电能转换为机械能,再转换为势能)
分析化学反应:
反应物的总能量
<生成物的总能量
化学反应吸收能量
反应物的总能量高
生成物的总能量低
生成物的总能量高
反应物的总能量低
放热反应
吸热反应
反应物的总能量=生成物的总能量+放出的热量
生成物的总能量=反应物的总能量+吸收的热量
化学反应的过程,可以看成是能量
的“贮存”或“释放”的过程
断键吸收总能量 <成键放出总能量
断键吸收总能量 > 成键放出总能量
反应物的总能量 >生成物的总能量
反应物的总能量 <生成物的总能量
反应放出能量
反应吸收能量
化学反应中能量变化原因
(1)宏观:化学反应中,化学反应中能量变化主要取决于反应物的总能量和生成物的总能量的相对大小。
(2)微观:化学键的断裂和形成是化学反应中能量变化的主要原因。
1.下面是有关化学能和热能的叙述,其中正确的是
( )
A.化学反应中不一定伴随着能量的变化
B.只要有能量变化的反应一定是化学反应
C. 需要加热才能发生的反应一定是吸热反应
D.燃烧反应都可以看成物质内部的化学能转变为热能的放热
反应
2. A+B=C+D是化学反应,已知该反应为放热反应,对该反应的说法正确的是 ( )
A.A的能量一定高于C 的能量
B.B的能量一定高于D的能量
C.反应物A与B的总能量一定低于生成物C与D的总能量
D.反应物A与B的总能量一定高于生成物C与D的总能量
D
D
3.下列说法中正确的是 ( )
A.吸热反应只有在在点燃条件下才能发生
B.在化学键的断裂过程中,肯定伴随着能量的变化
C.在一个确定的化学反应关系中,反应物的总能量
与生成物的总能量一定不同
D.在化学键的断裂过程中,肯定放出能量
BC
再见!
