铁的化合物
图片预览



文档简介
(共17张PPT)
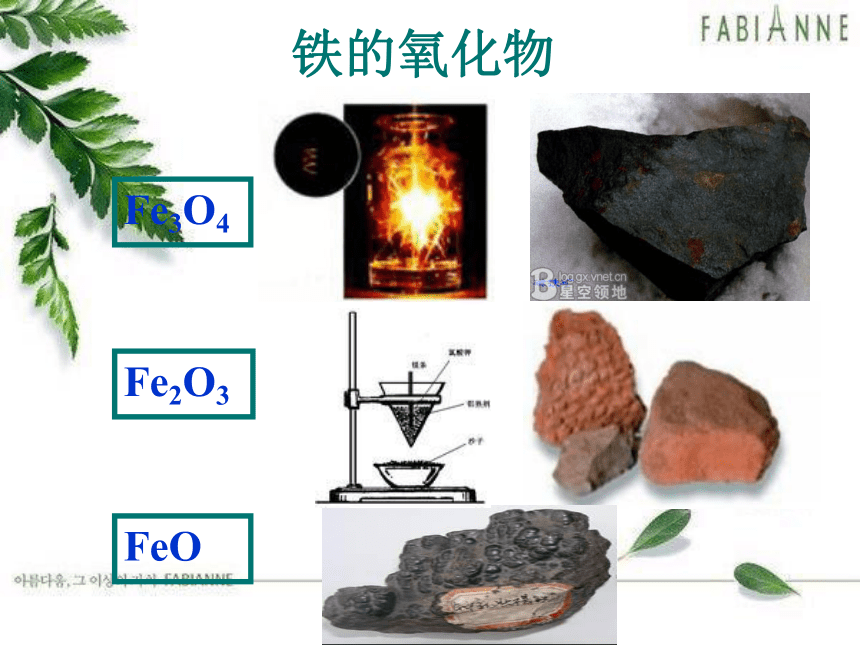
Fe2O3
FeO
铁的氧化物
Fe3O4
一、铁 的 氧 化 物
化学式 FeO Fe2O3 Fe3O4
俗名
----------
铁红
磁性氧化铁
红棕色粉末
黑色粉末
色态
黑色晶体
铁的化合价
+3
+2
+2 +3
水溶性
不溶于水
不溶于水
不溶于水
与酸反应
FeO + HCl
FeCl2 +H2O
Fe2O3 +HCl
FeCl3 +H2O
Fe3O4 +HCl
FeCl3 + FeCl2 +H2O
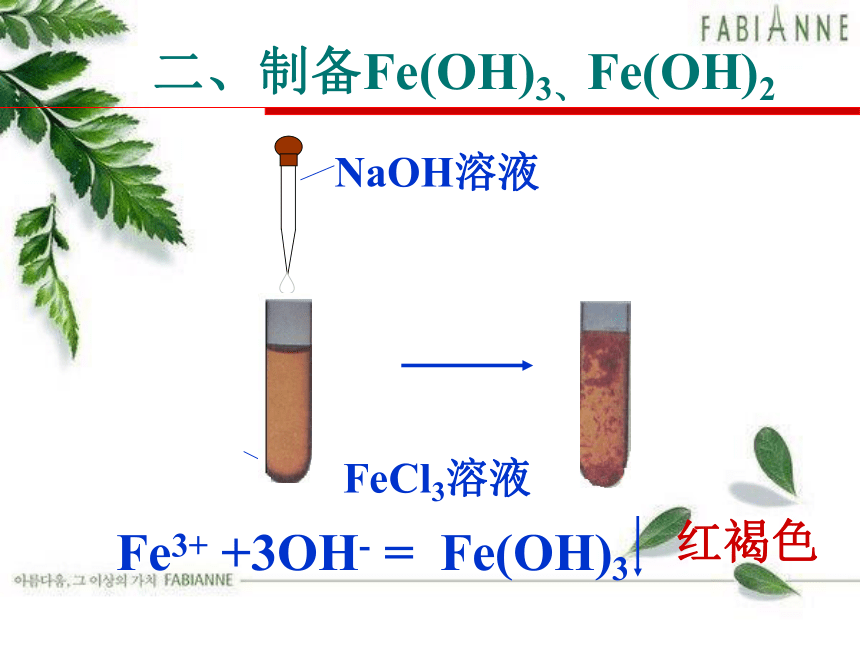
FeCl3溶液
NaOH溶液
Fe3+ +3OH- = Fe(OH)3
红褐色
二、制备Fe(OH)3、Fe(OH)2
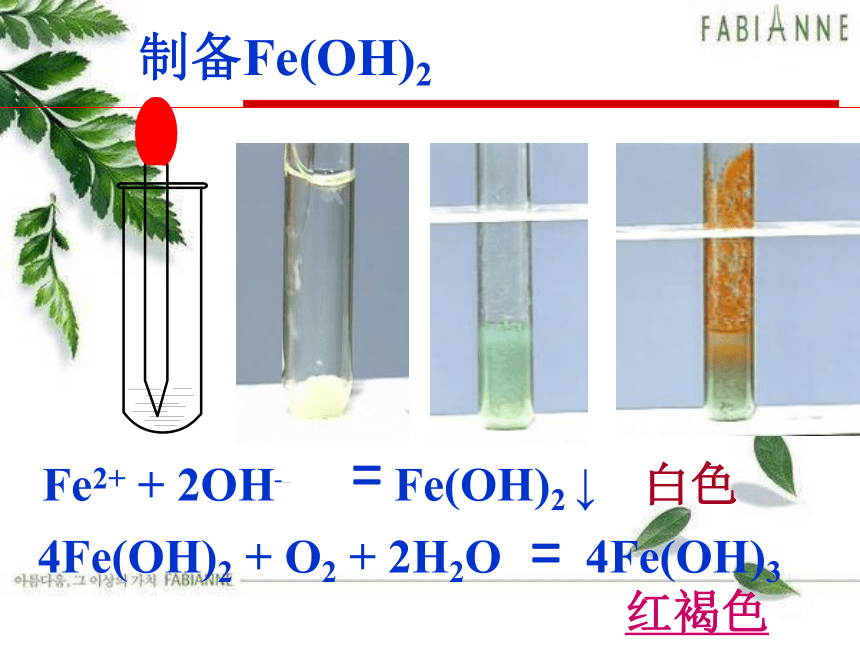
Fe2+ + 2OH– Fe(OH)2 ↓
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
白色
=
=
红褐色
制备Fe(OH)2
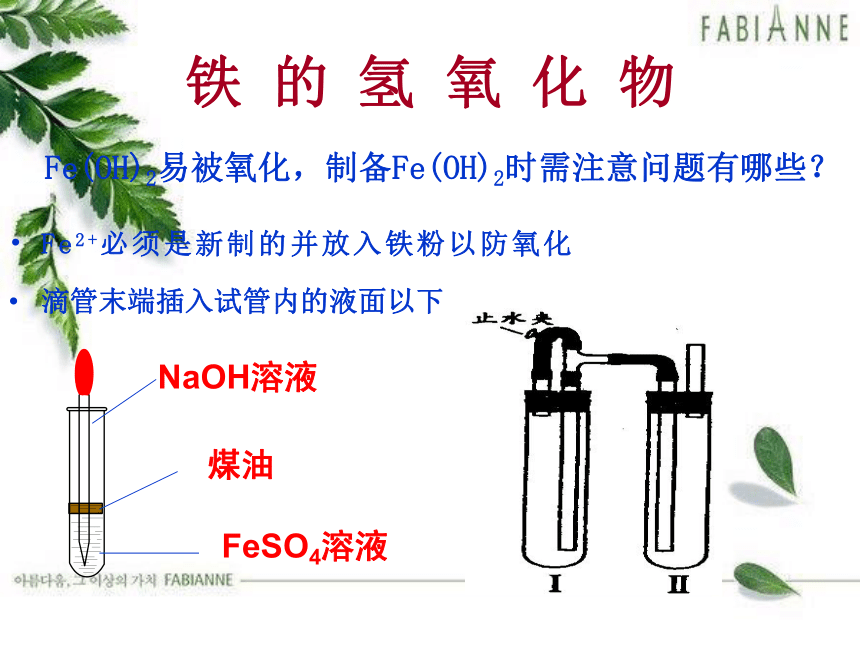
铁 的 氢 氧 化 物
Fe(OH)2易被氧化,制备Fe(OH)2时需注意问题有哪些?
滴管末端插入试管内的液面以下
Fe2+必须是新制的并放入铁粉以防氧化
煤油
FeSO4溶液
NaOH溶液
Fe(OH)2 Fe(OH)3
色态
溶解性
与强酸的反应
不稳定性
白色固体
红褐色固体
不溶于水
不溶于水
Fe(OH)2+2H+=Fe2+ +2H2O
Fe(OH)3+3H+=Fe3++3H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
现象:白色-灰绿色-红褐色
Fe(OH)3=Fe2O3+3H2O
铁的氢氧化物
铁 盐 和 亚 铁 盐
FeCl3 FeCl2
颜色
黄色 浅绿色
加碱
现象:白色沉淀→
灰绿色沉淀→红褐色沉淀
现象:红褐色沉淀
加KSCN
现象:溶液变为血红色
无明显现象
(一) Fe2+和Fe3+离子的检验
(1)
(2)
(3)
转化
铁 盐 和 亚 铁 盐
(二) Fe2+和Fe3+离子的转化
②FeSO4溶液
①FeCl3溶液
Fe粉
H2O2
KSCN
KSCN
无色
血红色
2Fe3++Fe=3Fe2+
2Fe2+ +H2O2+2H+ =2Fe3+ +2H2O
实验
②FeSO4溶液
①FeCl3溶液
KI溶液
KMnO4溶液
思考: 还有哪些物质能还原Fe3+ 或 能氧化Fe2+
黄色
蓝色
棕黄色
淀粉
I2
紫红色褪去
5Fe2+ + MnO4- + 8H+ =5Fe3+ + Mn2++4H2O
2Fe3+ + 2I- =2Fe2+ + I2
铁 盐 和 亚 铁 盐
铁 盐 和 亚 铁 盐
1. Fe2+→ Fe3+
氧化剂 : 02 Cl2 HNO3 MnO4-(H+)
2. Fe3+→ Fe2+
还原剂:Zn Fe Cu I - S2- 等
Fe
Fe3+
Fe2+
思考:用已学习的知识,选择具体的物质,填图。
(Cl2、Br2、稀HNO3 热浓H2SO4、KMnO4)
强氧化剂
弱氧化剂
(I2、S、H+、Cu2+)
强氧化剂
(O2 、Cl2、Br2、H2O2、 HNO3)
还原剂
(Zn、Fe、Cu、SO2、H2、 H2S、S2- 、I-)
还原剂
还原剂
铁三角
电路板是由高分子和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。
①请写出离子方程式。
②如何从废液中回收铜?
③如何使废液循环利用?
2Fe3++Cu=2Fe2++Cu2+
Fe+Cu2+ = Fe2++Cu
2Fe2+ + Cl2 =2Fe3++2Cl-
练习题
①FeCl3溶液
KSCN溶液
溶液呈血红色
Fe3++3SCN - = Fe(SCN)3
Fe2++SCN – = [Fe(SCN)] +
无色
络合反应
原因:
(灵敏)
血红色
应用: Fe3+检验
Fe2O3
FeO
铁的氧化物
Fe3O4
一、铁 的 氧 化 物
化学式 FeO Fe2O3 Fe3O4
俗名
----------
铁红
磁性氧化铁
红棕色粉末
黑色粉末
色态
黑色晶体
铁的化合价
+3
+2
+2 +3
水溶性
不溶于水
不溶于水
不溶于水
与酸反应
FeO + HCl
FeCl2 +H2O
Fe2O3 +HCl
FeCl3 +H2O
Fe3O4 +HCl
FeCl3 + FeCl2 +H2O
FeCl3溶液
NaOH溶液
Fe3+ +3OH- = Fe(OH)3
红褐色
二、制备Fe(OH)3、Fe(OH)2
Fe2+ + 2OH– Fe(OH)2 ↓
4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3
白色
=
=
红褐色
制备Fe(OH)2
铁 的 氢 氧 化 物
Fe(OH)2易被氧化,制备Fe(OH)2时需注意问题有哪些?
滴管末端插入试管内的液面以下
Fe2+必须是新制的并放入铁粉以防氧化
煤油
FeSO4溶液
NaOH溶液
Fe(OH)2 Fe(OH)3
色态
溶解性
与强酸的反应
不稳定性
白色固体
红褐色固体
不溶于水
不溶于水
Fe(OH)2+2H+=Fe2+ +2H2O
Fe(OH)3+3H+=Fe3++3H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
现象:白色-灰绿色-红褐色
Fe(OH)3=Fe2O3+3H2O
铁的氢氧化物
铁 盐 和 亚 铁 盐
FeCl3 FeCl2
颜色
黄色 浅绿色
加碱
现象:白色沉淀→
灰绿色沉淀→红褐色沉淀
现象:红褐色沉淀
加KSCN
现象:溶液变为血红色
无明显现象
(一) Fe2+和Fe3+离子的检验
(1)
(2)
(3)
转化
铁 盐 和 亚 铁 盐
(二) Fe2+和Fe3+离子的转化
②FeSO4溶液
①FeCl3溶液
Fe粉
H2O2
KSCN
KSCN
无色
血红色
2Fe3++Fe=3Fe2+
2Fe2+ +H2O2+2H+ =2Fe3+ +2H2O
实验
②FeSO4溶液
①FeCl3溶液
KI溶液
KMnO4溶液
思考: 还有哪些物质能还原Fe3+ 或 能氧化Fe2+
黄色
蓝色
棕黄色
淀粉
I2
紫红色褪去
5Fe2+ + MnO4- + 8H+ =5Fe3+ + Mn2++4H2O
2Fe3+ + 2I- =2Fe2+ + I2
铁 盐 和 亚 铁 盐
铁 盐 和 亚 铁 盐
1. Fe2+→ Fe3+
氧化剂 : 02 Cl2 HNO3 MnO4-(H+)
2. Fe3+→ Fe2+
还原剂:Zn Fe Cu I - S2- 等
Fe
Fe3+
Fe2+
思考:用已学习的知识,选择具体的物质,填图。
(Cl2、Br2、稀HNO3 热浓H2SO4、KMnO4)
强氧化剂
弱氧化剂
(I2、S、H+、Cu2+)
强氧化剂
(O2 、Cl2、Br2、H2O2、 HNO3)
还原剂
(Zn、Fe、Cu、SO2、H2、 H2S、S2- 、I-)
还原剂
还原剂
铁三角
电路板是由高分子和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”。
①请写出离子方程式。
②如何从废液中回收铜?
③如何使废液循环利用?
2Fe3++Cu=2Fe2++Cu2+
Fe+Cu2+ = Fe2++Cu
2Fe2+ + Cl2 =2Fe3++2Cl-
练习题
①FeCl3溶液
KSCN溶液
溶液呈血红色
Fe3++3SCN - = Fe(SCN)3
Fe2++SCN – = [Fe(SCN)] +
无色
络合反应
原因:
(灵敏)
血红色
应用: Fe3+检验
