胶体的性质
图片预览





文档简介
(共18张PPT)
普通高中课程标准实验教科书《化学1必修》人教版
分散系及其分类
----第二课时
思考与交流:
2、溶液和浊液有什么区别和联系?
联系
分散系
区别
溶液和浊液
分析:
1、将少量硫酸铜固体溶于水得到的体系是纯净物还是
混合物?将泥沙加到水中得到的体系呢?将它们静置一段时间后,有什么区别?
前者属于被分散物质,称做分散质;
1、分散系、分散质、分散剂有关概念
把一种(或多种)物质分散在另一种(或多种)物质所得到的体系,叫做分散系;
后者起容纳分散质的作用,称做分散剂。
例:
分散系是: 。
分散质是: 。
分散剂是: 。
氯化钠的水溶液
氯化钠的水溶液
氯化钠
水
一、分散系及其分类
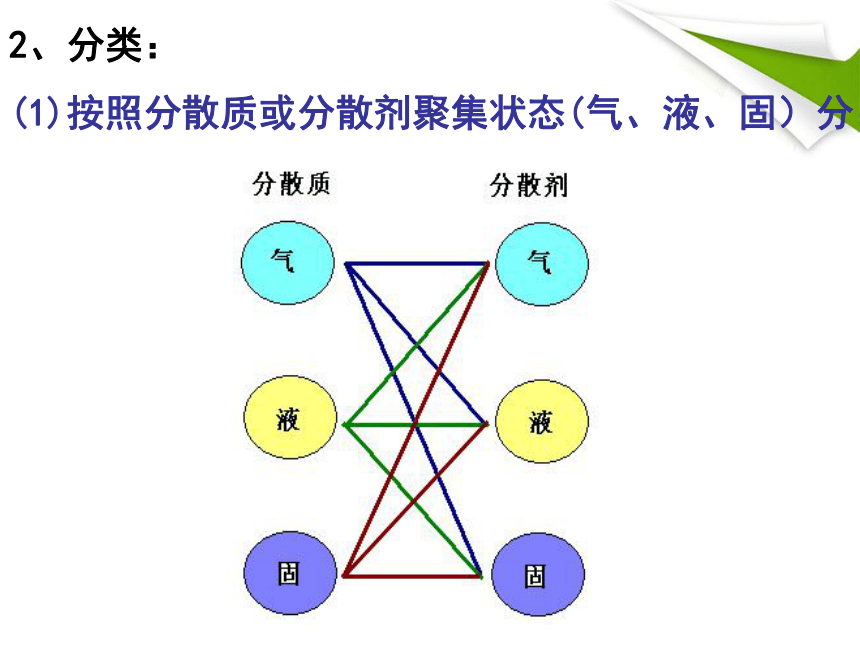
(1)按照分散质或分散剂聚集状态(气、液、固)分:
2、分类:
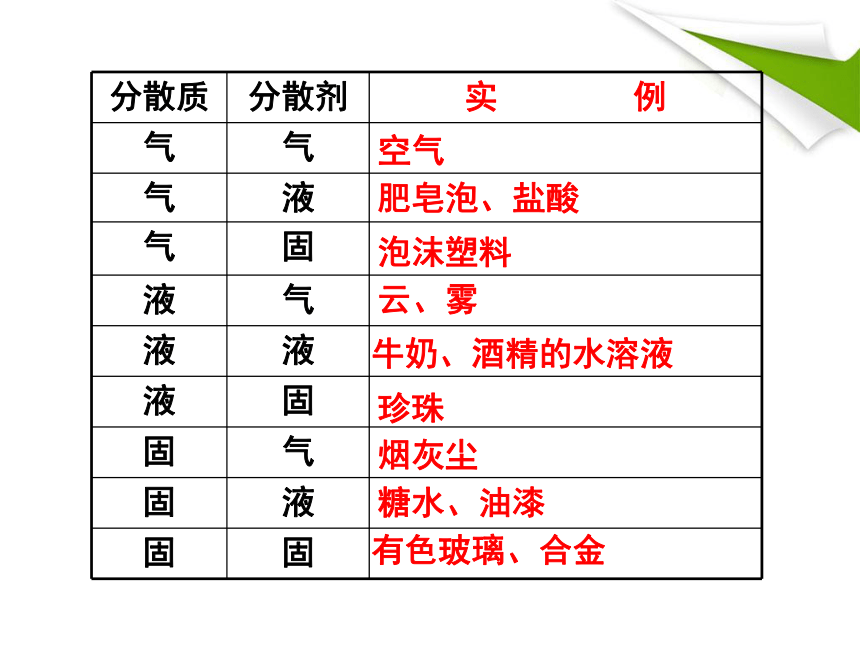
分散质 分散剂 实 例
气 气
气 液
气 固
液 气
液 液
液 固
固 气
固 液
固 固
空气
云、雾
烟灰尘
肥皂泡、盐酸
牛奶、酒精的水溶液
糖水、油漆
泡沫塑料
珍珠
有色玻璃、合金
分散系 溶质粒子(本质特征) 主要特征 实例
溶液
胶体
浊液
<1nm
>100nm
1~100nm
稳定、均一
较稳定、均一
不稳定、不均一
食盐水
豆浆、牛奶
泥浆水
(2)按照分散质粒子的大小,分散系通常分为:
【实验1】
取小烧杯,分别加入25 mL 蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1-2 mL FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热
二、实验探究
【探究1】
1、胶体的制备
2、胶体、溶液、浊液外观特征的比较
结论:
胶体和溶液都属于均一、稳定的分散系,
浊液属于不均一、不稳定的分散系。
静置一段时间后:
注意: a. 水加热至沸腾
b.逐滴加入饱和的FeCl3溶液
c.继续煮沸至溶液呈红褐色,停止加热
条件:饱和FeCl3溶液、沸水
FeCl3 + 3H2O △ Fe(OH)3(胶体)+3HCl
FeCl3溶液中存在微弱的水解,生成极少量的Fe(OH)3 加
热, 加大水解程度, 使Fe(OH)3聚集成较大颗粒 —胶体
Fe(OH)3胶体的制备:
返回
【实验2】
将盛有CuSO4溶液、和Fe(OH)3(水)分散系的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象
返回
验证Fe(OH)3胶体和CuSO4溶液是否发生丁达尔效应
结论:
胶体能发生丁达尔效应,而溶液不能
【探究2】
当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”,这种现象叫丁达尔现象,也叫丁达尔效应。
原因:在光的传播过程中,光线照射到粒子时如果粒子小于入射光波长,则发生光的散射,丁达尔效应就是光的散射现象
丁达尔效应是区别溶液与胶体常用的物理方法
【实验3】
将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象
【探究3】
结论:
胶体粒子可以通过滤纸空隙,浊液粒子则不行
分离胶体与浊液的一种常用的物理方法
分散系 溶液 胶体 浊液
分散质粒子的直径 <1nm 介于1-100nm >100nm
分散质粒子 单个小分子或离子 许多分子集合体或高分子 巨大数目分子集合体
性
质 外观、稳定性 均匀、透明 、稳定 均匀、半透明
较稳定 不均匀、不透明、不稳定
能否产生丁达尔效应 不能 能 不能
能否透过滤纸 能 能 不能
归纳总结:
自然界中的丁达尔现象
烟水晶
有色玻璃
普通高中课程标准实验教科书《化学1必修》人教版
分散系及其分类
----第二课时
思考与交流:
2、溶液和浊液有什么区别和联系?
联系
分散系
区别
溶液和浊液
分析:
1、将少量硫酸铜固体溶于水得到的体系是纯净物还是
混合物?将泥沙加到水中得到的体系呢?将它们静置一段时间后,有什么区别?
前者属于被分散物质,称做分散质;
1、分散系、分散质、分散剂有关概念
把一种(或多种)物质分散在另一种(或多种)物质所得到的体系,叫做分散系;
后者起容纳分散质的作用,称做分散剂。
例:
分散系是: 。
分散质是: 。
分散剂是: 。
氯化钠的水溶液
氯化钠的水溶液
氯化钠
水
一、分散系及其分类
(1)按照分散质或分散剂聚集状态(气、液、固)分:
2、分类:
分散质 分散剂 实 例
气 气
气 液
气 固
液 气
液 液
液 固
固 气
固 液
固 固
空气
云、雾
烟灰尘
肥皂泡、盐酸
牛奶、酒精的水溶液
糖水、油漆
泡沫塑料
珍珠
有色玻璃、合金
分散系 溶质粒子(本质特征) 主要特征 实例
溶液
胶体
浊液
<1nm
>100nm
1~100nm
稳定、均一
较稳定、均一
不稳定、不均一
食盐水
豆浆、牛奶
泥浆水
(2)按照分散质粒子的大小,分散系通常分为:
【实验1】
取小烧杯,分别加入25 mL 蒸馏水,将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1-2 mL FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热
二、实验探究
【探究1】
1、胶体的制备
2、胶体、溶液、浊液外观特征的比较
结论:
胶体和溶液都属于均一、稳定的分散系,
浊液属于不均一、不稳定的分散系。
静置一段时间后:
注意: a. 水加热至沸腾
b.逐滴加入饱和的FeCl3溶液
c.继续煮沸至溶液呈红褐色,停止加热
条件:饱和FeCl3溶液、沸水
FeCl3 + 3H2O △ Fe(OH)3(胶体)+3HCl
FeCl3溶液中存在微弱的水解,生成极少量的Fe(OH)3 加
热, 加大水解程度, 使Fe(OH)3聚集成较大颗粒 —胶体
Fe(OH)3胶体的制备:
返回
【实验2】
将盛有CuSO4溶液、和Fe(OH)3(水)分散系的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象
返回
验证Fe(OH)3胶体和CuSO4溶液是否发生丁达尔效应
结论:
胶体能发生丁达尔效应,而溶液不能
【探究2】
当一束光线透过胶体,从入射光的垂直方向可以观察到胶体里出现的一条光亮的“通路”,这种现象叫丁达尔现象,也叫丁达尔效应。
原因:在光的传播过程中,光线照射到粒子时如果粒子小于入射光波长,则发生光的散射,丁达尔效应就是光的散射现象
丁达尔效应是区别溶液与胶体常用的物理方法
【实验3】
将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象
【探究3】
结论:
胶体粒子可以通过滤纸空隙,浊液粒子则不行
分离胶体与浊液的一种常用的物理方法
分散系 溶液 胶体 浊液
分散质粒子的直径 <1nm 介于1-100nm >100nm
分散质粒子 单个小分子或离子 许多分子集合体或高分子 巨大数目分子集合体
性
质 外观、稳定性 均匀、透明 、稳定 均匀、半透明
较稳定 不均匀、不透明、不稳定
能否产生丁达尔效应 不能 能 不能
能否透过滤纸 能 能 不能
归纳总结:
自然界中的丁达尔现象
烟水晶
有色玻璃
