离子键
图片预览








文档简介
(共53张PPT)
第三节 化学键
课堂互动讲练
探究整合应用
知能优化训练
第三节
课前自主学案
学习目标
1.了解离子键、共价键、离子化合物、共价化合物的概念。
2.了解化学键的概念,会用电子式表示化合物及其形成过程。
3.了解物质变化过程中化学键的变化。
学习目标
课前自主学案
一、离子键
1.离子键
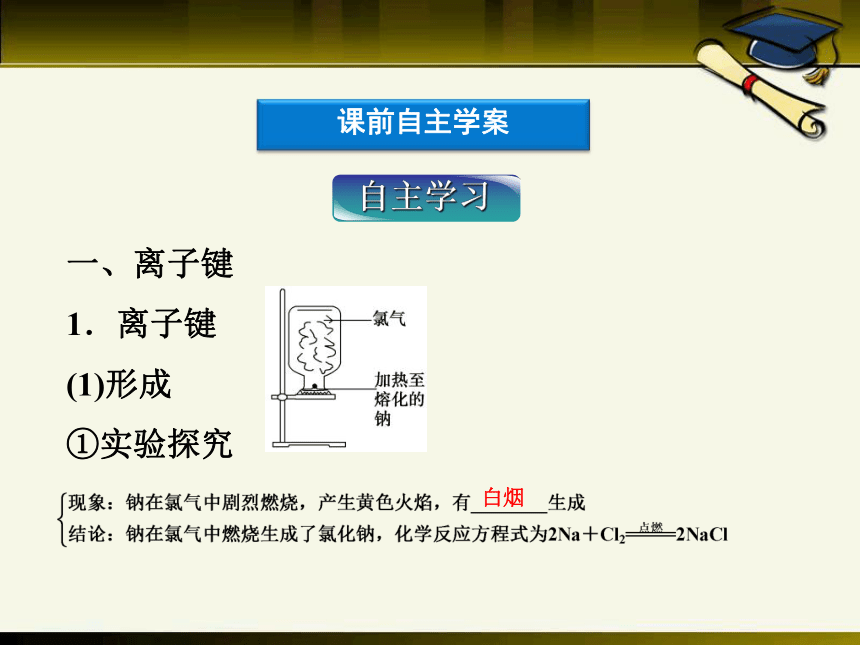
(1)形成
①实验探究
自主学习
白烟
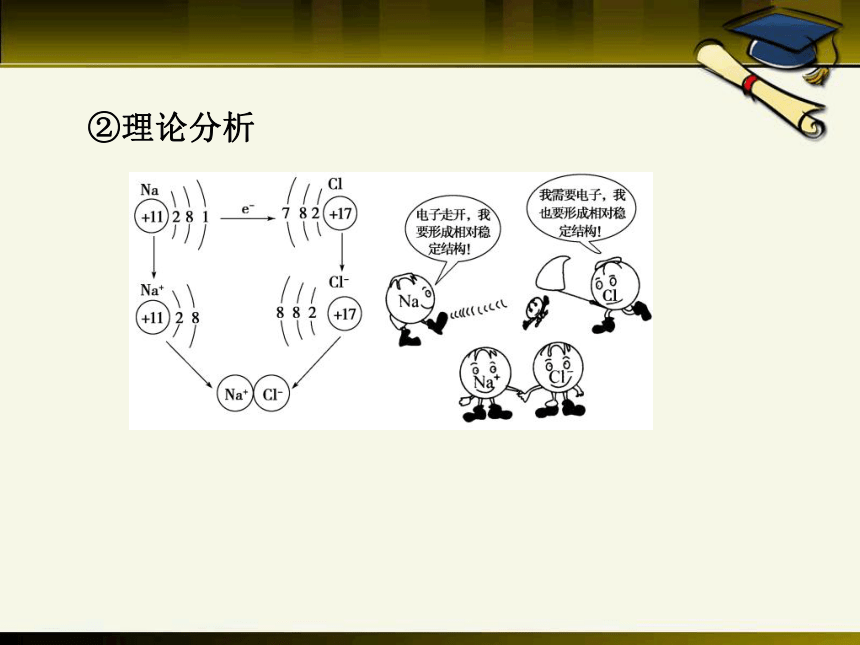
②理论分析
(2)定义及其理解
_______________之间的相互作用称为离子键。
①成键粒子:________________。
②成键元素:一般是______________元素和
_________________元素。
2.离子化合物
(1)定义:由__________构成的化合物。
(2)常见物质
①强碱:如________________________等。
带相反电荷离子
阴、阳离子
活泼金属
活泼非金属
离子键
NaOH、KOH、Ba(OH)2
②绝大多数盐:如NaCl、KClO3、K2SO4等。
③金属氧化物:如____________________等。
(3)表示方法
①电子式:在元素符号周围用“·”或“×”来表示__________________的式子。如:
Na2O、CaO、K2O
原子最外层电子
原子:Na:Na×、Mg:__________、Cl:
________ ·、S: ________
阳离子:Na+:Na+、Mg2+:____________
阴离子:Cl-:_____________、S2-:
_____________
×Mg×
Mg2+
②用电子式表示离子化合物的形成过程
二、共价键
1.共价键
(1)形成(以Cl2形成为例)
用电子式表示:_______________________
(2)定义及其理解
原子间通过_____________所形成的相互作用。
①成键粒子:__________。
②成键元素:一般是同种或不同种__________元素。
共用电子对
原子
非金属
(3)存在
①非金属元素的多原子单质,如
_______________。
②共价化合物,如CO2、HCl、H2SO4。
③某些离子化合物,
如NaOH、Na2O2、NH4Cl。
④分类
H2、O2、N2
2.共价化合物:以_____________形成分子的化合物。
3.含有共价键分子的表示方法
(1)用电子式、结构式表示含共价键的粒子
共用电子对
H—O—H
O==C==O
思考感悟
1.(1)只有共价化合物中才含有共价键吗?
(2)如何判断某共价键是极性键还是非极性键?
【提示】 (1)不是。共价化合物中一定含有共价键,单质和离子化合物中也可能含有共价键,如H2、O2、Cl2、NH4Cl、NaOH等均含有共价键。
(2)可根据成键元素的种类来判断。若成键元素相同,如X—X型,则为非极性键;若成键元素不同,如X—Y型,则为极性键。
三、化学键
1.概念:使_______相结合或______相结合的作用力。
2.分类
离子
原子
高子键
共价键
3.化学反应的本质
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
思考感悟
2.所有的物质中都含有化学键吗?
【提示】 不是。稀有气体的分子都是单原子分子,分子中不存在化学键。
四、分子间作用力和氢键
1.分子间作用力:分子之间存在的一种把分子聚集在一起的作用力,又称__________。分子间作用力比化学键弱的多,对物质的熔、沸点等有影响。
2.氢键:分子之间存在的一种比分子间作用力稍强的相互作用。氢键比化学键弱,但比分子间作用力强。氢键对物质的一些物理性质有影响,如熔、沸点,密度等。
范德华力
自主体验
2.下列叙述正确的是(双选)( )
A.两个非金属原子间不可能形成离子键
B.非金属原子间不可能形成离子化合物
C.共价化合物中可能有离子键
D.离子化合物中可能有共价键
解析:选AD。A项正确,因为两个非金属原子间不能得失电子,不能形成离子键;非金属原子间能形成离子化合物,如NH4Cl、(NH4)2SO4等,所以B项错;有离子键就应是离子化合物,共价化合物中不可能有离子键,C项错;有的离子化合物中阳离子原子团或阴离子原子团内有共价键,如NH4Cl中N—H键是共价键,即D项正确。
3.(2011年焦作高一检测)根据成键元素判断下列化合物中含有非极性共价键的是( )
A.KCl
B.H2O2
C.H2SO4
D.MgO
而共价键的形成条件是两非金属原子间,不同的两非金属原子之间形成极性共价键,例如H与O、C、S、P等元素之间的共价键是极性共价键,同种元素两原子间形成非极性共价键,例如O2、H2等分子中含有非极性共价键。
课堂互动讲练
1.离子键与共价键的比较
离子键与共价键、离子化合物与共价化合物的比较
离子键 共价键
概念 带相反电荷的离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
离子键 共价键
成键粒子 阴、阳离子 原子
形成条件 活泼金属元素与活泼非金属元素化合 同种或不同种非金属元素化合
存在 离子化合物中 绝大多数非金属单质、共价化合物、某些离子化合物中
2.离子化合物和共价化合物的比较
离子化合物 共价化合物
定义 阴、阳离子之间以离子键相结合形成的化合物 原子间以共用电子对形成的化合物
构成粒子 阴、阳离子 原子
粒子间的作用 离子键 共价键
熔、沸点 较高 一般较低,少部分很高(如SiO2)
离子化合物 共价化合物
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破
坏的作用力 一定破坏离子键 一般不破坏共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
特别提醒:(1)存在离子键的化合物一定是离子化合物。
(2)共价化合物中只含共价键,不含离子键,只含共价键的物质不一定是共价化合物,可能是非金属单质。
(2011年哈尔滨高一检测)关于化学键的各种叙述中正确的是( )
A.在离子化合物里,只存在离子键
B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由不同元素组成的多原子分子里,一定只存在极性键
例1
【答案】 B
【误区警示】 对于化学键(包括离子键和共价键)和离子化合物及共价化合物的概念辨析及判断是该部分知识出错率较高的,常犯错误有:
(1)离子化合物中只有离子键(×),还可存在共价键(√)。
(2)离子化合物中必有金属元素(×),铵盐也是离子化合物(√)。
(3)共价化合物中一定无离子键(√),一定无金属元素(×),如AlCl3。
(4)极性键只存在于共价化合物中(×),非极性键只能存在于单质分子中(×),前者如NaOH,后者如Na2O2、H2O2等。
变式训练1 下列说法正确的是( )
A.P4和NO2都是共价化合物
B.CCl4和NH3分子中都含有极性键
C.CaO和SiO2都是离子化合物
D.Na2O2是离子化合物,只含有离子键
物质的变化过程中化学键的变化
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如:
H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如:
H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程
3.共价化合物的溶解或熔化过程
(1)溶解
4.单质的熔化或溶解过程
单质的特点 化学键变化 举例
由分子构成的固体单质 熔化或升华时只破坏分子间作用力,不破坏化学键 P4的熔化,I2的升华
由原子构成的单质 熔化时破坏共价键 金刚石或晶体硅
能与水反应的某些活泼非金属单质 溶于水后,分子内共价键被破坏 Cl2、F2等
特别提醒:(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等。只有旧化学键的断裂而没有新化学键的生成,故不是化学变化。
例2
【解析】 化学变化肯定存在化学键的破坏,物理变化过程要注意分析过程才能确定。A、C两项发生的都是化学变化,加热NH4Cl破坏了NH4Cl内的离子键和共价键;水通电分解破坏了水分子内的共价键;D项中,HCl溶于水,破坏了HCl分子内的共价键;B项中,干冰升华没有化学键的破坏,只是破坏了分子间作用力。
【答案】 B
【规律方法】 解答时首先要明确构成物质的微粒是分子、原子还是离子,确定构成物质的微粒间的相互作用属于离子键、共价键还是分子间作用力,然后根据物质的变化分析解答,并注意化学变化过程中一定有旧化学键的破坏和新化学键的形成,物理变化过程中的化学键有的被破坏,如离子化合物的溶解和熔化,共价化合物中的酸等溶于水;共价化合物的汽化、升华一般不破坏化学键。
变式训练2 试分析下列各种情况下微粒间作用力的变化情况(填“离子键”、“极性键”、“非极性键”或“分子间作用力”):
(1)NaCl溶于水时破坏____________________;
(2)HCl溶于水时破坏____________________;
(3)SO2溶于水时破坏____________________;
(4)酒精溶于水时破坏____________________;
(5)2Na2O2+2CO2===2Na2CO3+O2,被破坏的有________________,形成的化学键有________________________________________________________________________。
解析:NaCl、HCl、SO2中分别含有离子键、极性键、极性键,溶于水时破坏相应的化学键;酒精溶于水时只破坏分子间作用力;可解决(1)、(2)、(3)、(4);而(5)是考查化学变化中化学键的变化情况,根据各物质中的化学键类型判断即可,破坏和形成的化学键有离子键、共价键(极性共价键和非极性共价键)。
答案:(1)离子键 (2)极性键 (3)极性键 (4)分子间作用力 (5)离子键、极性键、非极性键 极性键、非极性键、离子键
探究整合应用
请根据教材上的实验“钠与氯气反应”,完成下列问题。
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。
根据所学的知识分析该实
验存在哪些缺点?
①____________________________________;
②_____________________________________;
③ _____________________________________。
(至少填2条)
(2)某同学根据以上存在
的缺点改进实验装置,
如图所示:
实验步骤为:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有______生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:
a.____________,b.____________,c.____________(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式_______________________________________,并用电子式表示产物形成过程______________________。
④H2在Cl2中燃烧现象是________________________,并用电子式表示HCl形成过程
________________________________________________________________________。
【解析】 在回答问题时应根据反应原理,结合新装置的特点找出异同,从比较中去分析、综合,找到解决问题的思路。上述两个实验的不同在于一静一动。可从操作便利、易控制反应快慢、环境污染等方面分析。
【答案】 (1)①Na预先在空气中加热,会生成氧化物,可能影响Na在Cl2中燃烧 ②预先收集的Cl2在进行实验时可能不够或过量 ③实验过程中会造成污染
(2)①黄绿 黄 白烟 白色固体
②a.整个实验过程中氯气保持一定浓度和纯度,避免发生副反应
b.安全可靠,污染少
c.可以避免钠在加热时生成Na2O2
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
第三节 化学键
课堂互动讲练
探究整合应用
知能优化训练
第三节
课前自主学案
学习目标
1.了解离子键、共价键、离子化合物、共价化合物的概念。
2.了解化学键的概念,会用电子式表示化合物及其形成过程。
3.了解物质变化过程中化学键的变化。
学习目标
课前自主学案
一、离子键
1.离子键
(1)形成
①实验探究
自主学习
白烟
②理论分析
(2)定义及其理解
_______________之间的相互作用称为离子键。
①成键粒子:________________。
②成键元素:一般是______________元素和
_________________元素。
2.离子化合物
(1)定义:由__________构成的化合物。
(2)常见物质
①强碱:如________________________等。
带相反电荷离子
阴、阳离子
活泼金属
活泼非金属
离子键
NaOH、KOH、Ba(OH)2
②绝大多数盐:如NaCl、KClO3、K2SO4等。
③金属氧化物:如____________________等。
(3)表示方法
①电子式:在元素符号周围用“·”或“×”来表示__________________的式子。如:
Na2O、CaO、K2O
原子最外层电子
原子:Na:Na×、Mg:__________、Cl:
________ ·、S: ________
阳离子:Na+:Na+、Mg2+:____________
阴离子:Cl-:_____________、S2-:
_____________
×Mg×
Mg2+
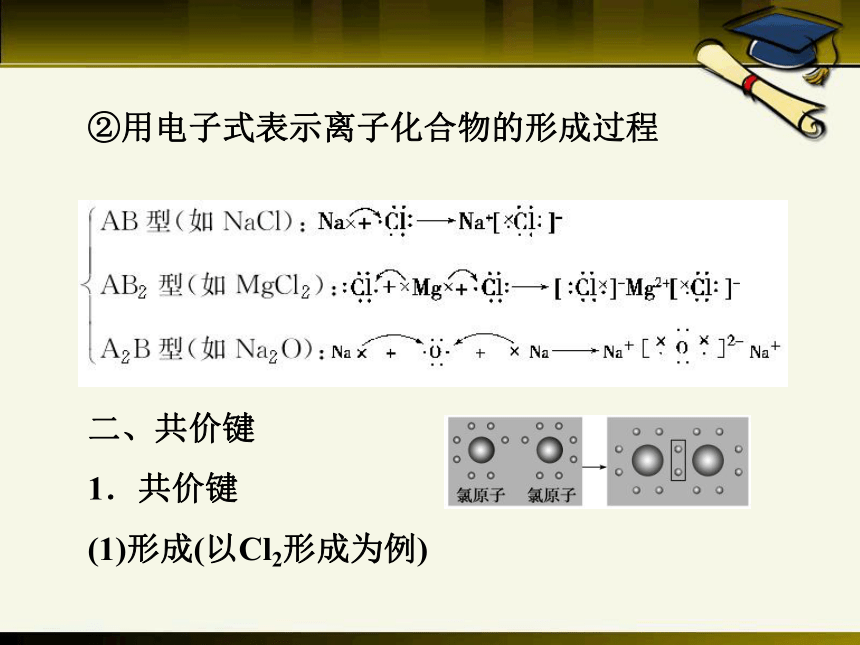
②用电子式表示离子化合物的形成过程
二、共价键
1.共价键
(1)形成(以Cl2形成为例)
用电子式表示:_______________________
(2)定义及其理解
原子间通过_____________所形成的相互作用。
①成键粒子:__________。
②成键元素:一般是同种或不同种__________元素。
共用电子对
原子
非金属
(3)存在
①非金属元素的多原子单质,如
_______________。
②共价化合物,如CO2、HCl、H2SO4。
③某些离子化合物,
如NaOH、Na2O2、NH4Cl。
④分类
H2、O2、N2
2.共价化合物:以_____________形成分子的化合物。
3.含有共价键分子的表示方法
(1)用电子式、结构式表示含共价键的粒子
共用电子对
H—O—H
O==C==O
思考感悟
1.(1)只有共价化合物中才含有共价键吗?
(2)如何判断某共价键是极性键还是非极性键?
【提示】 (1)不是。共价化合物中一定含有共价键,单质和离子化合物中也可能含有共价键,如H2、O2、Cl2、NH4Cl、NaOH等均含有共价键。
(2)可根据成键元素的种类来判断。若成键元素相同,如X—X型,则为非极性键;若成键元素不同,如X—Y型,则为极性键。
三、化学键
1.概念:使_______相结合或______相结合的作用力。
2.分类
离子
原子
高子键
共价键
3.化学反应的本质
一个化学反应的过程,本质上就是旧化学键的断裂和新化学键的形成的过程。
思考感悟
2.所有的物质中都含有化学键吗?
【提示】 不是。稀有气体的分子都是单原子分子,分子中不存在化学键。
四、分子间作用力和氢键
1.分子间作用力:分子之间存在的一种把分子聚集在一起的作用力,又称__________。分子间作用力比化学键弱的多,对物质的熔、沸点等有影响。
2.氢键:分子之间存在的一种比分子间作用力稍强的相互作用。氢键比化学键弱,但比分子间作用力强。氢键对物质的一些物理性质有影响,如熔、沸点,密度等。
范德华力
自主体验
2.下列叙述正确的是(双选)( )
A.两个非金属原子间不可能形成离子键
B.非金属原子间不可能形成离子化合物
C.共价化合物中可能有离子键
D.离子化合物中可能有共价键
解析:选AD。A项正确,因为两个非金属原子间不能得失电子,不能形成离子键;非金属原子间能形成离子化合物,如NH4Cl、(NH4)2SO4等,所以B项错;有离子键就应是离子化合物,共价化合物中不可能有离子键,C项错;有的离子化合物中阳离子原子团或阴离子原子团内有共价键,如NH4Cl中N—H键是共价键,即D项正确。
3.(2011年焦作高一检测)根据成键元素判断下列化合物中含有非极性共价键的是( )
A.KCl
B.H2O2
C.H2SO4
D.MgO
而共价键的形成条件是两非金属原子间,不同的两非金属原子之间形成极性共价键,例如H与O、C、S、P等元素之间的共价键是极性共价键,同种元素两原子间形成非极性共价键,例如O2、H2等分子中含有非极性共价键。
课堂互动讲练
1.离子键与共价键的比较
离子键与共价键、离子化合物与共价化合物的比较
离子键 共价键
概念 带相反电荷的离子之间的相互作用 原子之间通过共用电子对所形成的相互作用
成键方式 通过得失电子达到稳定结构 通过形成共用电子对达到稳定结构
离子键 共价键
成键粒子 阴、阳离子 原子
形成条件 活泼金属元素与活泼非金属元素化合 同种或不同种非金属元素化合
存在 离子化合物中 绝大多数非金属单质、共价化合物、某些离子化合物中
2.离子化合物和共价化合物的比较
离子化合物 共价化合物
定义 阴、阳离子之间以离子键相结合形成的化合物 原子间以共用电子对形成的化合物
构成粒子 阴、阳离子 原子
粒子间的作用 离子键 共价键
熔、沸点 较高 一般较低,少部分很高(如SiO2)
离子化合物 共价化合物
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破
坏的作用力 一定破坏离子键 一般不破坏共价键
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属的氢化物、非金属的氧化物
特别提醒:(1)存在离子键的化合物一定是离子化合物。
(2)共价化合物中只含共价键,不含离子键,只含共价键的物质不一定是共价化合物,可能是非金属单质。
(2011年哈尔滨高一检测)关于化学键的各种叙述中正确的是( )
A.在离子化合物里,只存在离子键
B.共价化合物里,一定不存在离子键
C.非极性键只存在于双原子的单质分子里
D.由不同元素组成的多原子分子里,一定只存在极性键
例1
【答案】 B
【误区警示】 对于化学键(包括离子键和共价键)和离子化合物及共价化合物的概念辨析及判断是该部分知识出错率较高的,常犯错误有:
(1)离子化合物中只有离子键(×),还可存在共价键(√)。
(2)离子化合物中必有金属元素(×),铵盐也是离子化合物(√)。
(3)共价化合物中一定无离子键(√),一定无金属元素(×),如AlCl3。
(4)极性键只存在于共价化合物中(×),非极性键只能存在于单质分子中(×),前者如NaOH,后者如Na2O2、H2O2等。
变式训练1 下列说法正确的是( )
A.P4和NO2都是共价化合物
B.CCl4和NH3分子中都含有极性键
C.CaO和SiO2都是离子化合物
D.Na2O2是离子化合物,只含有离子键
物质的变化过程中化学键的变化
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如:
H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
1.化学反应过程
化学反应过程中反应物一定有旧化学键被破坏和产物中新化学键的形成。如:
H2+F2===2HF,H—H键、F—F键均被破坏,形成H—F键。
2.离子化合物的溶解或熔化过程
3.共价化合物的溶解或熔化过程
(1)溶解
4.单质的熔化或溶解过程
单质的特点 化学键变化 举例
由分子构成的固体单质 熔化或升华时只破坏分子间作用力,不破坏化学键 P4的熔化,I2的升华
由原子构成的单质 熔化时破坏共价键 金刚石或晶体硅
能与水反应的某些活泼非金属单质 溶于水后,分子内共价键被破坏 Cl2、F2等
特别提醒:(1)化学反应中,并不是反应物中所有的化学键都被破坏,如(NH4)2SO4+BaCl2===BaSO4↓+2NH4Cl,只破坏反应物中的离子键,而共价键未被破坏。
(2)化学键被破坏的变化,不一定是化学变化,如NaCl、金刚石的受热熔化、NaCl溶于水等。只有旧化学键的断裂而没有新化学键的生成,故不是化学变化。
例2
【解析】 化学变化肯定存在化学键的破坏,物理变化过程要注意分析过程才能确定。A、C两项发生的都是化学变化,加热NH4Cl破坏了NH4Cl内的离子键和共价键;水通电分解破坏了水分子内的共价键;D项中,HCl溶于水,破坏了HCl分子内的共价键;B项中,干冰升华没有化学键的破坏,只是破坏了分子间作用力。
【答案】 B
【规律方法】 解答时首先要明确构成物质的微粒是分子、原子还是离子,确定构成物质的微粒间的相互作用属于离子键、共价键还是分子间作用力,然后根据物质的变化分析解答,并注意化学变化过程中一定有旧化学键的破坏和新化学键的形成,物理变化过程中的化学键有的被破坏,如离子化合物的溶解和熔化,共价化合物中的酸等溶于水;共价化合物的汽化、升华一般不破坏化学键。
变式训练2 试分析下列各种情况下微粒间作用力的变化情况(填“离子键”、“极性键”、“非极性键”或“分子间作用力”):
(1)NaCl溶于水时破坏____________________;
(2)HCl溶于水时破坏____________________;
(3)SO2溶于水时破坏____________________;
(4)酒精溶于水时破坏____________________;
(5)2Na2O2+2CO2===2Na2CO3+O2,被破坏的有________________,形成的化学键有________________________________________________________________________。
解析:NaCl、HCl、SO2中分别含有离子键、极性键、极性键,溶于水时破坏相应的化学键;酒精溶于水时只破坏分子间作用力;可解决(1)、(2)、(3)、(4);而(5)是考查化学变化中化学键的变化情况,根据各物质中的化学键类型判断即可,破坏和形成的化学键有离子键、共价键(极性共价键和非极性共价键)。
答案:(1)离子键 (2)极性键 (3)极性键 (4)分子间作用力 (5)离子键、极性键、非极性键 极性键、非极性键、离子键
探究整合应用
请根据教材上的实验“钠与氯气反应”,完成下列问题。
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。
根据所学的知识分析该实
验存在哪些缺点?
①____________________________________;
②_____________________________________;
③ _____________________________________。
(至少填2条)
(2)某同学根据以上存在
的缺点改进实验装置,
如图所示:
实验步骤为:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有______生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:
a.____________,b.____________,c.____________(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式_______________________________________,并用电子式表示产物形成过程______________________。
④H2在Cl2中燃烧现象是________________________,并用电子式表示HCl形成过程
________________________________________________________________________。
【解析】 在回答问题时应根据反应原理,结合新装置的特点找出异同,从比较中去分析、综合,找到解决问题的思路。上述两个实验的不同在于一静一动。可从操作便利、易控制反应快慢、环境污染等方面分析。
【答案】 (1)①Na预先在空气中加热,会生成氧化物,可能影响Na在Cl2中燃烧 ②预先收集的Cl2在进行实验时可能不够或过量 ③实验过程中会造成污染
(2)①黄绿 黄 白烟 白色固体
②a.整个实验过程中氯气保持一定浓度和纯度,避免发生副反应
b.安全可靠,污染少
c.可以避免钠在加热时生成Na2O2
知能优化训练
本部分内容讲解结束
点此进入课件目录
按ESC键退出全屏播放
谢谢使用
