乙烯
图片预览







文档简介
(共25张PPT)
第五章 第三节
乙烯
乙烯的分子结构
乙烯的实验室制取
乙烯化学性质
乙烯的用途
乙烯的物理性质
练习题
GO
GO
GO
GO
GO
GO
一、乙烯的物理性质
1.无色、稍有气味的气体。
2.难溶于水。
3.密度比空气略小。( 标准状况:1.25 g/L )
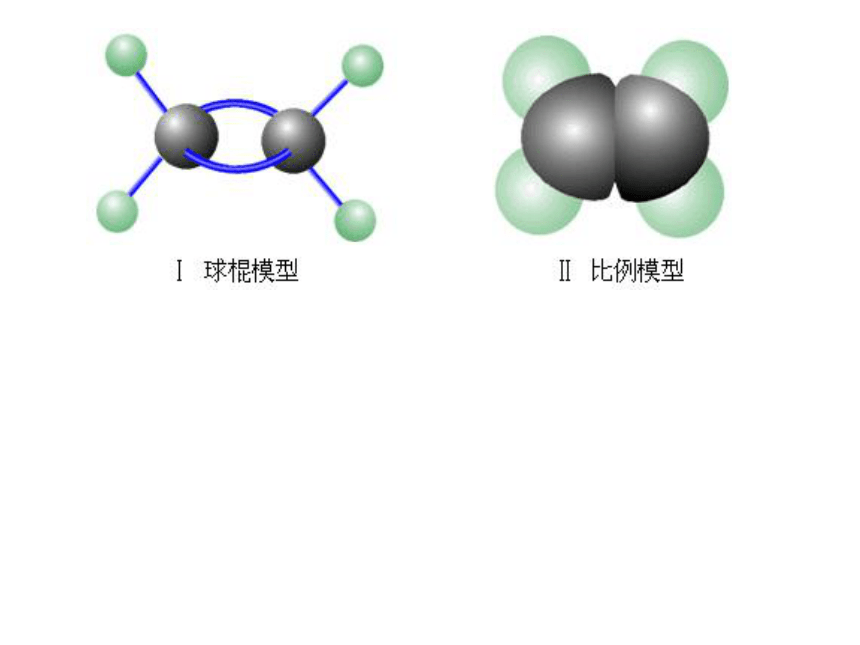
二、乙烯的结构
与乙烷相比少两个氢原子,由于氢原子较稀少,我们称它乙烯。
C原子为满足4个价键,碳碳键必须以双键存在。
请书写出乙烯分子的电子式和结构式 ?
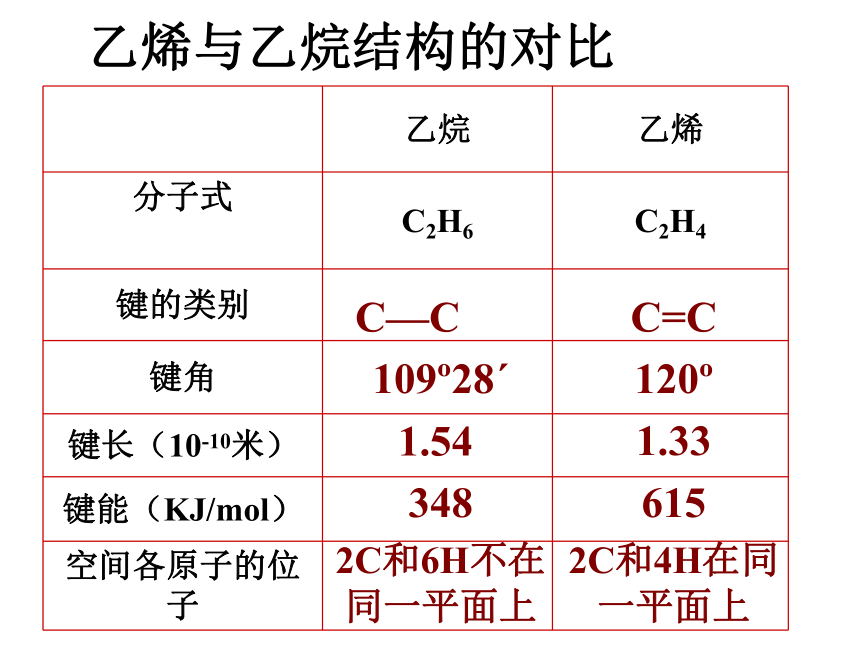
乙烯与乙烷结构的对比
乙烷 乙烯
分子式
C2H6 C2H4
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子的位子
C—C
109 28ˊ
1.54
348
2C和6H不在同一平面上
C=C
120
1.33
615
2C和4H在同一平面上
结构小结
C=C的键能并不是C-C的两倍,说明C=C双键中有一个键不稳定,容易断裂,有一个键较稳定。
三、乙烯的实验室制取
实验室常用乙醇来制取乙烯
1.原理:
2.装置:
液+液 需 加热的发生装置
3.收集:排水法
4.性质实验
(1)将乙烯气体通入到酸性高锰酸钾溶液中
(2)将乙烯气体通入到溴水中
(3)将乙烯气体点燃
4.性质实验
思考:
1、由乙醇变成乙烯,从分子组成的角度看,还应有什么产物?
2、要从乙醇分子中去掉一个水分子,,选用什么试剂?它在反应中起了什么作用?用量呢?
需注意的问题:
(1)浓硫酸:催化剂、脱水剂。 浓硫酸与乙醇的体积比为 3:1
(3)温度计的位置:
(4)碎瓷片或沸石的作用:
(2)反应温度:170℃
液面以下
防止暴沸
需控制温度的原因:
一、140 ℃时 分子间脱水生成乙醚和水
二、其它温度也不能有效生成乙烯
C2H5OH 2C+3H2O
浓硫酸
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
四、乙烯化学性质: 1、氧化反应
(1)可燃性
(产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光)
(2)被氧化剂氧化
KMnO4 + H2SO4+ C2H4→ MnSO4+ K2SO4+ CO2↑+ H2O
可使酸性高锰酸钾褪色
四、乙烯化学性质: 2、加成反应
有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应
完成:
CH2=CH2 + H—H →
H—X(必须是气体) →
H—OH(必须是蒸气) →
加成反应
四、乙烯化学性质:3、聚合反应
聚合反应(加聚反应):分子量小的化合物分子互相结合成分子量大的化合物的反应。
加聚反应的实质是:
不饱和键的断裂和相互加成。
根本原因是含有不饱和的C=C双键
五、乙烯的用途
(1)有机化工原料等。
(2)植物生长调节剂,催熟剂等。
练习:
3、碎瓷片的作用是什么?
4、温度计水银球的位置如何?反应为什么要迅速升高温度?
5、浓H2SO4 有何作用?为什么要过量?
6、反应液为什么会变黑?
1、收集的乙烯中主要有哪些杂质?
2、如何证明制得的气体中含有SO2 ?
实验室制乙烯中:
练习:
下列关于乙烯和乙烷相比较的说法中,不正确的是
A.乙烯能使酸性高锰酸钾溶液褪色,乙烷不能
B.乙烯属于不饱和链烃,乙烷属于饱和链烃
C.乙烯分子中的碳碳双键和乙烷分子中的碳碳单键相比较,双键的键能大,键长长
D.乙烯分子中的所有原子处于同一平面上,乙烷分子则为立体结构,原子不在同一平面上
练习:
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯,得到纯净乙烷的方法是
A.与足量溴单质反应 B.通入足量溴水中
C.在一定条件下通入氢气 D.分别进行燃烧
练习:
下列物质不能用加成反应得到的是
A. B.
C. D.
练习:
下列反应不能体现乙烯的不饱和性的是
练习:
1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气
A.1mol B.4mol
C.5mol D.6mol
练习:
一种气态烷烃和气态烯烃组成的混合物共10g,混合气密度是相同状况下H2密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4g,组成该混合气体的可能是
A.乙烯和乙烷 B.乙烷和丙烷
C.甲烷和乙烯 D.乙烯和丙烷
第五章 第三节
乙烯
乙烯的分子结构
乙烯的实验室制取
乙烯化学性质
乙烯的用途
乙烯的物理性质
练习题
GO
GO
GO
GO
GO
GO
一、乙烯的物理性质
1.无色、稍有气味的气体。
2.难溶于水。
3.密度比空气略小。( 标准状况:1.25 g/L )
二、乙烯的结构
与乙烷相比少两个氢原子,由于氢原子较稀少,我们称它乙烯。
C原子为满足4个价键,碳碳键必须以双键存在。
请书写出乙烯分子的电子式和结构式 ?
乙烯与乙烷结构的对比
乙烷 乙烯
分子式
C2H6 C2H4
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子的位子
C—C
109 28ˊ
1.54
348
2C和6H不在同一平面上
C=C
120
1.33
615
2C和4H在同一平面上
结构小结
C=C的键能并不是C-C的两倍,说明C=C双键中有一个键不稳定,容易断裂,有一个键较稳定。
三、乙烯的实验室制取
实验室常用乙醇来制取乙烯
1.原理:
2.装置:
液+液 需 加热的发生装置
3.收集:排水法
4.性质实验
(1)将乙烯气体通入到酸性高锰酸钾溶液中
(2)将乙烯气体通入到溴水中
(3)将乙烯气体点燃
4.性质实验
思考:
1、由乙醇变成乙烯,从分子组成的角度看,还应有什么产物?
2、要从乙醇分子中去掉一个水分子,,选用什么试剂?它在反应中起了什么作用?用量呢?
需注意的问题:
(1)浓硫酸:催化剂、脱水剂。 浓硫酸与乙醇的体积比为 3:1
(3)温度计的位置:
(4)碎瓷片或沸石的作用:
(2)反应温度:170℃
液面以下
防止暴沸
需控制温度的原因:
一、140 ℃时 分子间脱水生成乙醚和水
二、其它温度也不能有效生成乙烯
C2H5OH 2C+3H2O
浓硫酸
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
四、乙烯化学性质: 1、氧化反应
(1)可燃性
(产生黑烟是因为含碳量高,燃烧不充分;火焰明亮是碳微粒受灼热而发光)
(2)被氧化剂氧化
KMnO4 + H2SO4+ C2H4→ MnSO4+ K2SO4+ CO2↑+ H2O
可使酸性高锰酸钾褪色
四、乙烯化学性质: 2、加成反应
有机物分子中双键(或三键)两端的碳原子与其他原子或原子团直接结合生成新的化合物的反应,叫做加成反应
完成:
CH2=CH2 + H—H →
H—X(必须是气体) →
H—OH(必须是蒸气) →
加成反应
四、乙烯化学性质:3、聚合反应
聚合反应(加聚反应):分子量小的化合物分子互相结合成分子量大的化合物的反应。
加聚反应的实质是:
不饱和键的断裂和相互加成。
根本原因是含有不饱和的C=C双键
五、乙烯的用途
(1)有机化工原料等。
(2)植物生长调节剂,催熟剂等。
练习:
3、碎瓷片的作用是什么?
4、温度计水银球的位置如何?反应为什么要迅速升高温度?
5、浓H2SO4 有何作用?为什么要过量?
6、反应液为什么会变黑?
1、收集的乙烯中主要有哪些杂质?
2、如何证明制得的气体中含有SO2 ?
实验室制乙烯中:
练习:
下列关于乙烯和乙烷相比较的说法中,不正确的是
A.乙烯能使酸性高锰酸钾溶液褪色,乙烷不能
B.乙烯属于不饱和链烃,乙烷属于饱和链烃
C.乙烯分子中的碳碳双键和乙烷分子中的碳碳单键相比较,双键的键能大,键长长
D.乙烯分子中的所有原子处于同一平面上,乙烷分子则为立体结构,原子不在同一平面上
练习:
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯,得到纯净乙烷的方法是
A.与足量溴单质反应 B.通入足量溴水中
C.在一定条件下通入氢气 D.分别进行燃烧
练习:
下列物质不能用加成反应得到的是
A. B.
C. D.
练习:
下列反应不能体现乙烯的不饱和性的是
练习:
1mol乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气
A.1mol B.4mol
C.5mol D.6mol
练习:
一种气态烷烃和气态烯烃组成的混合物共10g,混合气密度是相同状况下H2密度的12.5倍,该混合气体通过装有溴水的试剂瓶时,试剂瓶总质量增加了8.4g,组成该混合气体的可能是
A.乙烯和乙烷 B.乙烷和丙烷
C.甲烷和乙烯 D.乙烯和丙烷
