第16课时信息化学题
图片预览








文档简介
(共21张PPT)
第16课时信息化学题
1.明代爱国将领于谦的《石灰吟》:
千锤万凿出深山,烈火焚烧若等闲。
粉身碎骨浑不怕,要留清白在人间。
该诗体现诗人的崇高情操和献身精神。诗中蕴含着石灰的来源、生产、性质、用途等多种化学事实。下列化学变化与诗意无关的是( )。
A、
B、CaO+H2O=Ca(OH)2
C、Ca(OH)2+CO2=CaCO3↓+H2O D、CaCO3+2HCl=CaCl2+H2O+CO2↑
2.山茶花、杜鹃花、栀子花等适宜在酸性的土壤中生长,而仙人球适宜在中性偏碱的土壤中生长,现测得某土壤的pH约为7~8,该土壤适宜种植的花卉是( )。
A、仙人球 B、杜鹃花
C、栀子花 D、山茶花
3、一瓶密封保存的KNO3饱和溶液,当温度改变时,下列说法中正确的是( )
A、不管升温还是降温,溶液成分都保持不变
B、温度升高,则变成不饱和溶液,溶质质量
分数不变
C、温度降低,仍为饱和溶液,溶质质量分数
不变
D、温度升高,溶液的溶质质量分数变小
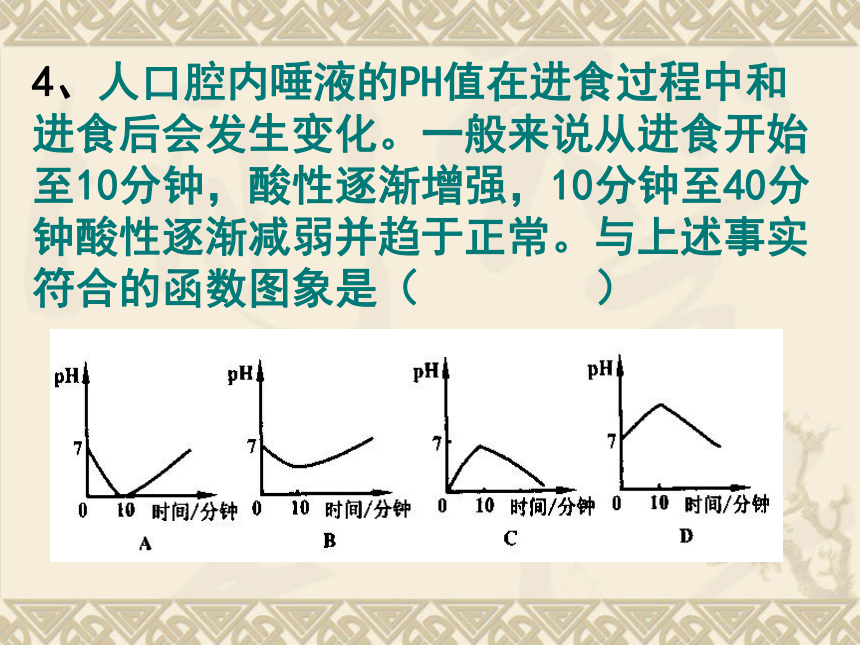
4、人口腔内唾液的PH值在进食过程中和进食后会发生变化。一般来说从进食开始至10分钟,酸性逐渐增强,10分钟至40分钟酸性逐渐减弱并趋于正常。与上述事实符合的函数图象是( )
5.将一定质量的CaO加到饱和澄清石灰水溶液中,下列叙述正确的是 ( )
A、溶液中溶质的质量不变
B、溶液中溶质质量分数变大
C、溶液中溶质质量分数开始减少,然后逐渐增大到原来饱和澄清石灰水的质量分数
D、溶液中溶质质量分数开始增大,然后逐渐减小到原来饱和澄清石灰水的质量分数
6、将元素、分子、原子、离子、质子、中子或电子分别填入有关空格内:
(1)化学变化中的最小粒子是 。
(2)氢气 是保持氢气化学性质的最小粒子。
(3)带电的原子或原子团叫 ,
(4)具有相同 数的一类原子总称为元素。
(5)Na与Na+属于同—种 ,
(6)铁原子核内含有26个质子和30个 ,
(7)在离子化合物中,元素化合价的数值为1个的原子
得失 ,
(8)酸在水中电离时能产生相同的氢 。
(9)在金属活动性顺序中,只有排在氢之前的金属才能置换出酸中的氢 。
7、生活中的许多现象与化学有着密切的联系。在S02、NaOH、粉尘、CO2、甲醇、CO六种物质中,选择正确的填人下列空格内
(1)饮用假酒引起中毒导致眼睛失明,是由于假酒中含有 的原因。
(2)用煤炉取暖时发生中毒,原因之一是由于室内
排放不畅而引起的。
(3)人们在进入干涸深井前必须做灯火实验,这是因为深井中可能积存有大量的 ,
(4)煤中一般都含有硫元素,煤燃烧时会产生污染空气的 气体。
8.为适应火车提速,沪宁线上原有的短轨已全部连接为超长轨。工程技术人员常用点燃铝热剂(铝粉和氧化铁粉末的混合物,能释放大量的热量)的方法来生成熔融状态的铁,从而焊接钢轨间的缝隙。写出有关的化学方程式______,其中还原剂是________,其基本反应类型是______。
9、阅读下面的短文并简要回答问题。
土壤污染是指土壤中积累有毒、有害物质,引起对植物生长的危害,或者残留在农作物中进入食物链而危害人体健康。人从自然界取得资源和能源,经过加工、调配和消费,最终以废弃物撤向土壤,或通过大气、水体和生物向土壤中排放和转化。当输入的污染物质数量超过土壤的容量和自净能力时,必然引起土壤情况的恶化,发生土壤污染。污染的土壤对农作物生长不利。
(1)设计实验测定本地区土壤的酸碱度(简要写出操作步骤、现象和结论)。
(2)据你所学化学知识提出
防止土壤污染的措施(至少三种)。
10.南京著名的风景点珍珠泉,水底有大量气泡冒出,像串串珍珠,珍珠泉由此得名。某学生推测这种气体可能是沼气,查资料得知沼气中含60%—70%的CH4,还含有CO2、N2和CO等。他想用实验检验珍珠泉冒出气体的组成,设计了如图甲所示的取气方法:将空的雪碧汽水塑料瓶装满水,倒放在泉水中,瓶口对准水底冒出的气泡收集。
(1)这种集气方法叫 。针对瓶口太小不便于收集的特点,在不换瓶的情况下你的改进方法 。
(2)如图乙所示,若用水将瓶中的气体排出,水龙头应接 导管。
(3)假设将这种未知气体通过澄清石灰水,石灰水变浑浊,剩余气体通过浓硫酸(以上两步,能被吸收的气体均被完全吸收),再通人纯氧气中点燃,将燃烧后生成的气体依次通过无水
硫酸铜、澄清石灰水,观察到无水硫酸铜变
蓝,石灰水变浑浊。仅由以上实验现象分析
此未知气体的组成,结论 。
11.钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质。当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式______________。
12.“纳米材料”特指粒径为1——100nm的颗粒。纳米材料和纳米技术的应用几乎涉及现代工业的各个领域。汽车尾气是城市空气的主要污染源,治理方法之一是在汽车的排气管上装一“催化转换器”(内含催化剂)。现有用纳米级的某种氧化物作的一种催化剂,可使汽车尾气中的CO和NO反应,生成可参与大气生态环境循环的两种无毒气体,其中一种可参与植物的光合作用。写出CO和NO反应的化学方程式_____________________________。
13.过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
14、钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时却能与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。目前大规模生产钛的方法是:第一步,金红石(主要成分TiO2)、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式为____________________________。
第二步,在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。该反应的化学方程式为________________________。简述从上述所得产物中获得金属钛的步骤____________________________。
四氯化钛非常容易与空气中的水发生反应生成二氧化钛,并有大量酸雾生成。该反应的化学方程式为______________________________。
15、鲜鸡蛋在进行呼吸作用时会通过蛋壳表面的大量微小孔隙呼出CO2,为停止鸡蛋的呼吸作用达到保鲜的目的,人们常用石灰水作为鲜鸡蛋的保鲜剂,其原理可用化学方程式表示为
______________________________。
16、实验室制取有毒的氯气时,常用氢氧化钠溶液来吸收多余的氯气,其反应的化学方程式为:Cl2+2NaOH==NaCl+NaClO(次氯酸钠)+H2O。写出氯气和消石灰反应的化学方程式____________。(工业上用它来制取漂白粉)
17、如果血液中缺乏亚铁离子就会造成缺铁性贫血。市场出售的某种麦片中含有微量的颗粒极细小的铁粉,这些铁粉与人体中的胃酸作用,从而减轻缺铁性贫血。其原理可用化学方程式表示为________________________。
18、发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成。该反应的化学方程式为_______________________。
小结
再见,同学们
第16课时信息化学题
1.明代爱国将领于谦的《石灰吟》:
千锤万凿出深山,烈火焚烧若等闲。
粉身碎骨浑不怕,要留清白在人间。
该诗体现诗人的崇高情操和献身精神。诗中蕴含着石灰的来源、生产、性质、用途等多种化学事实。下列化学变化与诗意无关的是( )。
A、
B、CaO+H2O=Ca(OH)2
C、Ca(OH)2+CO2=CaCO3↓+H2O D、CaCO3+2HCl=CaCl2+H2O+CO2↑
2.山茶花、杜鹃花、栀子花等适宜在酸性的土壤中生长,而仙人球适宜在中性偏碱的土壤中生长,现测得某土壤的pH约为7~8,该土壤适宜种植的花卉是( )。
A、仙人球 B、杜鹃花
C、栀子花 D、山茶花
3、一瓶密封保存的KNO3饱和溶液,当温度改变时,下列说法中正确的是( )
A、不管升温还是降温,溶液成分都保持不变
B、温度升高,则变成不饱和溶液,溶质质量
分数不变
C、温度降低,仍为饱和溶液,溶质质量分数
不变
D、温度升高,溶液的溶质质量分数变小
4、人口腔内唾液的PH值在进食过程中和进食后会发生变化。一般来说从进食开始至10分钟,酸性逐渐增强,10分钟至40分钟酸性逐渐减弱并趋于正常。与上述事实符合的函数图象是( )
5.将一定质量的CaO加到饱和澄清石灰水溶液中,下列叙述正确的是 ( )
A、溶液中溶质的质量不变
B、溶液中溶质质量分数变大
C、溶液中溶质质量分数开始减少,然后逐渐增大到原来饱和澄清石灰水的质量分数
D、溶液中溶质质量分数开始增大,然后逐渐减小到原来饱和澄清石灰水的质量分数
6、将元素、分子、原子、离子、质子、中子或电子分别填入有关空格内:
(1)化学变化中的最小粒子是 。
(2)氢气 是保持氢气化学性质的最小粒子。
(3)带电的原子或原子团叫 ,
(4)具有相同 数的一类原子总称为元素。
(5)Na与Na+属于同—种 ,
(6)铁原子核内含有26个质子和30个 ,
(7)在离子化合物中,元素化合价的数值为1个的原子
得失 ,
(8)酸在水中电离时能产生相同的氢 。
(9)在金属活动性顺序中,只有排在氢之前的金属才能置换出酸中的氢 。
7、生活中的许多现象与化学有着密切的联系。在S02、NaOH、粉尘、CO2、甲醇、CO六种物质中,选择正确的填人下列空格内
(1)饮用假酒引起中毒导致眼睛失明,是由于假酒中含有 的原因。
(2)用煤炉取暖时发生中毒,原因之一是由于室内
排放不畅而引起的。
(3)人们在进入干涸深井前必须做灯火实验,这是因为深井中可能积存有大量的 ,
(4)煤中一般都含有硫元素,煤燃烧时会产生污染空气的 气体。
8.为适应火车提速,沪宁线上原有的短轨已全部连接为超长轨。工程技术人员常用点燃铝热剂(铝粉和氧化铁粉末的混合物,能释放大量的热量)的方法来生成熔融状态的铁,从而焊接钢轨间的缝隙。写出有关的化学方程式______,其中还原剂是________,其基本反应类型是______。
9、阅读下面的短文并简要回答问题。
土壤污染是指土壤中积累有毒、有害物质,引起对植物生长的危害,或者残留在农作物中进入食物链而危害人体健康。人从自然界取得资源和能源,经过加工、调配和消费,最终以废弃物撤向土壤,或通过大气、水体和生物向土壤中排放和转化。当输入的污染物质数量超过土壤的容量和自净能力时,必然引起土壤情况的恶化,发生土壤污染。污染的土壤对农作物生长不利。
(1)设计实验测定本地区土壤的酸碱度(简要写出操作步骤、现象和结论)。
(2)据你所学化学知识提出
防止土壤污染的措施(至少三种)。
10.南京著名的风景点珍珠泉,水底有大量气泡冒出,像串串珍珠,珍珠泉由此得名。某学生推测这种气体可能是沼气,查资料得知沼气中含60%—70%的CH4,还含有CO2、N2和CO等。他想用实验检验珍珠泉冒出气体的组成,设计了如图甲所示的取气方法:将空的雪碧汽水塑料瓶装满水,倒放在泉水中,瓶口对准水底冒出的气泡收集。
(1)这种集气方法叫 。针对瓶口太小不便于收集的特点,在不换瓶的情况下你的改进方法 。
(2)如图乙所示,若用水将瓶中的气体排出,水龙头应接 导管。
(3)假设将这种未知气体通过澄清石灰水,石灰水变浑浊,剩余气体通过浓硫酸(以上两步,能被吸收的气体均被完全吸收),再通人纯氧气中点燃,将燃烧后生成的气体依次通过无水
硫酸铜、澄清石灰水,观察到无水硫酸铜变
蓝,石灰水变浑浊。仅由以上实验现象分析
此未知气体的组成,结论 。
11.钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质。当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式______________。
12.“纳米材料”特指粒径为1——100nm的颗粒。纳米材料和纳米技术的应用几乎涉及现代工业的各个领域。汽车尾气是城市空气的主要污染源,治理方法之一是在汽车的排气管上装一“催化转换器”(内含催化剂)。现有用纳米级的某种氧化物作的一种催化剂,可使汽车尾气中的CO和NO反应,生成可参与大气生态环境循环的两种无毒气体,其中一种可参与植物的光合作用。写出CO和NO反应的化学方程式_____________________________。
13.过氧化钠(Na2O2)是一种淡黄色固体,可在潜水艇里作为氧气的来源,因为它能与CO2反应,该反应的化学方程式____________(另一种产物加盐酸后能产生一种使澄清石灰水变浑的气体)。
14、钛(Ti)因为具有神奇的性能越来越引起人们的关注,常温下钛不和非金属、强酸反应,红热时却能与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。目前大规模生产钛的方法是:第一步,金红石(主要成分TiO2)、炭粉混合在高温条件下通入氯气制得TiCl4和一种可燃性气体。该反应的化学方程式为____________________________。
第二步,在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。该反应的化学方程式为________________________。简述从上述所得产物中获得金属钛的步骤____________________________。
四氯化钛非常容易与空气中的水发生反应生成二氧化钛,并有大量酸雾生成。该反应的化学方程式为______________________________。
15、鲜鸡蛋在进行呼吸作用时会通过蛋壳表面的大量微小孔隙呼出CO2,为停止鸡蛋的呼吸作用达到保鲜的目的,人们常用石灰水作为鲜鸡蛋的保鲜剂,其原理可用化学方程式表示为
______________________________。
16、实验室制取有毒的氯气时,常用氢氧化钠溶液来吸收多余的氯气,其反应的化学方程式为:Cl2+2NaOH==NaCl+NaClO(次氯酸钠)+H2O。写出氯气和消石灰反应的化学方程式____________。(工业上用它来制取漂白粉)
17、如果血液中缺乏亚铁离子就会造成缺铁性贫血。市场出售的某种麦片中含有微量的颗粒极细小的铁粉,这些铁粉与人体中的胃酸作用,从而减轻缺铁性贫血。其原理可用化学方程式表示为________________________。
18、发射卫星的火箭用联氨(N2H4)作燃料,以四氧化二氮作氧化剂,燃烧尾气由氮气与水蒸气组成。该反应的化学方程式为_______________________。
小结
再见,同学们
