2.6 材料的利用与发展 课件(共11张PPT)
文档属性
| 名称 | 2.6 材料的利用与发展 课件(共11张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 268.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-07-12 09:28:39 | ||
图片预览




文档简介
2.6 材料的利用与发展
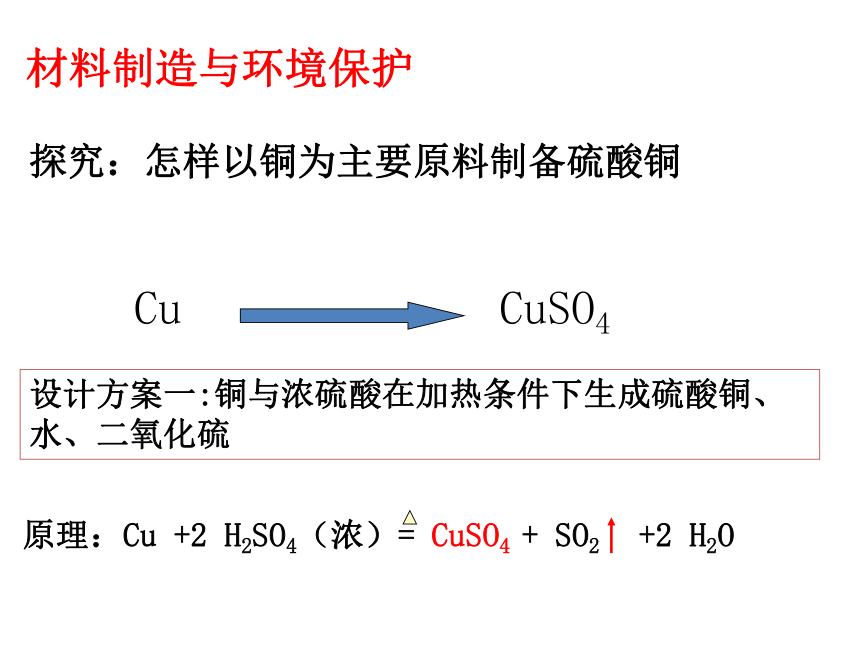
材料制造与环境保护
探究:怎样以铜为主要原料制备硫酸铜
Cu
CuSO4
设计方案一:铜与浓硫酸在加热条件下生成硫酸铜、水、二氧化硫
原理:Cu +2 H2SO4(浓)= CuSO4 + SO2 +2 H2O
设计方案二:铜加热生成氧化铜,氧化铜和稀硫酸反应生成硫酸铜和水
原理:2Cu+O2=2CuO
CuO+H2SO4=CuSO4+H2O
设计方案三:将铜与硝酸银反应生成硝酸铜,然后将硝酸铜和氢氧化钠反应,生成氢氧化铜和硝酸钠,最后利用氢氧化铜和硫酸反应制取硫酸铜
原理: Cu+2AgNO3=2Ag+Cu(NO3)2
Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
Cu(OH)2+H2SO4=CuSO4+2H2O
设计方案四:将铜和氯气在加热条件下反应生成氯化铜,然后将氯化铜和氢氧化钠反应,生成氢氧化铜和氯化钠,最后利用氢氧化铜和硫酸反应制取硫酸铜
原理:Cu+Cl2=CuCl2
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
Cu(OH)2+H2SO4=CuSO4+2H2O
以上方法可从操作、安全、原料的利用率、经济、环保等方面考虑,对每个方案进行评价
方案一:原料浓硫酸有一定的危险性,原料利用率低,生成了SO2污染大气
方案二:原料利用率高,无污染
方案三:操作复杂步骤多,原料成本高不经济
方案四:操作复杂步骤多,原料氯气有毒不环保
上述方案中最优的是方案二
绿色化学
按照绿色化学的原则、理想的状态是:反应物的原子全部转化为目标产物,即原子利用率为100%
下列过程符合“绿色化学”理念的是
A. 实验室制O2:2KClO3=2KCl+3O2↑
B. 2C2H5OH+O2=2CH3CHO+2H2O
C. 2M+N═2P+2Q,2P+M═Q(M、N为原料,Q为期望产品)
D. 用铁屑、CuO、稀硫酸为原料制铜:CuO+H2SO4═CuSO4+H2O????Fe+CuSO4═FeSO4+Cu
C
化合反应
某小组同学用如图所示装置制取硫酸铜
用B装置来收集SO2,补画导管
SO2会污染大气,如何处理?
此实验装置有什么不足之处?
氢氧化钠溶液会倒吸入B瓶
如何改进装置?
防倒吸
充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?请设计实验方案
1、待烧瓶冷却后,将烧瓶中的混合物稀释、过滤、取滤液
2、取少量滤液于试管中滴入紫色石蕊
3、若石蕊变红,硫酸有剩余
取少量滤液于试管中滴入硝酸钡溶液,产生白色沉淀,硫酸有剩余
×
焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂。小金模仿化工生产,用如图装置来制取Na2S2O5。已知:
A中发生的反应为:H2SO4(浓)+Na2SO3=Na2SO4+SO2↑+H2O,
B中发生的反应为:Na2SO3+SO2= Na2S2O5
在实验过程中,滴加浓硫酸不宜过快,为什么?
防止生成SO2气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5
亚硫酸钠在有H2O存在时容易被空气中的氧气氧化为硫酸钠(Na2SO4),要制取纯净的Na2S2O5,实验前必须进行什么操作?
排尽装置内的空气
某化工厂利用含有1% -2%BaCO3的废料制取BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
滤渣必须经过充分洗涤,确保其中Ba2+含量达到规定标准才能作为固体废弃物处理
写出流程过程中发生的所有反应方程式
洗涤滤渣的主要目的是什么?
防止废弃物中的钡离子对环境造成污染
材料制造与环境保护
探究:怎样以铜为主要原料制备硫酸铜
Cu
CuSO4
设计方案一:铜与浓硫酸在加热条件下生成硫酸铜、水、二氧化硫
原理:Cu +2 H2SO4(浓)= CuSO4 + SO2 +2 H2O
设计方案二:铜加热生成氧化铜,氧化铜和稀硫酸反应生成硫酸铜和水
原理:2Cu+O2=2CuO
CuO+H2SO4=CuSO4+H2O
设计方案三:将铜与硝酸银反应生成硝酸铜,然后将硝酸铜和氢氧化钠反应,生成氢氧化铜和硝酸钠,最后利用氢氧化铜和硫酸反应制取硫酸铜
原理: Cu+2AgNO3=2Ag+Cu(NO3)2
Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3
Cu(OH)2+H2SO4=CuSO4+2H2O
设计方案四:将铜和氯气在加热条件下反应生成氯化铜,然后将氯化铜和氢氧化钠反应,生成氢氧化铜和氯化钠,最后利用氢氧化铜和硫酸反应制取硫酸铜
原理:Cu+Cl2=CuCl2
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
Cu(OH)2+H2SO4=CuSO4+2H2O
以上方法可从操作、安全、原料的利用率、经济、环保等方面考虑,对每个方案进行评价
方案一:原料浓硫酸有一定的危险性,原料利用率低,生成了SO2污染大气
方案二:原料利用率高,无污染
方案三:操作复杂步骤多,原料成本高不经济
方案四:操作复杂步骤多,原料氯气有毒不环保
上述方案中最优的是方案二
绿色化学
按照绿色化学的原则、理想的状态是:反应物的原子全部转化为目标产物,即原子利用率为100%
下列过程符合“绿色化学”理念的是
A. 实验室制O2:2KClO3=2KCl+3O2↑
B. 2C2H5OH+O2=2CH3CHO+2H2O
C. 2M+N═2P+2Q,2P+M═Q(M、N为原料,Q为期望产品)
D. 用铁屑、CuO、稀硫酸为原料制铜:CuO+H2SO4═CuSO4+H2O????Fe+CuSO4═FeSO4+Cu
C
化合反应
某小组同学用如图所示装置制取硫酸铜
用B装置来收集SO2,补画导管
SO2会污染大气,如何处理?
此实验装置有什么不足之处?
氢氧化钠溶液会倒吸入B瓶
如何改进装置?
防倒吸
充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?请设计实验方案
1、待烧瓶冷却后,将烧瓶中的混合物稀释、过滤、取滤液
2、取少量滤液于试管中滴入紫色石蕊
3、若石蕊变红,硫酸有剩余
取少量滤液于试管中滴入硝酸钡溶液,产生白色沉淀,硫酸有剩余
×
焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂。小金模仿化工生产,用如图装置来制取Na2S2O5。已知:
A中发生的反应为:H2SO4(浓)+Na2SO3=Na2SO4+SO2↑+H2O,
B中发生的反应为:Na2SO3+SO2= Na2S2O5
在实验过程中,滴加浓硫酸不宜过快,为什么?
防止生成SO2气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5
亚硫酸钠在有H2O存在时容易被空气中的氧气氧化为硫酸钠(Na2SO4),要制取纯净的Na2S2O5,实验前必须进行什么操作?
排尽装置内的空气
某化工厂利用含有1% -2%BaCO3的废料制取BaCl2(废料中其他物质不溶于水和稀盐酸、且不与稀盐酸反应)。其部分流程如下:
滤渣必须经过充分洗涤,确保其中Ba2+含量达到规定标准才能作为固体废弃物处理
写出流程过程中发生的所有反应方程式
洗涤滤渣的主要目的是什么?
防止废弃物中的钡离子对环境造成污染
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
