盐类的水解
图片预览







文档简介
(共25张PPT)
第八章 水溶液中的离子平衡
第25讲 盐类的水解
陕县一高
尚雪娥
学习目标:
1 盐类水解的实质、特点、表示
方法及水解规律
2 影响水解平衡的因素
3 了解盐类水解的应用
一、盐类的水解
1定义:溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2 条件:①盐必须溶于水
②盐必须有“弱”离子(弱碱阳离
子或弱酸根离子)
3 实质:破坏了水的电离平衡,促进水的电离
注: 往水中加入酸或碱抑制水的电离
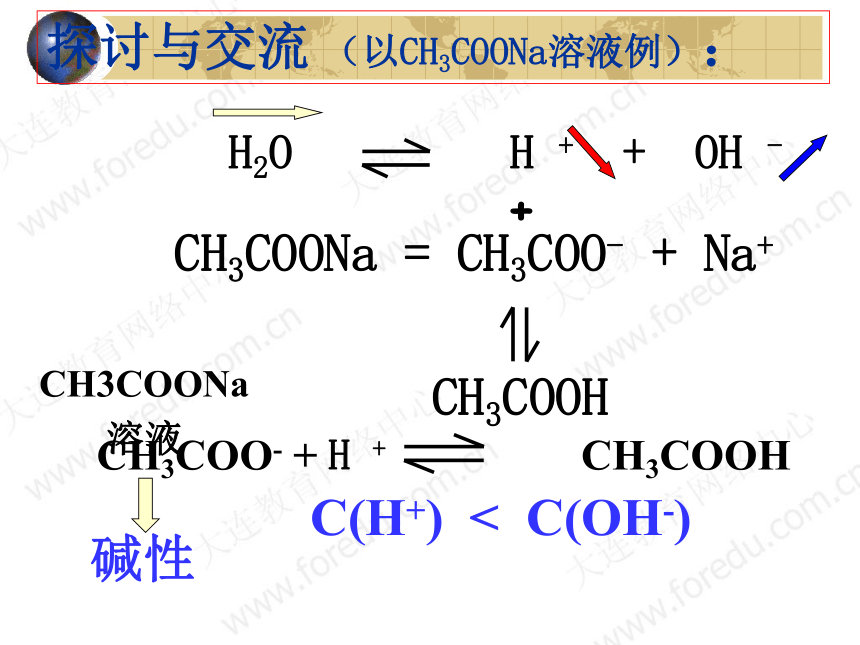
CH3COONa = CH3COO- + Na+
+
CH3COOH
探讨与交流 (以CH3COONa溶液例):
C(H+) < C(OH-)
CH3COO- + H + CH3COOH
碱性
CH3COONa
溶液
H2O H + + OH -
O
H
H
H
H
H
C
O
O
-
H
H
H
H
C
O
O
-
H
O
+
+
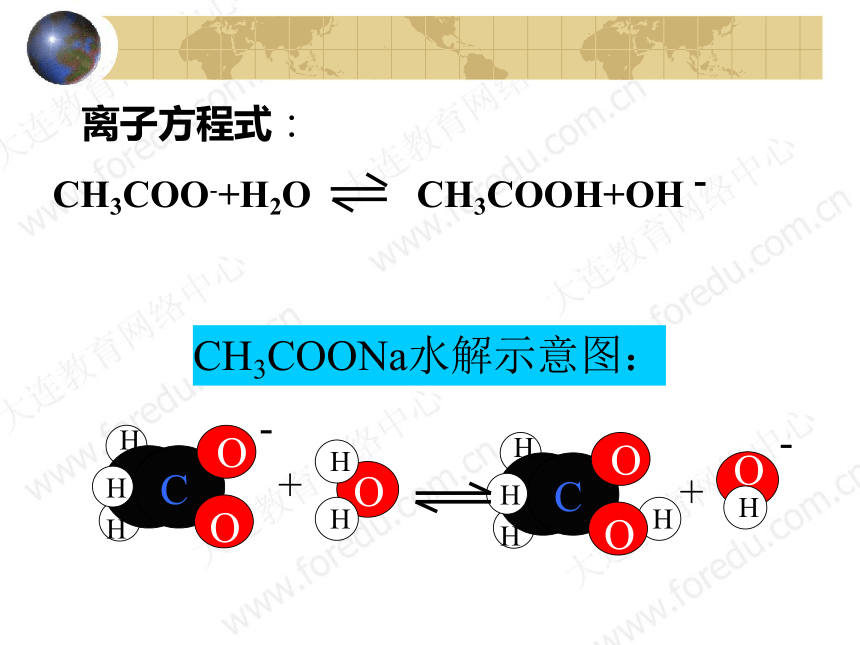
CH3COONa水解示意图:
CH3COO-+H2O CH3COOH+OH -
离子方程式:
4 特征:
①属可逆反应,是中和反应的逆反应
②水解程度一般比较微弱
5 影响盐类水解平衡的因素
① 内因:越难电离的物质越容易水解
即越弱越水解
② 外因:温度越高,越有利于水解
溶液越稀,越有利于水解
外加酸碱,促进或抑制水解
6 盐类水解的规律:
有弱才水解,
越弱越水解,
谁强显谁性,
同强呈中性。
7 水解方程式的表示方法:
① 先找“弱”
② 由于水解程度小,水解产物少。一般书写“ ” ,不写“ = ”、“↑”、“↓”,也不把生成物(如NH3·H2O、H2CO3)写成分解产物的形式
③多元弱酸盐分步水解,但以第一步水解为主,故只写第一步即可;多元弱碱盐也是分步水解,但不分步书写。
总结:可逆,分步,无气体或沉淀
CO32-+H2O HCO3- +OH -
第二步是生成的HCO3- 进一步发生水解:
HCO3-+ H2O H2CO3 +OH –
第一步是Na2CO3在水溶液里电离
出来的CO32- 发生水解:
碳酸钠在溶液中的变化:
(主要)
NH4+ + H2O NH3 · H2O + H+
Cu 2++ 2H2O Cu(OH)2 + 2H+
7 水解方程式的表示方法:
④双水解由于不形成水解平衡,书写要用“ = ” 、“↑”、“↓”,如溶液NaHCO3与AlCl3溶液混合:
3HCO3- +Al3+ +3H2O = 3CO2 +3H2O
+ Al (OH)3
练1 判断FeCl3、NaHCO3、Na3PO4、K2S、(NH4)2SO4、BaCl2的水溶液能否水解。写出水解的离子方程式。
Fe3+ + 3H2O Fe(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
PO43- + H2O HPO42- + OH-
S2- + H2O HS- + OH-
NH4+ + H2O NH3·H2O + H2O
注:离子方程式应遵循电荷守恒
练2 下列水解离子方程式书写正确的是( )
A Fe3+ + 3H2O Fe(OH)3 + 3H+
B Br - + H2O HBr + OH-
C CO32- + 2H2O H2CO3 + 2OH-
D NH4+ + H2O NH3·H2O + H+
AD
提示:Br- 不能水解;CO32- 应分步水解
练3 下列物质的水溶液中,除了水分子外,不存在其它分子的是( )
A HNO3 B NH4 NO3 C Na2S D HClO
A
练4 物质的量相同的下列溶液,由水电离出的H+浓度由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A ④③②① B ①②③④
C ③②④① D ③④①②
C
二、盐类水解的应用
1 判断盐溶液的酸碱性及能否使指示剂变色 要考虑盐类的水解
如CH3COONa溶液显碱性
CH3COO- + H2O CH3COOH + OH-
NH4Cl溶液使紫色石蕊变红原因
NH4+ + 2H2O NH3·H2O + H+
判断酸式盐溶液的酸碱性
如果不考虑阳离子的水解的因素,单纯考虑酸式酸根离子,那么酸式酸根离子在溶液中既可以电离又有可能水解。
(1) 强酸的酸式盐只电离,不水解,一定显酸性。如:NaHSO4
(2) 弱酸的酸式盐既电离又水解。电离程度强于水解,则显酸性,如H2PO4-、HSO3-;水解程度强于电离,则显碱性,如HCO3-、HS-、 HPO42-等。
如配制CuSO4溶液需加入少量H2SO4; 配制FeCl3溶液加入少量HCl
注:须加入相应的酸抑制其水解,防止溶液
出现浑浊现象。
2 配制某些盐溶液要考虑盐类的水解。
练5 物质的量相同的下列溶液中,含微粒种类最多的是( )
A CaCl2 B CH3COONa
C NH3 D K2S
D
盐溶液中离子种类多少的判断需考虑到盐
类的水解
提示:K2S中含有K+、S2-、HS-、H+、OH-、
H2S、H2O七种微粒
4 比较盐溶液中离子浓度大小时有的考虑盐类的水解。
如Na2S溶液中离子浓度比较:
[Na+] > [S2-] > [OH-] > [HS-] > [H+]
KAl(SO4)2溶液中离子浓度比较:
[SO42-] > [K+] > [Al3+] > [H+] > [OH-]
5 施用化肥时应考虑盐的水解。
如草木灰不能与铵态氮肥混合施用的原因
CO32- + H2O HCO3- + OH-
NH4+ + OH- = NH3·H2O
6 某些活泼金属与强酸弱碱盐的反应考虑盐
类的水解
如将金属镁投入到氯化铵溶液中有气泡产生
NH4+ + 2H2O NH3·H2O + H+
Mg + 2H+ = Mg2+ + H2↑
7 试剂的贮存考虑盐的水解。
如Na2CO3溶液贮存时用橡胶塞
CO32- + H2O HCO3- + OH-
SiO2 + OH- = SiO32- + H2O
注意:实验室贮存碱性溶液的试剂瓶一律使
用橡胶塞
8 制备某些无水盐时要考虑盐类的水解
如制无水AlCl3、无水MgCl2、Al2S3等
练6 下列溶液加热蒸干后,不能析出溶质固体的是( )
A Fe2(SO4)3 B FeCl3
C Na2CO3 D KCl
B
练7 在25℃时1mol/L 的(NH4)2SO4、(NH4)2 CO3、(NH4)2Fe(SO4)2 的溶液中,测得其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是( )
A a=b=c B a>b>c
C a>c>b D c>a>b
D
多 谢 指 导 !
第八章 水溶液中的离子平衡
第25讲 盐类的水解
陕县一高
尚雪娥
学习目标:
1 盐类水解的实质、特点、表示
方法及水解规律
2 影响水解平衡的因素
3 了解盐类水解的应用
一、盐类的水解
1定义:溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
2 条件:①盐必须溶于水
②盐必须有“弱”离子(弱碱阳离
子或弱酸根离子)
3 实质:破坏了水的电离平衡,促进水的电离
注: 往水中加入酸或碱抑制水的电离
CH3COONa = CH3COO- + Na+
+
CH3COOH
探讨与交流 (以CH3COONa溶液例):
C(H+) < C(OH-)
CH3COO- + H + CH3COOH
碱性
CH3COONa
溶液
H2O H + + OH -
O
H
H
H
H
H
C
O
O
-
H
H
H
H
C
O
O
-
H
O
+
+
CH3COONa水解示意图:
CH3COO-+H2O CH3COOH+OH -
离子方程式:
4 特征:
①属可逆反应,是中和反应的逆反应
②水解程度一般比较微弱
5 影响盐类水解平衡的因素
① 内因:越难电离的物质越容易水解
即越弱越水解
② 外因:温度越高,越有利于水解
溶液越稀,越有利于水解
外加酸碱,促进或抑制水解
6 盐类水解的规律:
有弱才水解,
越弱越水解,
谁强显谁性,
同强呈中性。
7 水解方程式的表示方法:
① 先找“弱”
② 由于水解程度小,水解产物少。一般书写“ ” ,不写“ = ”、“↑”、“↓”,也不把生成物(如NH3·H2O、H2CO3)写成分解产物的形式
③多元弱酸盐分步水解,但以第一步水解为主,故只写第一步即可;多元弱碱盐也是分步水解,但不分步书写。
总结:可逆,分步,无气体或沉淀
CO32-+H2O HCO3- +OH -
第二步是生成的HCO3- 进一步发生水解:
HCO3-+ H2O H2CO3 +OH –
第一步是Na2CO3在水溶液里电离
出来的CO32- 发生水解:
碳酸钠在溶液中的变化:
(主要)
NH4+ + H2O NH3 · H2O + H+
Cu 2++ 2H2O Cu(OH)2 + 2H+
7 水解方程式的表示方法:
④双水解由于不形成水解平衡,书写要用“ = ” 、“↑”、“↓”,如溶液NaHCO3与AlCl3溶液混合:
3HCO3- +Al3+ +3H2O = 3CO2 +3H2O
+ Al (OH)3
练1 判断FeCl3、NaHCO3、Na3PO4、K2S、(NH4)2SO4、BaCl2的水溶液能否水解。写出水解的离子方程式。
Fe3+ + 3H2O Fe(OH)3 + 3H+
HCO3- + H2O H2CO3 + OH-
PO43- + H2O HPO42- + OH-
S2- + H2O HS- + OH-
NH4+ + H2O NH3·H2O + H2O
注:离子方程式应遵循电荷守恒
练2 下列水解离子方程式书写正确的是( )
A Fe3+ + 3H2O Fe(OH)3 + 3H+
B Br - + H2O HBr + OH-
C CO32- + 2H2O H2CO3 + 2OH-
D NH4+ + H2O NH3·H2O + H+
AD
提示:Br- 不能水解;CO32- 应分步水解
练3 下列物质的水溶液中,除了水分子外,不存在其它分子的是( )
A HNO3 B NH4 NO3 C Na2S D HClO
A
练4 物质的量相同的下列溶液,由水电离出的H+浓度由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A ④③②① B ①②③④
C ③②④① D ③④①②
C
二、盐类水解的应用
1 判断盐溶液的酸碱性及能否使指示剂变色 要考虑盐类的水解
如CH3COONa溶液显碱性
CH3COO- + H2O CH3COOH + OH-
NH4Cl溶液使紫色石蕊变红原因
NH4+ + 2H2O NH3·H2O + H+
判断酸式盐溶液的酸碱性
如果不考虑阳离子的水解的因素,单纯考虑酸式酸根离子,那么酸式酸根离子在溶液中既可以电离又有可能水解。
(1) 强酸的酸式盐只电离,不水解,一定显酸性。如:NaHSO4
(2) 弱酸的酸式盐既电离又水解。电离程度强于水解,则显酸性,如H2PO4-、HSO3-;水解程度强于电离,则显碱性,如HCO3-、HS-、 HPO42-等。
如配制CuSO4溶液需加入少量H2SO4; 配制FeCl3溶液加入少量HCl
注:须加入相应的酸抑制其水解,防止溶液
出现浑浊现象。
2 配制某些盐溶液要考虑盐类的水解。
练5 物质的量相同的下列溶液中,含微粒种类最多的是( )
A CaCl2 B CH3COONa
C NH3 D K2S
D
盐溶液中离子种类多少的判断需考虑到盐
类的水解
提示:K2S中含有K+、S2-、HS-、H+、OH-、
H2S、H2O七种微粒
4 比较盐溶液中离子浓度大小时有的考虑盐类的水解。
如Na2S溶液中离子浓度比较:
[Na+] > [S2-] > [OH-] > [HS-] > [H+]
KAl(SO4)2溶液中离子浓度比较:
[SO42-] > [K+] > [Al3+] > [H+] > [OH-]
5 施用化肥时应考虑盐的水解。
如草木灰不能与铵态氮肥混合施用的原因
CO32- + H2O HCO3- + OH-
NH4+ + OH- = NH3·H2O
6 某些活泼金属与强酸弱碱盐的反应考虑盐
类的水解
如将金属镁投入到氯化铵溶液中有气泡产生
NH4+ + 2H2O NH3·H2O + H+
Mg + 2H+ = Mg2+ + H2↑
7 试剂的贮存考虑盐的水解。
如Na2CO3溶液贮存时用橡胶塞
CO32- + H2O HCO3- + OH-
SiO2 + OH- = SiO32- + H2O
注意:实验室贮存碱性溶液的试剂瓶一律使
用橡胶塞
8 制备某些无水盐时要考虑盐类的水解
如制无水AlCl3、无水MgCl2、Al2S3等
练6 下列溶液加热蒸干后,不能析出溶质固体的是( )
A Fe2(SO4)3 B FeCl3
C Na2CO3 D KCl
B
练7 在25℃时1mol/L 的(NH4)2SO4、(NH4)2 CO3、(NH4)2Fe(SO4)2 的溶液中,测得其c(NH4+)分别为a、b、c(单位为mol/L),下列判断正确的是( )
A a=b=c B a>b>c
C a>c>b D c>a>b
D
多 谢 指 导 !
