山东省临朐县临朐实高2020-2021学年高一7月月考化学试题 PDF版含答案
文档属性
| 名称 | 山东省临朐县临朐实高2020-2021学年高一7月月考化学试题 PDF版含答案 |  | |
| 格式 | |||
| 文件大小 | 375.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-13 17:56:37 | ||
图片预览



文档简介
高一(2020 级)7 月份月结学情检测
化学试题
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Fe-56
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题目要求
1.2021 年 5 月 15日,中国首个火星探测器天问一号成功登陆火星。碳化硅增强铝基复合材料被
应用于该探测器。下列关于该复合材料的说法错误的是( )
A.是一种有机高分子材料
B.碳化硅是增强体,起到骨架作用
C.碳化硅中的化学键类型为共价键
D.具有重量轻、强度高、刚性好、宽温度范围下尺寸稳定等特性
2.化学与生活密切相关。根据化学知识判断,下列做法错误的是( )
A.用植物油制作肥皂 B.用加酶洗衣粉洗涤毛织品
C.用柠檬酸作食品添加剂 D.用聚乙烯塑料袋盛装食品
3.理清概念是化学学习的基础。下列说法错误的是( )
A.129 131
54 Xe与54 Xe互为同位素
B.二聚硫?S2?与环八硫?S8?互为同素异形体
C. 与 互为同分异构体
D. 与 是同种物质
4.某同学依据实验现象,分析苹果中的物质成分,下列推测不合理的是( )
选项 实验现象 推测
A 苹果具有香味 含有低级酯
B 向苹果泥中滴加 不含淀粉
KIO3溶液,未变蓝
C 切开苹果,放置一段时间,果肉颜色变深 含有还原性物质
D 向苹果汁中加入适量 NaOH 溶液,再与新制的 含有葡萄糖
Cu(OH)2悬浊液共热,产生砖红色沉淀
5.2021 年国务院政府工作报告指出,要扎实做好碳中和、碳达峰的各项工作,以减少或消除二
氧化碳等温室气体对气候的影响。下列措施能实现碳中和且可行的是( )
①通过植树造林捕捉二氧化碳 ②禁止使用煤和石油等化石能源
1
③大力发展风能、太阳能等新型能源 ④工业中用碱石灰吸收CO2
⑤绿色出行,减少燃油车的使用
A.①③④⑤ B.①②③④ C.②③④⑤ D.①②④⑤
6.某品牌热敷贴的主要成分为铁粉、水、活性炭、吸水性树脂、盐等。关于该热敷贴的叙述错
误的是( )
A.需放置袋中密封保存 B.可将化学能转化为热能
C.活性炭在反应中做催化剂 D.发热与氧化还原反应有关
7 下列热化学方程式,正.确.的是( )
-1
A.甲烷的摩尔燃烧焓ΔH=-890.3 kJ·mol ,则表示甲烷摩尔燃烧焓的热化学方程式为:CH4(g)
-1
+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol
B.在 101 kPa 时,2g H2完全燃烧生成液态水,放出 285.8 kJ 热量,氢气燃烧的热化学方程式
-1
表示为 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol
-1
C.HCl和 NaOH 反应的中和热ΔH=-57.3 kJ·mol ,则 H2SO4和 Ca(OH)2反应的中和热ΔH=2
-1
×(-57.3)kJ·mol
D.500 ℃、30 MPa 下,将 0.5mol N2(g)和 1.5mol H2(g)置于密闭容器中充分反应生成 NH3(g),
-1
放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol
8.元素周期表中,某些主族元素与其右下方紧邻的主族元素的某些性质是相似的,如铍和铝。
下列关于铍及其化合物的性质推测错误的是( )
A.原子半径:Be>B B.碱性:Be(OH)2 ?Ca(OH)2
C.单质铍能与冷水剧烈反应 D.BeO是一种两性氧化物
9.浓氨水可用于检验氯气管道是否漏气,其反应为3Cl2 ?8NH3 ?N2 ?6NH4Cl 。下列说法错误的
是( )
A.该反应一定伴随有能量变化
B.该反应在理论上可以设计成原电池
C.该反应同时有离子键和共价键的断裂与形成
D.将浓氨水置于氯气管道附近,若出现白烟,说明氯气管道漏气
10.分枝酸是生物合成的中间体,可用于生化研究,其结构简式如下图所示。下列关于分枝酸的
叙述正确的是( )
2
A.含有苯环
B.分子式为C10H8O6
C.可发生水解反应
D.可使酸性KMnO4溶液褪色
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目要求,
全部选对得4 分,选对但不全的得 2 分,有选错的得 0 分。
11.利用表中实验装置进行相应实验,能达到实验目的的是( )
选项 A B C D
装置
目的 将化学能转化为电 证明非金属性:C>Si 分离苯和水 得到汽油、煤油和柴油
能 等各种馏分
?
12.将一片在空气中久置的铝片投入足量的 1
0.5mol?L 的硫酸中,产生氢气的速率v?H2?与反应
时间t的关系如右图所示。下列说法错误的是( )
? ?
A. 3
oa段反应的离子方程式为Al2O3 ?6H ?2Al ?3H2O
B.ab段v?H2?增大的原因是该反应放热,使反应体系的温度升高
C.bc段v?H2?减小的主要原因是硫酸的浓度减小
?
D.为增大 1
v?H2?,反应前可将0.5mol?L 的硫酸换成浓硫酸
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压。高铁电池的总反应为
放电
3Zn +2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3 +4KOH
充电
下列叙述正.确.的是( )
A.放电时正极附近溶液的 PH 减小
3
— — ?
B.充电时阳极反应为:Fe(OH)3 —3e + 5 OH = FeO2
4 + 4H2O
C.放电时每转移 3 mol 电子,正极有 1mol K2FeO4被氧化
— —
D.放电时负极反应为:Zn—2e +2OH = Zn(OH)2
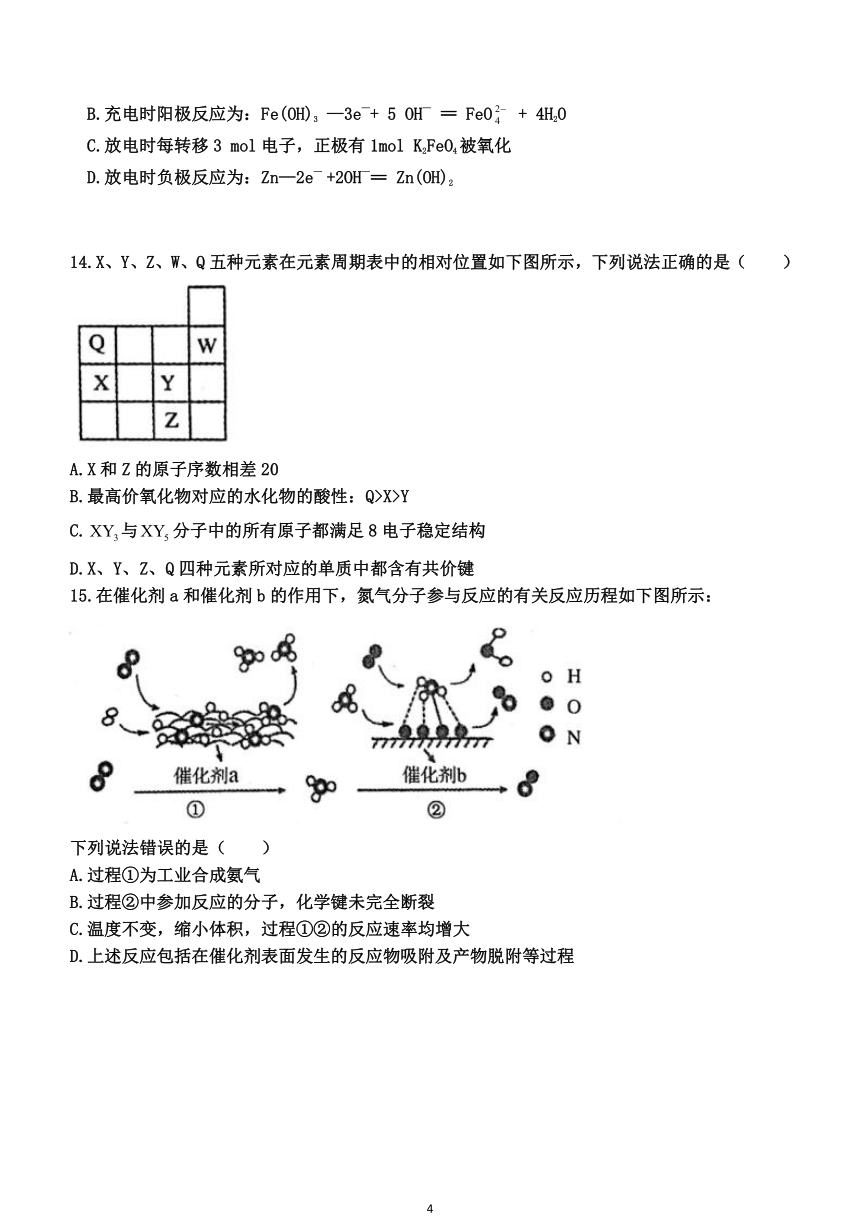
14.X、Y、Z、W、Q 五种元素在元素周期表中的相对位置如下图所示,下列说法正确的是( )
A.X和 Z 的原子序数相差 20
B.最高价氧化物对应的水化物的酸性:Q>X>Y
C.XY3与XY5分子中的所有原子都满足 8 电子稳定结构
D.X、Y、Z、Q 四种元素所对应的单质中都含有共价键
15.在催化剂 a 和催化剂 b 的作用下,氮气分子参与反应的有关反应历程如下图所示:
下列说法错误的是( )
A.过程①为工业合成氨气
B.过程②中参加反应的分子,化学键未完全断裂
C.温度不变,缩小体积,过程①②的反应速率均增大
D.上述反应包括在催化剂表面发生的反应物吸附及产物脱附等过程
4
第Ⅱ卷(非选择题,共 60 分)
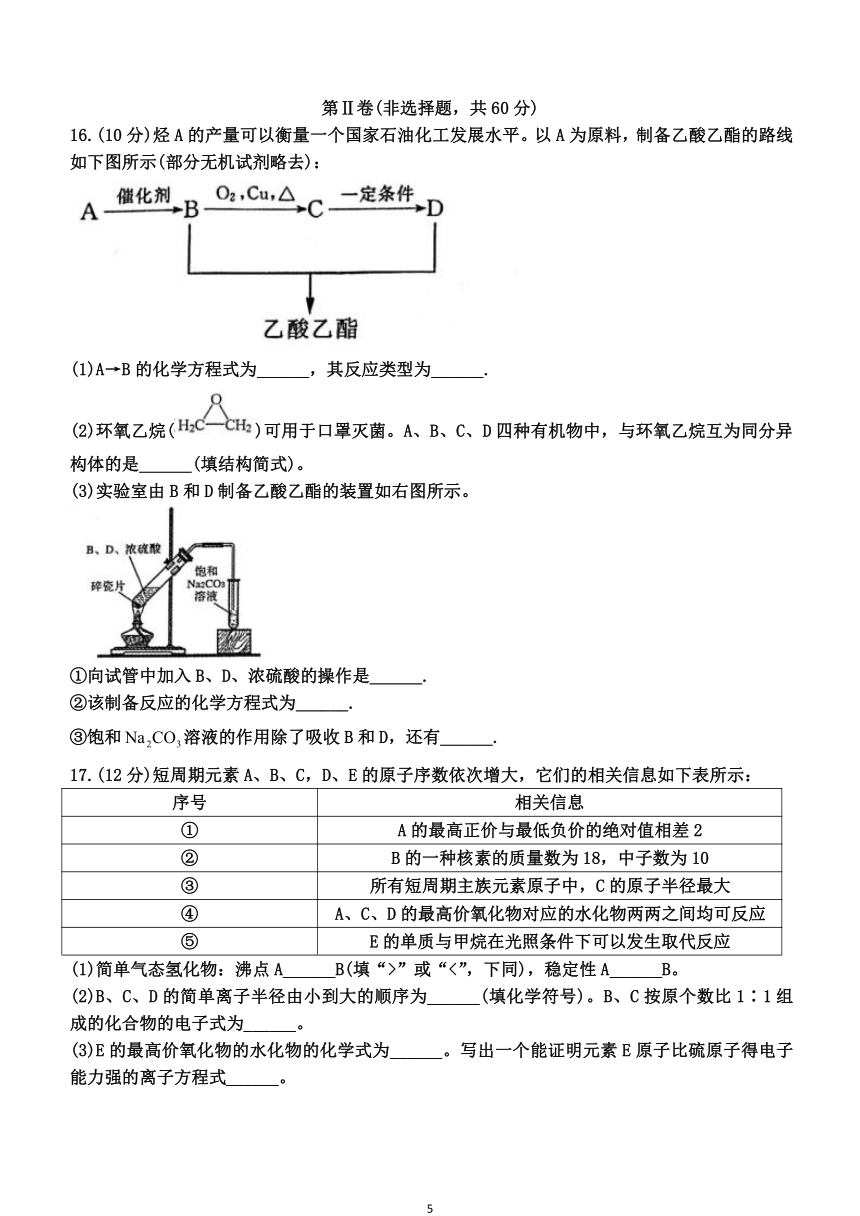
16.(10 分)烃 A 的产量可以衡量一个国家石油化工发展水平。以 A 为原料,制备乙酸乙酯的路线
如下图所示(部分无机试剂略去):
(1)A→B 的化学方程式为______,其反应类型为______.
(2)环氧乙烷( )可用于口罩灭菌。A、B、C、D 四种有机物中,与环氧乙烷互为同分异
构体的是______(填结构简式)。
(3)实验室由 B 和 D 制备乙酸乙酯的装置如右图所示。
①向试管中加入 B、D、浓硫酸的操作是______.
②该制备反应的化学方程式为______.
③饱和Na2CO3溶液的作用除了吸收 B 和 D,还有______.
17.(12 分)短周期元素 A、B、C,D、E 的原子序数依次增大,它们的相关信息如下表所示:
序号 相关信息
① A 的最高正价与最低负价的绝对值相差 2
② B 的一种核素的质量数为 18,中子数为 10
③ 所有短周期主族元素原子中,C 的原子半径最大
④ A、C、D 的最高价氧化物对应的水化物两两之间均可反应
⑤ E 的单质与甲烷在光照条件下可以发生取代反应
(1)简单气态氢化物:沸点 A______B(填“>”或“<”,下同),稳定性A______B。
(2)B、C、D 的简单离子半径由小到大的顺序为______(填化学符号)。B、C 按原个数比 1∶1 组
成的化合物的电子式为______。
(3)E 的最高价氧化物的水化物的化学式为______。写出一个能证明元素 E 原子比硫原子得电子
能力强的离子方程式______。
5
(4)向DE3的水溶液中滴加 C 的最高价氧化物对应水化物的水溶液至过量,依据实验现象可以说
明失电子能力 C>D,其理由是______。
18.(8 分) NO2 和 N2O4 是氮的两种重要氧化物。100℃时,在 2L 密闭容器中发生反应
N2O4(g)??????2NO2(g),各气体浓度随时间变化的情况如下图所示。
(1)代表NO2气体浓度随时间变化的曲线为______(填序号)。
?
(2)当 1
N2O4的浓度为0.06mol?L 时,反应时间为ts,则 0~ts 时,用NO2气体的浓度变化量表
达该反应的平均速率为______。
(3)反应达到平衡状态时,c?NO2?:c?N2O4??______。
(4)已知NO2(g)与SO2(g)发生可逆反应:NO2(g)?SO2(g)??????SO3(g)?NO(g)(该反应正向为放
热反应)。在一定条件下,向 1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法
正确的是( )
A.只要经过足够长的时间,可使c?SO2??0
B.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
C.达到平衡状态时,各物质的物质的量浓度相等
D.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
19.(14 分)氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。
某化学兴趣小组用氯气和相应的碱溶液反应制取 NaClO 和KClO3,制备装置如下图所示(部分加
?
持仪器略去),并研究KClO3的氧化性。已知:氯气与碱反应,温度较高时生成ClO3,温度较低
?
时生成ClO 。
6
(1)盛装浓盐酸的仪器名称是______。
(2)装置 A 烧瓶中反应的化学方程式为______。
(3)装置C中Cl2与试剂 a 反应的离子方程式为______。
(4)如果缺少装置 B,对制取 NaClO 和KClO3的影响是______。
(5)E中可选用试剂有______(填标号)。
A.饱和Na2CO3溶液B.浓H2SO4 C.饱和 NaCl 溶液 D.NaOH 溶液
(6)该小组在探究KClO3氧化性时,发现KClO3与NaHSO3的反应速率先增大后减小,反应为
? ? ? 2? ?
ClO3 ?3HSO3 ?Cl ?3SO4 ?3H 。小组分析认为,反应生成的离子可能对反应速率产生影响。
?
为了探究c?H ?对化学反应速率的影响,设计如下实验:
实验序 温度 ?1 ?1 ?1
0.1mol?L KClO3 0.3mol?L NaHSO3 0.2mol?L 盐酸 H2O
号
① 25℃ 10mL 10mL 0mL 1mL
② 25℃ 10mL 10mL 1mL 0mL
该实验______(填“能”或“不能”)达到实验目的,理由是______。
20.(16 分)氢气因燃值高、燃烧产物无污染,被公认为清洁能源。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为______。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
-1
ΔH=49.0 kJ·mol
1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
2
-1
ΔH=-192.9 kJ·mol
-1
又知:③H2O(g)===H2O(l) ΔH=-44 kJ·mol
则 表 示 甲 醇 摩 尔 燃 烧 焓 的 热 化 学 方 程 式 为
7
________________________________________________________________
(3)已知1molH2完全燃烧生成H2O(g),放出245kJ 能量。根据下列信息,计算a?______。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。
①在导线中电子流动方向为______(用 a、b 表示)。
②电极表面镀一层细小的铂粉,其目的是______。
? ?
③该电池的负极反应式为H2 ?2e ?2OH ?2H2O,请写出正极反应式______。
④假设该电池每发 1 度电(1 度 6
?3.6?10 J )能生成 450g 水蒸气,则该电池的能量转化率为
______(保留小数点后一位)。
8
高一化学参考答案
选择题(40 分)
题号 1 2 3 4 5 6 7 8
答案 A B C B A C B C
题号 9 10 11 12 13 14 15
答案 C D BC D BD AD B
16.(10 分)
催化剂
(1)CH2 ?CH2 ?H2O????CH3CH2OH(2 分)加成反应(1 分)
(2)CH3CHO(2 分)
(3)①先将乙酸和乙醇混合,再缓慢加入浓硫酸,并振荡(2 分)
浓硫酸
②CH3COOH?CH3CH2OH?????
△?????CH3COOCH2CH3?H2O(2 分)
③降低乙酸乙酯的溶解度(1 分)
17.(12 分)
(1)<(1 分)<(1 分)
? ? ?
(2) 3 2
Al ? Na ?O (2 分) (2 分)
? ?
(3) 2
HClO4(2 分)Cl2 ?S ?2Cl ?S?(或其他合理答案)(2 分)
(4)生成的 Al(OH)3 沉淀能够溶于 NaOH 溶液中,说明 Al(OH)3 为两性氢氧化物,碱性
Al(OH)3 ?NaOH (2 分)
18.(8 分)
0.08 ? ?
(1)①(2 分) (2) 1 1
mol?L ?s (2 分) (3)3:1(2 分) (4)BD(2 分)
t
19.(14 分)
(1)分液漏斗(2 分)
△
(2)MnO2 ?4HCl?浓? MnCl2 ?Cl2 ??2H2O(2 分)
? △ ? ?
(3)3Cl2 ?6OH ClO3 ?5Cl ?3H2O(2 分)
(4)降低KClO3的产率(2 分)
(5)AD(2 分)
? ?
(6)不能(2 分)盐酸电离出的 Cl 也属于反应生成的离子,无法排除 Cl 的影响(或
? ? ?
Cl ?ClO3 ?H ?Cl2 ?H2O)(2 分)
20.(16 分)
9
通电
(1)2NaCl?2H2O 2NaOH?Cl2 ??H2 ?(2 分)
3 -1
(2)CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol (3 分)
2
(3)930(3 分)
(4)①a→b(2 分)②吸附气体,增大气体反应物的浓度,加快电极反应速率(2 分)
? ?
③O2 ?2H2O?4e ?4OH (2 分)④58.8%(2 分)
10
化学试题
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Fe-56
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题目要求
1.2021 年 5 月 15日,中国首个火星探测器天问一号成功登陆火星。碳化硅增强铝基复合材料被
应用于该探测器。下列关于该复合材料的说法错误的是( )
A.是一种有机高分子材料
B.碳化硅是增强体,起到骨架作用
C.碳化硅中的化学键类型为共价键
D.具有重量轻、强度高、刚性好、宽温度范围下尺寸稳定等特性
2.化学与生活密切相关。根据化学知识判断,下列做法错误的是( )
A.用植物油制作肥皂 B.用加酶洗衣粉洗涤毛织品
C.用柠檬酸作食品添加剂 D.用聚乙烯塑料袋盛装食品
3.理清概念是化学学习的基础。下列说法错误的是( )
A.129 131
54 Xe与54 Xe互为同位素
B.二聚硫?S2?与环八硫?S8?互为同素异形体
C. 与 互为同分异构体
D. 与 是同种物质
4.某同学依据实验现象,分析苹果中的物质成分,下列推测不合理的是( )
选项 实验现象 推测
A 苹果具有香味 含有低级酯
B 向苹果泥中滴加 不含淀粉
KIO3溶液,未变蓝
C 切开苹果,放置一段时间,果肉颜色变深 含有还原性物质
D 向苹果汁中加入适量 NaOH 溶液,再与新制的 含有葡萄糖
Cu(OH)2悬浊液共热,产生砖红色沉淀
5.2021 年国务院政府工作报告指出,要扎实做好碳中和、碳达峰的各项工作,以减少或消除二
氧化碳等温室气体对气候的影响。下列措施能实现碳中和且可行的是( )
①通过植树造林捕捉二氧化碳 ②禁止使用煤和石油等化石能源
1
③大力发展风能、太阳能等新型能源 ④工业中用碱石灰吸收CO2
⑤绿色出行,减少燃油车的使用
A.①③④⑤ B.①②③④ C.②③④⑤ D.①②④⑤
6.某品牌热敷贴的主要成分为铁粉、水、活性炭、吸水性树脂、盐等。关于该热敷贴的叙述错
误的是( )
A.需放置袋中密封保存 B.可将化学能转化为热能
C.活性炭在反应中做催化剂 D.发热与氧化还原反应有关
7 下列热化学方程式,正.确.的是( )
-1
A.甲烷的摩尔燃烧焓ΔH=-890.3 kJ·mol ,则表示甲烷摩尔燃烧焓的热化学方程式为:CH4(g)
-1
+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol
B.在 101 kPa 时,2g H2完全燃烧生成液态水,放出 285.8 kJ 热量,氢气燃烧的热化学方程式
-1
表示为 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol
-1
C.HCl和 NaOH 反应的中和热ΔH=-57.3 kJ·mol ,则 H2SO4和 Ca(OH)2反应的中和热ΔH=2
-1
×(-57.3)kJ·mol
D.500 ℃、30 MPa 下,将 0.5mol N2(g)和 1.5mol H2(g)置于密闭容器中充分反应生成 NH3(g),
-1
放热 19.3 kJ,其热化学方程式为 N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol
8.元素周期表中,某些主族元素与其右下方紧邻的主族元素的某些性质是相似的,如铍和铝。
下列关于铍及其化合物的性质推测错误的是( )
A.原子半径:Be>B B.碱性:Be(OH)2 ?Ca(OH)2
C.单质铍能与冷水剧烈反应 D.BeO是一种两性氧化物
9.浓氨水可用于检验氯气管道是否漏气,其反应为3Cl2 ?8NH3 ?N2 ?6NH4Cl 。下列说法错误的
是( )
A.该反应一定伴随有能量变化
B.该反应在理论上可以设计成原电池
C.该反应同时有离子键和共价键的断裂与形成
D.将浓氨水置于氯气管道附近,若出现白烟,说明氯气管道漏气
10.分枝酸是生物合成的中间体,可用于生化研究,其结构简式如下图所示。下列关于分枝酸的
叙述正确的是( )
2
A.含有苯环
B.分子式为C10H8O6
C.可发生水解反应
D.可使酸性KMnO4溶液褪色
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目要求,
全部选对得4 分,选对但不全的得 2 分,有选错的得 0 分。
11.利用表中实验装置进行相应实验,能达到实验目的的是( )
选项 A B C D
装置
目的 将化学能转化为电 证明非金属性:C>Si 分离苯和水 得到汽油、煤油和柴油
能 等各种馏分
?
12.将一片在空气中久置的铝片投入足量的 1
0.5mol?L 的硫酸中,产生氢气的速率v?H2?与反应
时间t的关系如右图所示。下列说法错误的是( )
? ?
A. 3
oa段反应的离子方程式为Al2O3 ?6H ?2Al ?3H2O
B.ab段v?H2?增大的原因是该反应放热,使反应体系的温度升高
C.bc段v?H2?减小的主要原因是硫酸的浓度减小
?
D.为增大 1
v?H2?,反应前可将0.5mol?L 的硫酸换成浓硫酸
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压。高铁电池的总反应为
放电
3Zn +2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3 +4KOH
充电
下列叙述正.确.的是( )
A.放电时正极附近溶液的 PH 减小
3
— — ?
B.充电时阳极反应为:Fe(OH)3 —3e + 5 OH = FeO2
4 + 4H2O
C.放电时每转移 3 mol 电子,正极有 1mol K2FeO4被氧化
— —
D.放电时负极反应为:Zn—2e +2OH = Zn(OH)2
14.X、Y、Z、W、Q 五种元素在元素周期表中的相对位置如下图所示,下列说法正确的是( )
A.X和 Z 的原子序数相差 20
B.最高价氧化物对应的水化物的酸性:Q>X>Y
C.XY3与XY5分子中的所有原子都满足 8 电子稳定结构
D.X、Y、Z、Q 四种元素所对应的单质中都含有共价键
15.在催化剂 a 和催化剂 b 的作用下,氮气分子参与反应的有关反应历程如下图所示:
下列说法错误的是( )
A.过程①为工业合成氨气
B.过程②中参加反应的分子,化学键未完全断裂
C.温度不变,缩小体积,过程①②的反应速率均增大
D.上述反应包括在催化剂表面发生的反应物吸附及产物脱附等过程
4
第Ⅱ卷(非选择题,共 60 分)
16.(10 分)烃 A 的产量可以衡量一个国家石油化工发展水平。以 A 为原料,制备乙酸乙酯的路线
如下图所示(部分无机试剂略去):
(1)A→B 的化学方程式为______,其反应类型为______.
(2)环氧乙烷( )可用于口罩灭菌。A、B、C、D 四种有机物中,与环氧乙烷互为同分异
构体的是______(填结构简式)。
(3)实验室由 B 和 D 制备乙酸乙酯的装置如右图所示。
①向试管中加入 B、D、浓硫酸的操作是______.
②该制备反应的化学方程式为______.
③饱和Na2CO3溶液的作用除了吸收 B 和 D,还有______.
17.(12 分)短周期元素 A、B、C,D、E 的原子序数依次增大,它们的相关信息如下表所示:
序号 相关信息
① A 的最高正价与最低负价的绝对值相差 2
② B 的一种核素的质量数为 18,中子数为 10
③ 所有短周期主族元素原子中,C 的原子半径最大
④ A、C、D 的最高价氧化物对应的水化物两两之间均可反应
⑤ E 的单质与甲烷在光照条件下可以发生取代反应
(1)简单气态氢化物:沸点 A______B(填“>”或“<”,下同),稳定性A______B。
(2)B、C、D 的简单离子半径由小到大的顺序为______(填化学符号)。B、C 按原个数比 1∶1 组
成的化合物的电子式为______。
(3)E 的最高价氧化物的水化物的化学式为______。写出一个能证明元素 E 原子比硫原子得电子
能力强的离子方程式______。
5
(4)向DE3的水溶液中滴加 C 的最高价氧化物对应水化物的水溶液至过量,依据实验现象可以说
明失电子能力 C>D,其理由是______。
18.(8 分) NO2 和 N2O4 是氮的两种重要氧化物。100℃时,在 2L 密闭容器中发生反应
N2O4(g)??????2NO2(g),各气体浓度随时间变化的情况如下图所示。
(1)代表NO2气体浓度随时间变化的曲线为______(填序号)。
?
(2)当 1
N2O4的浓度为0.06mol?L 时,反应时间为ts,则 0~ts 时,用NO2气体的浓度变化量表
达该反应的平均速率为______。
(3)反应达到平衡状态时,c?NO2?:c?N2O4??______。
(4)已知NO2(g)与SO2(g)发生可逆反应:NO2(g)?SO2(g)??????SO3(g)?NO(g)(该反应正向为放
热反应)。在一定条件下,向 1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法
正确的是( )
A.只要经过足够长的时间,可使c?SO2??0
B.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
C.达到平衡状态时,各物质的物质的量浓度相等
D.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
19.(14 分)氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。
某化学兴趣小组用氯气和相应的碱溶液反应制取 NaClO 和KClO3,制备装置如下图所示(部分加
?
持仪器略去),并研究KClO3的氧化性。已知:氯气与碱反应,温度较高时生成ClO3,温度较低
?
时生成ClO 。
6
(1)盛装浓盐酸的仪器名称是______。
(2)装置 A 烧瓶中反应的化学方程式为______。
(3)装置C中Cl2与试剂 a 反应的离子方程式为______。
(4)如果缺少装置 B,对制取 NaClO 和KClO3的影响是______。
(5)E中可选用试剂有______(填标号)。
A.饱和Na2CO3溶液B.浓H2SO4 C.饱和 NaCl 溶液 D.NaOH 溶液
(6)该小组在探究KClO3氧化性时,发现KClO3与NaHSO3的反应速率先增大后减小,反应为
? ? ? 2? ?
ClO3 ?3HSO3 ?Cl ?3SO4 ?3H 。小组分析认为,反应生成的离子可能对反应速率产生影响。
?
为了探究c?H ?对化学反应速率的影响,设计如下实验:
实验序 温度 ?1 ?1 ?1
0.1mol?L KClO3 0.3mol?L NaHSO3 0.2mol?L 盐酸 H2O
号
① 25℃ 10mL 10mL 0mL 1mL
② 25℃ 10mL 10mL 1mL 0mL
该实验______(填“能”或“不能”)达到实验目的,理由是______。
20.(16 分)氢气因燃值高、燃烧产物无污染,被公认为清洁能源。
(1)电解饱和食盐水可制取氢气,该反应的化学方程式为______。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g)
-1
ΔH=49.0 kJ·mol
1
②CH3OH(g)+ O2(g)===CO2(g)+2H2(g)
2
-1
ΔH=-192.9 kJ·mol
-1
又知:③H2O(g)===H2O(l) ΔH=-44 kJ·mol
则 表 示 甲 醇 摩 尔 燃 烧 焓 的 热 化 学 方 程 式 为
7
________________________________________________________________
(3)已知1molH2完全燃烧生成H2O(g),放出245kJ 能量。根据下列信息,计算a?______。
(4)氢氧燃料电池是符合绿色化学理念的新型发电装置,下图为氢氧燃料电池的示意图。
①在导线中电子流动方向为______(用 a、b 表示)。
②电极表面镀一层细小的铂粉,其目的是______。
? ?
③该电池的负极反应式为H2 ?2e ?2OH ?2H2O,请写出正极反应式______。
④假设该电池每发 1 度电(1 度 6
?3.6?10 J )能生成 450g 水蒸气,则该电池的能量转化率为
______(保留小数点后一位)。
8
高一化学参考答案
选择题(40 分)
题号 1 2 3 4 5 6 7 8
答案 A B C B A C B C
题号 9 10 11 12 13 14 15
答案 C D BC D BD AD B
16.(10 分)
催化剂
(1)CH2 ?CH2 ?H2O????CH3CH2OH(2 分)加成反应(1 分)
(2)CH3CHO(2 分)
(3)①先将乙酸和乙醇混合,再缓慢加入浓硫酸,并振荡(2 分)
浓硫酸
②CH3COOH?CH3CH2OH?????
△?????CH3COOCH2CH3?H2O(2 分)
③降低乙酸乙酯的溶解度(1 分)
17.(12 分)
(1)<(1 分)<(1 分)
? ? ?
(2) 3 2
Al ? Na ?O (2 分) (2 分)
? ?
(3) 2
HClO4(2 分)Cl2 ?S ?2Cl ?S?(或其他合理答案)(2 分)
(4)生成的 Al(OH)3 沉淀能够溶于 NaOH 溶液中,说明 Al(OH)3 为两性氢氧化物,碱性
Al(OH)3 ?NaOH (2 分)
18.(8 分)
0.08 ? ?
(1)①(2 分) (2) 1 1
mol?L ?s (2 分) (3)3:1(2 分) (4)BD(2 分)
t
19.(14 分)
(1)分液漏斗(2 分)
△
(2)MnO2 ?4HCl?浓? MnCl2 ?Cl2 ??2H2O(2 分)
? △ ? ?
(3)3Cl2 ?6OH ClO3 ?5Cl ?3H2O(2 分)
(4)降低KClO3的产率(2 分)
(5)AD(2 分)
? ?
(6)不能(2 分)盐酸电离出的 Cl 也属于反应生成的离子,无法排除 Cl 的影响(或
? ? ?
Cl ?ClO3 ?H ?Cl2 ?H2O)(2 分)
20.(16 分)
9
通电
(1)2NaCl?2H2O 2NaOH?Cl2 ??H2 ?(2 分)
3 -1
(2)CH3OH(g)+ O2(g)===CO2(g)+2H2O(l) ΔH=-764.7 kJ·mol (3 分)
2
(3)930(3 分)
(4)①a→b(2 分)②吸附气体,增大气体反应物的浓度,加快电极反应速率(2 分)
? ?
③O2 ?2H2O?4e ?4OH (2 分)④58.8%(2 分)
10
同课章节目录
