人教版化学选修6《实验化学》实验4-2 金属镁、铝、锌化学性质的探究 课件(共28张PPT)
文档属性
| 名称 | 人教版化学选修6《实验化学》实验4-2 金属镁、铝、锌化学性质的探究 课件(共28张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 849.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-13 14:33:19 | ||
图片预览








文档简介
人教版(选修6)《实验化学》
实验4-2 《金属镁、铝、锌化学性质的探究》
第四单元 研究型实验
课题一 物质性质的研究
实验探究的步骤:
实验目的:
实验方法:
实验过程:
实验结论:
要探究的问题,想知道或证明什么?
反应原理、仪器、条件,设计实验步骤
记录数据、现象
整理、讨论、分析、得出结论
【思考、交流】
物质的性质有哪些?
物理性质:颜色、气味、状态、熔点、沸点、
密度、溶解性、导电性等
化学性质:
类 别: 通性
化合价: 氧化性、还原性
特 性:
2.我们通常从哪些方面研究某一类物质(金属、非金属,有机物、无机物等)的性质?
物质的分类: 通性(相同)
化合价: 氧化性、还原性
特 性: (特殊性)
价类二元图像(铁)
指出F转化为C反应类型:
指出G转化为F反应类型:
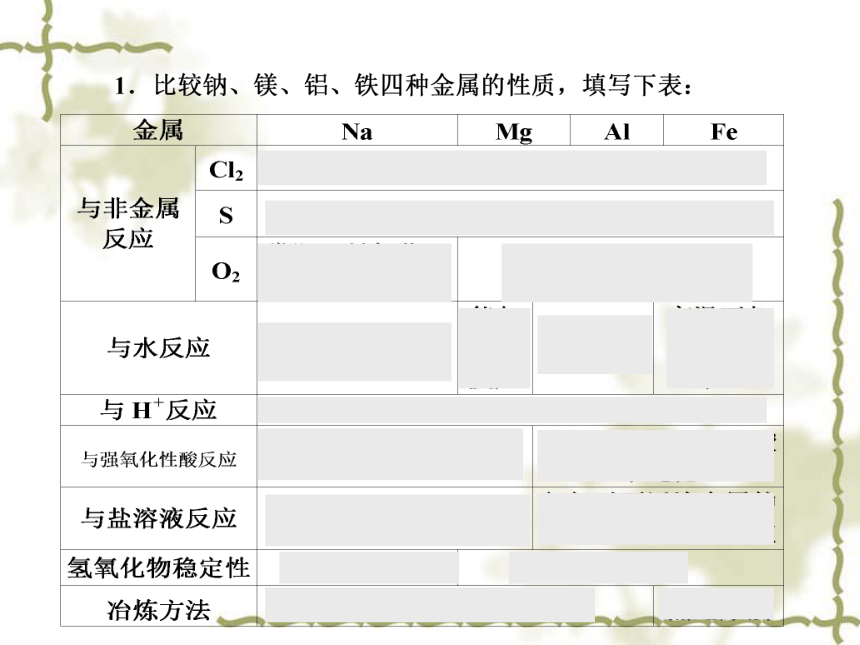
【复习】我们已经学习钠、铝、镁、铁的性质,请完成下列表格:(展示表格)
能否反应?反应条件?反应产物?特殊反应?
2.写出下列反应的化学方程式:
(1)铁粉溶于盐酸:
(2)钠与硫酸铜溶液反应:
(3)铝与Fe2O3发生铝热反应:
(4)铝与氢氧化钠溶液反应:
(5)写出硫与铁的反应:
(6)电解制备铝:
高温
高温
电解
【总结】金属共性:
金属共性:与活泼非金属,与水,酸的反应,与盐反应)
金属活泼性差异:
1、理论(金属活动顺序表,结构、周期表、律)
2、实验(置换反应,最高价氧化物对应水化物的碱性强弱,与酸或水反应置换出氢气的难易程度,相同浓度盐溶液的PH、原电池正负极,电解池放电顺序等)
金属特性:与氧化物的反应,与碱反应
【探究】锌及其化合物性质的探究
【活动】 各成员小组共同写出所有锌及其化合物(越多越好)各小组进行展示
锌与其他金属性质上的相似性及特殊性。
金属锌是常见金属,锌元素是人体必需的微量元素之一,是人体多种蛋白质的核心组成部分。锌及其化合物有多种用途。锌被人称为智慧元素,对脑的发育和功能成熟起重要作用。缺少锌会引起部分疾病。如免疫功能下降,神经功能障碍。过多会引起恶心、呕吐等。现在我们将探究锌及其化合物的性质。
2、把你们写出含锌物质进行分类(越系统越好)(小组展示,并说出分组依据)
【设问】:利用你所掌握的知识,每组物质中选出一个作为代表物,预测其化学性质。
并设计实验进行有验证。
试预测下列物质化学性质,并设计实验进行有验证。
设计并完成类似表格
提示:1、实验步骤中要注意试剂的浓度,量,先后的顺序
2、实验现象要全面
加热条件下能发生反应
剧烈反应,生成白色物质
都能产生气体,有爆鸣声
锌可以和强酸、强碱反应
褪色,有固体物质析出
可发生氧化还原反应
取混合的锌粉与硫粉在石棉网上,用酒精灯加热
分别取少量锌粉放入两支试管,各加入适量的硫酸、NaOH溶液,
分别取少量锌粉放入两支试管,各加入适量的硫酸铜、硫酸铁溶液,
pH<7
镁条表面析出
一层银白色略
带青蓝色的金属
,并有气泡冒出
Zn2+溶液
水解显酸性
镁与盐溶液
发生置换反应
盐溶液能
与碱溶液反
应, Zn(OH)2
是弱碱
两支试管中均产
生白色沉淀
三支试管中的白
色沉淀均溶解
Zn(OH)2能与
盐酸、NaOH
溶液、氨水
反应
4
ⅡB
两个
易失去两个
较活泼
金属氧化物
强碱
通性
两性
复分解
氧化还原
锌性质总结
产生气泡较慢
产生气泡快
产生气泡较快
铝条
镁条
产生少量氢气、有红色铜析出
产生大量氢气和蓝色沉淀
有红色铜析出
实验结论:金属活泼性:Mg>Al>Zn
镁与盐溶液反应时,往往会促进盐的水解。
如镁与硫酸铜溶液反应时会产生氢气并生成氢氧化铜沉淀。
[归纳总结]
锌及其化合物性质的探究实验的关键
(1)对锌及其化合物正确分类,并根据类别进行正确预测。
(2)选择正确的试剂并注意试剂的用量及实验条件,正确记录现象,总结锌及其化合物的性质,并与铝及其化合物性质进行类比。
研究物质性质的思路
类别
氧化还原反应
周期律
【应用】1、设计实验:由粗锌ZnO(或闪锌矿焙烧的矿粉)制备ZnSO4·7H2O
流程:(1)ZnSO4·7H2O溶液制备:称取市售粗ZnO(闪锌矿焙烧所得的矿粉)30g放在250mL烧杯中,加入2 mol·L-1H2SO4 150~180mL,在不断搅拌下,加热至90℃,并保持该温度下使之溶解,同时用ZnO调节溶液的pH≈4,趁热减压过滤,滤液置于250mL烧杯中.
(2)氧化除Fe2+,Mn2+杂质:将上面滤液加热至80~90℃后,滴加
0.5 mol·L-1KMnO4至呈微红时停止加入,继续加热至溶液为无色,并控制溶液pH=4,趁热减压过滤,弃去残渣,滤液置于250mL烧杯中.
(3)置换除Ni2+,Cd2+杂质:将除去杂质的滤液加热至80℃左右,在不断搅拌下分批加入1g纯锌粉,反应10min后,检查溶液中杂质是否除尽(如何检查?), 冷却减压过滤,滤液置于250mL烧杯中.
(4)ZnSO4·7H2O结晶:量取精制后的ZnSO4母液 于100mL烧杯中,滴加3 mol·L-1H2SO4调节至溶液的pH≈1,将溶液转移至洁净的蒸发皿中,水浴加热蒸发至液面出现晶膜后,停止加热,冷却结晶,减压过滤,晶体用滤纸吸干后称量,计算产率
酸溶
粗ZnO
氧化锌
(1)
硫酸溶液
残渣
滤液
酸溶
粗ZnO
残渣
除铁、锰
氧化锌
硫酸溶液
残渣
KMnO4
PH=4
除镍、镉
残渣
少量锌
… …
ZnSO4·7H2O
实验4-2 《金属镁、铝、锌化学性质的探究》
第四单元 研究型实验
课题一 物质性质的研究
实验探究的步骤:
实验目的:
实验方法:
实验过程:
实验结论:
要探究的问题,想知道或证明什么?
反应原理、仪器、条件,设计实验步骤
记录数据、现象
整理、讨论、分析、得出结论
【思考、交流】
物质的性质有哪些?
物理性质:颜色、气味、状态、熔点、沸点、
密度、溶解性、导电性等
化学性质:
类 别: 通性
化合价: 氧化性、还原性
特 性:
2.我们通常从哪些方面研究某一类物质(金属、非金属,有机物、无机物等)的性质?
物质的分类: 通性(相同)
化合价: 氧化性、还原性
特 性: (特殊性)
价类二元图像(铁)
指出F转化为C反应类型:
指出G转化为F反应类型:
【复习】我们已经学习钠、铝、镁、铁的性质,请完成下列表格:(展示表格)
能否反应?反应条件?反应产物?特殊反应?
2.写出下列反应的化学方程式:
(1)铁粉溶于盐酸:
(2)钠与硫酸铜溶液反应:
(3)铝与Fe2O3发生铝热反应:
(4)铝与氢氧化钠溶液反应:
(5)写出硫与铁的反应:
(6)电解制备铝:
高温
高温
电解
【总结】金属共性:
金属共性:与活泼非金属,与水,酸的反应,与盐反应)
金属活泼性差异:
1、理论(金属活动顺序表,结构、周期表、律)
2、实验(置换反应,最高价氧化物对应水化物的碱性强弱,与酸或水反应置换出氢气的难易程度,相同浓度盐溶液的PH、原电池正负极,电解池放电顺序等)
金属特性:与氧化物的反应,与碱反应
【探究】锌及其化合物性质的探究
【活动】 各成员小组共同写出所有锌及其化合物(越多越好)各小组进行展示
锌与其他金属性质上的相似性及特殊性。
金属锌是常见金属,锌元素是人体必需的微量元素之一,是人体多种蛋白质的核心组成部分。锌及其化合物有多种用途。锌被人称为智慧元素,对脑的发育和功能成熟起重要作用。缺少锌会引起部分疾病。如免疫功能下降,神经功能障碍。过多会引起恶心、呕吐等。现在我们将探究锌及其化合物的性质。
2、把你们写出含锌物质进行分类(越系统越好)(小组展示,并说出分组依据)
【设问】:利用你所掌握的知识,每组物质中选出一个作为代表物,预测其化学性质。
并设计实验进行有验证。
试预测下列物质化学性质,并设计实验进行有验证。
设计并完成类似表格
提示:1、实验步骤中要注意试剂的浓度,量,先后的顺序
2、实验现象要全面
加热条件下能发生反应
剧烈反应,生成白色物质
都能产生气体,有爆鸣声
锌可以和强酸、强碱反应
褪色,有固体物质析出
可发生氧化还原反应
取混合的锌粉与硫粉在石棉网上,用酒精灯加热
分别取少量锌粉放入两支试管,各加入适量的硫酸、NaOH溶液,
分别取少量锌粉放入两支试管,各加入适量的硫酸铜、硫酸铁溶液,
pH<7
镁条表面析出
一层银白色略
带青蓝色的金属
,并有气泡冒出
Zn2+溶液
水解显酸性
镁与盐溶液
发生置换反应
盐溶液能
与碱溶液反
应, Zn(OH)2
是弱碱
两支试管中均产
生白色沉淀
三支试管中的白
色沉淀均溶解
Zn(OH)2能与
盐酸、NaOH
溶液、氨水
反应
4
ⅡB
两个
易失去两个
较活泼
金属氧化物
强碱
通性
两性
复分解
氧化还原
锌性质总结
产生气泡较慢
产生气泡快
产生气泡较快
铝条
镁条
产生少量氢气、有红色铜析出
产生大量氢气和蓝色沉淀
有红色铜析出
实验结论:金属活泼性:Mg>Al>Zn
镁与盐溶液反应时,往往会促进盐的水解。
如镁与硫酸铜溶液反应时会产生氢气并生成氢氧化铜沉淀。
[归纳总结]
锌及其化合物性质的探究实验的关键
(1)对锌及其化合物正确分类,并根据类别进行正确预测。
(2)选择正确的试剂并注意试剂的用量及实验条件,正确记录现象,总结锌及其化合物的性质,并与铝及其化合物性质进行类比。
研究物质性质的思路
类别
氧化还原反应
周期律
【应用】1、设计实验:由粗锌ZnO(或闪锌矿焙烧的矿粉)制备ZnSO4·7H2O
流程:(1)ZnSO4·7H2O溶液制备:称取市售粗ZnO(闪锌矿焙烧所得的矿粉)30g放在250mL烧杯中,加入2 mol·L-1H2SO4 150~180mL,在不断搅拌下,加热至90℃,并保持该温度下使之溶解,同时用ZnO调节溶液的pH≈4,趁热减压过滤,滤液置于250mL烧杯中.
(2)氧化除Fe2+,Mn2+杂质:将上面滤液加热至80~90℃后,滴加
0.5 mol·L-1KMnO4至呈微红时停止加入,继续加热至溶液为无色,并控制溶液pH=4,趁热减压过滤,弃去残渣,滤液置于250mL烧杯中.
(3)置换除Ni2+,Cd2+杂质:将除去杂质的滤液加热至80℃左右,在不断搅拌下分批加入1g纯锌粉,反应10min后,检查溶液中杂质是否除尽(如何检查?), 冷却减压过滤,滤液置于250mL烧杯中.
(4)ZnSO4·7H2O结晶:量取精制后的ZnSO4母液 于100mL烧杯中,滴加3 mol·L-1H2SO4调节至溶液的pH≈1,将溶液转移至洁净的蒸发皿中,水浴加热蒸发至液面出现晶膜后,停止加热,冷却结晶,减压过滤,晶体用滤纸吸干后称量,计算产率
酸溶
粗ZnO
氧化锌
(1)
硫酸溶液
残渣
滤液
酸溶
粗ZnO
残渣
除铁、锰
氧化锌
硫酸溶液
残渣
KMnO4
PH=4
除镍、镉
残渣
少量锌
… …
ZnSO4·7H2O
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
