江西省景德镇一高2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 江西省景德镇一高2020-2021学年高一下学期期末考试化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 954.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-13 23:14:54 | ||
图片预览



文档简介
1082040011861800景德镇一中2020~2021学年第二学期期末考试卷
高一化学
可能用到的相对原子质量:H:1 Li:7 O:16 Cu:64
选择题(每小题3分共48分)
1...中华文明源远流长,下面中国国宝级文物的表面不会因电化学腐蚀被氧化的是:
A. 秦朝铜车马 B. 春秋越王剑
C. 唐三彩 D. 商代司母戊鼎
2.下列过程不需要通电就可进行的是( )
A.电离 B.电解 C.电镀 D.工业冶炼铝
3.下列能量转化过程与氧化还原反应无关的是( )
4181475781050A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
3495675228604.臭氧层中氧分解过程如图所示,下列说法正确的是( )
A.催化反应①②均为放热反应
B.催化剂不能改变该反应的焓变
C.ClO是该反应的催化剂
D.在该反应过程中没有化学键的断裂与生成
5..食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A. “双吸剂”中的生石灰有吸水作用
B. “双吸剂”吸收氧气时,发生了原电池反应
C. 炭粉上发生的反应为:O2+4e-+4H+=2H2O
D. 吸收氧气的过程中,铁作原电池的负极
6..如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是( )
A. 图中Ec与E之差表示活化能
B. 升高温度,图中阴影部分面积会增大
C. 使用合适的催化剂,E不变,Ec变小
D. 能量大于Ec的分子间发生的碰撞一定是有效碰撞
7..已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1 2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为( )
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H D.△H1-5△H2-12△H3
8.下列各装置中,在铜电极上不能产生气泡的是( )
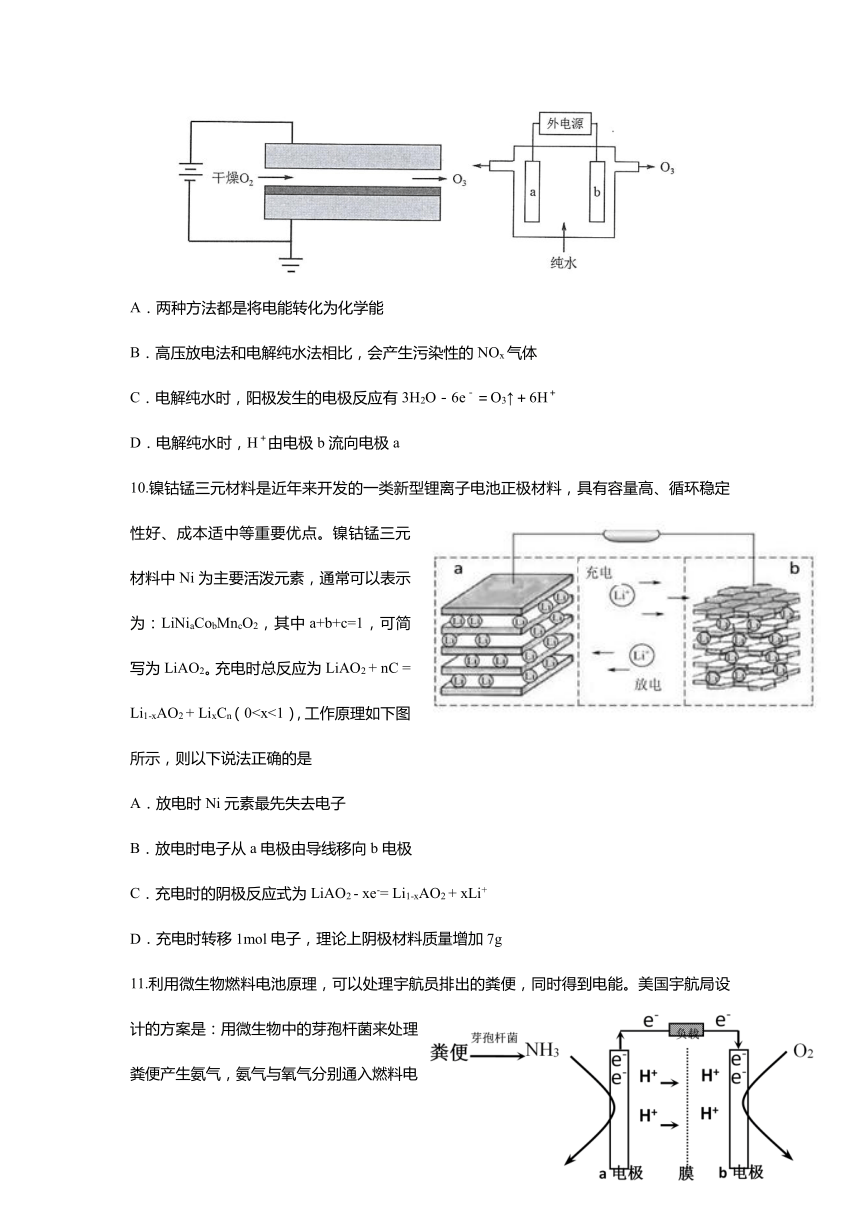
9.臭氧很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中高压放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是
A.两种方法都是将电能转化为化学能
B.高压放电法和电解纯水法相比,会产生污染性的NOx气体
C.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
D.电解纯水时,H+由电极b流向电极a
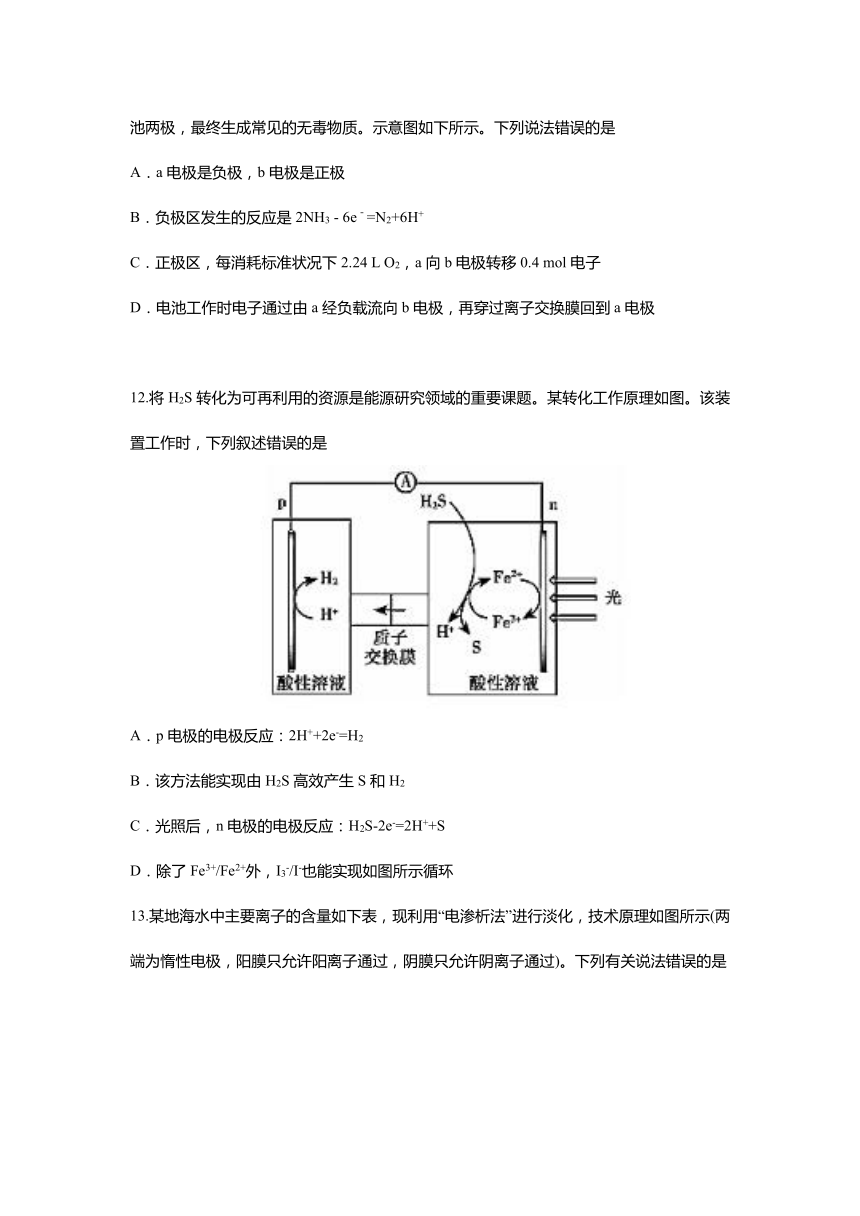
257937049720510.镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0A.放电时Ni元素最先失去电子
B.放电时电子从a电极由导线移向b电极
C.充电时的阴极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D.充电时转移1mol电子,理论上阴极材料质量增加7g
264604547434511.利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
12.将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
13.某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
A.甲室的电极反应式为:2Cl--2e-= Cl2↑ B.淡化过程中易在戊室形成水垢
C.乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D.当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
14.已知:C(s,石墨)===C(s,金刚石) ΔH=+1.9kJ·mol-1。下列有关说法正确的是( )
A.相同条件下,1mol石墨比1mol金刚石能量高
B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
C.若:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5kJ·mol-1
则有:C(s,金刚石)+O2(g)===CO2(g) ΔH2=-395.4kJ·mol-1
D.相同条件下,金刚石比石墨稳定
15.如图是利用水银为阴极电解食盐水制备苛性钠的原理示意图。已知在水银电极上钠离子比氢离子容易放电。下列说法不正确的是( )
A丁电极是负极,电解液中pH增大 B.气体甲是氯气,气体乙是氢气
C.电子迁移路径:碳棒→丙电极,丁电板→水银 D.该方法获取的苛性钠纯度高,但存在汞蒸气污染
16.用碳棒做电极电解2L某浓度的硫酸铜溶液,电解一段时间后,若使电解后的溶液恢复到原来的浓度需加入0.1mol的氢氧化铜,则电解过程中转移电子的物质的量( )
A.0.2mol B.0.3mol C.o.4mol D.o.6mol
非选择题( 共52分)
17.Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
该历程中,放热最多的步骤的化学方程式为______________________________________________。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
。
402844028575(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式
。
Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
3409315118745(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________。
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
410464026035E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
18.Ⅰ.如下图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
(1)写出甲电解池中的电解反应方程式:甲______________________________。
(2)若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为________。
(3)若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________。
40246301466850Ⅱ.将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属
电流方向
电压/V
A
Cu→A
+0.78
B
B→Cu
-0.15
C
Cu→C
+1.35
D
Cu→D
+0.30
已知:构成两电极的金属其活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)________金属可能是最强的还原剂。(填字母)
(2)________金属一定不能从硫酸铜溶液中置换出铜。(填字母)
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是________(填字母)。金属对应的原电池的正极电极反应式为 __________________________________________________________________________________。
19.Ⅰ为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_____________(填“正”或“负”)极,该装置内发生反应的化学方程式为___________________________________________
___________________________________________________________。
4275455345440(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
Ⅱ(1)1.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是__ ____。
(2).利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为__ _____。
(3)如图是电沉积法制取金属Ni所使用的电解装置。
3221355-53340①在电解过程中C室可能发生的电极反应方程式为________________________________,________________________________
②电解一段时间后B室中氯化钠的浓度______1%(填“大于”“小于”或“等于”)。
20.为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20oC)AgCl:1.5×10-4 g Ag2SO4:0.796 g
(1)甲同学的实验如下:
序号
操作
现象
实验Ⅰ
将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中
产生白色沉淀,随后有黑色固体产生
取上层清液,滴加KSCN溶液
溶液变红
注:经检验黑色固体为Ag
① 白色沉淀的化学式是 。
② 甲同学得出Ag+氧化了Fe2+的依据是 。
33204156985(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为: 偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是 。
② b中电压表指针逆向偏移后,银为 极(填“正”或“负”)。
③ 由实验得出Ag+和Fe2+反应的离子方程式是 。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
序号
操作
现象
实验Ⅲ
将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中
银镜消失
实验Ⅳ
将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中
银镜减少,未消失
实验Ⅴ
将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中
银镜消失
① 实验Ⅲ (填“能”或“不能”)证明Fe3+氧化了Ag,理由是 。
高一化学期末参考答案
1-16 C A A B C D C B B D D C D C A C
17、Ⅰ、答案 A CHO*+3H*=CO*+4H*(或CHO*=CO*+H*)
Ⅱ、(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5 kJ/mol
(2)2H2+2NO=N2+2H2O
Ⅲ、(1)CH3OH(l)+false O2(g) ===CO2(g)+2H2O(l) ΔH=-726.0 kJ/mol (2)ACE
18、Ⅰ、(1)2CuSO4+2H2O2Cu+O2↑+2H2SO4
(2)4.48 L (3)1 mol·L-1
Ⅱ、答案:(1)C (2)B (3)B O2+2H2O+4e-===4OH-
19、Ⅰ、(1)H2-2e-+2OH-=2H2O;(2)氢氧化钠和氢气;
(3)负 2NaCl+2H2O=2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO;(4)3:4
Ⅱ、阳极 Cu可以发生氧化反应生成Cu2+ N 牺牲阳极的阴极保护法。
①Ni2++2e?=Ni、2H++2e?=H2↑ ②大于
20、(1)① Ag2SO4
② 有黑色固体(Ag)生成,加入KSCN溶液后变红
(2)① Fe2+ -e-=Fe3+(2分) ② 负(2分)
③ Fe2++Ag+ Fe3++Ag(2分)
(3)① 不能 因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag。
高一化学
可能用到的相对原子质量:H:1 Li:7 O:16 Cu:64
选择题(每小题3分共48分)
1...中华文明源远流长,下面中国国宝级文物的表面不会因电化学腐蚀被氧化的是:
A. 秦朝铜车马 B. 春秋越王剑
C. 唐三彩 D. 商代司母戊鼎
2.下列过程不需要通电就可进行的是( )
A.电离 B.电解 C.电镀 D.工业冶炼铝
3.下列能量转化过程与氧化还原反应无关的是( )
4181475781050A.硅太阳能电池工作时,光能转化成电能 B.锂离子电池放电时,化学能转化成电能
C.电解质溶液导电时,电能转化成化学能
D.葡萄糖为人类生命活动提供能量时,化学能转化成热能
3495675228604.臭氧层中氧分解过程如图所示,下列说法正确的是( )
A.催化反应①②均为放热反应
B.催化剂不能改变该反应的焓变
C.ClO是该反应的催化剂
D.在该反应过程中没有化学键的断裂与生成
5..食品保鲜所用的“双吸剂”,是由还原铁粉、生石灰、氯化钠、炭粉等按一定比例组成的混合物,可吸收氧气和水。下列分析不正确的是( )
A. “双吸剂”中的生石灰有吸水作用
B. “双吸剂”吸收氧气时,发生了原电池反应
C. 炭粉上发生的反应为:O2+4e-+4H+=2H2O
D. 吸收氧气的过程中,铁作原电池的负极
6..如图,这种具有不同能量的分子百分数和能量的对应关系图,叫做一定温度下分子能量分布曲线图。图中E表示分子平均能量,Ec是活化分子具有的最低能量。下列说法不正确的是( )
A. 图中Ec与E之差表示活化能
B. 升高温度,图中阴影部分面积会增大
C. 使用合适的催化剂,E不变,Ec变小
D. 能量大于Ec的分子间发生的碰撞一定是有效碰撞
7..已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1 2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为( )
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H D.△H1-5△H2-12△H3
8.下列各装置中,在铜电极上不能产生气泡的是( )
9.臭氧很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中高压放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是
A.两种方法都是将电能转化为化学能
B.高压放电法和电解纯水法相比,会产生污染性的NOx气体
C.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
D.电解纯水时,H+由电极b流向电极a
257937049720510.镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0
B.放电时电子从a电极由导线移向b电极
C.充电时的阴极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D.充电时转移1mol电子,理论上阴极材料质量增加7g
264604547434511.利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
12.将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
13.某地海水中主要离子的含量如下表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是
A.甲室的电极反应式为:2Cl--2e-= Cl2↑ B.淡化过程中易在戊室形成水垢
C.乙室和丁室中部分离子的浓度增大,淡水的出口为 b
D.当戊室收集到22.4L(标准状况)气体时,通过甲室阳膜的离子的物质的量一定为2mol
14.已知:C(s,石墨)===C(s,金刚石) ΔH=+1.9kJ·mol-1。下列有关说法正确的是( )
A.相同条件下,1mol石墨比1mol金刚石能量高
B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
C.若:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5kJ·mol-1
则有:C(s,金刚石)+O2(g)===CO2(g) ΔH2=-395.4kJ·mol-1
D.相同条件下,金刚石比石墨稳定
15.如图是利用水银为阴极电解食盐水制备苛性钠的原理示意图。已知在水银电极上钠离子比氢离子容易放电。下列说法不正确的是( )
A丁电极是负极,电解液中pH增大 B.气体甲是氯气,气体乙是氢气
C.电子迁移路径:碳棒→丙电极,丁电板→水银 D.该方法获取的苛性钠纯度高,但存在汞蒸气污染
16.用碳棒做电极电解2L某浓度的硫酸铜溶液,电解一段时间后,若使电解后的溶液恢复到原来的浓度需加入0.1mol的氢氧化铜,则电解过程中转移电子的物质的量( )
A.0.2mol B.0.3mol C.o.4mol D.o.6mol
非选择题( 共52分)
17.Ⅰ.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
该历程中,放热最多的步骤的化学方程式为______________________________________________。
Ⅱ.TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
(1)沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式
。
402844028575(2)工业上处理尾气中NO的方法为:将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化如图所示。写出图示转化的总反应的化学方程式
。
Ⅲ.甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol ③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
3409315118745(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________。
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
410464026035E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
18.Ⅰ.如下图为相互串联的甲、乙两个电解池(电极都是惰性电极),请回答:
(1)写出甲电解池中的电解反应方程式:甲______________________________。
(2)若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为________。
(3)若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________。
40246301466850Ⅱ.将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属
电流方向
电压/V
A
Cu→A
+0.78
B
B→Cu
-0.15
C
Cu→C
+1.35
D
Cu→D
+0.30
已知:构成两电极的金属其活动性相差越大,电压表读数越大。请依据表中数据判断:
(1)________金属可能是最强的还原剂。(填字母)
(2)________金属一定不能从硫酸铜溶液中置换出铜。(填字母)
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是________(填字母)。金属对应的原电池的正极电极反应式为 __________________________________________________________________________________。
19.Ⅰ为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
(1)甲装置中,a电极的反应式为________________________________________。
(2)乙装置中,阴极区产物为_________________________。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为_____________(填“正”或“负”)极,该装置内发生反应的化学方程式为___________________________________________
___________________________________________________________。
4275455345440(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________(不考虑气体的溶解)。
Ⅱ(1)1.镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是__ ____。
(2).利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为__ _____。
(3)如图是电沉积法制取金属Ni所使用的电解装置。
3221355-53340①在电解过程中C室可能发生的电极反应方程式为________________________________,________________________________
②电解一段时间后B室中氯化钠的浓度______1%(填“大于”“小于”或“等于”)。
20.为探究Ag+与Fe3+氧化性的相关问题,某小组同学进行如下实验:
已知:相关物质的溶解度(20oC)AgCl:1.5×10-4 g Ag2SO4:0.796 g
(1)甲同学的实验如下:
序号
操作
现象
实验Ⅰ
将2 mL 1 mol/L AgNO3溶液加入到1 mL 1 mol/L FeSO4溶液中
产生白色沉淀,随后有黑色固体产生
取上层清液,滴加KSCN溶液
溶液变红
注:经检验黑色固体为Ag
① 白色沉淀的化学式是 。
② 甲同学得出Ag+氧化了Fe2+的依据是 。
33204156985(2)乙同学为探究Ag+和Fe2+反应的程度,进行实验Ⅱ。
a.按右图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移。偏移的方向表明:电子由石墨经导线流向银。放置一段时间后,指针偏移减小。
b.随后向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为: 偏移减小→回到零点→逆向偏移。
① a中甲烧杯里的电极反应式是 。
② b中电压表指针逆向偏移后,银为 极(填“正”或“负”)。
③ 由实验得出Ag+和Fe2+反应的离子方程式是 。
(3)为进一步验证乙同学的结论,丙同学又进行了如下实验:
序号
操作
现象
实验Ⅲ
将2 mL 2 mol/L Fe(NO3)3溶液加入有银镜的试管中
银镜消失
实验Ⅳ
将2 mL1 mol/L Fe2(SO4)3溶液加入有银镜的试管中
银镜减少,未消失
实验Ⅴ
将2 mL 2 mol/L FeCl3溶液加入有银镜的试管中
银镜消失
① 实验Ⅲ (填“能”或“不能”)证明Fe3+氧化了Ag,理由是 。
高一化学期末参考答案
1-16 C A A B C D C B B D D C D C A C
17、Ⅰ、答案 A CHO*+3H*=CO*+4H*(或CHO*=CO*+H*)
Ⅱ、(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g) △H=-45.5 kJ/mol
(2)2H2+2NO=N2+2H2O
Ⅲ、(1)CH3OH(l)+false O2(g) ===CO2(g)+2H2O(l) ΔH=-726.0 kJ/mol (2)ACE
18、Ⅰ、(1)2CuSO4+2H2O2Cu+O2↑+2H2SO4
(2)4.48 L (3)1 mol·L-1
Ⅱ、答案:(1)C (2)B (3)B O2+2H2O+4e-===4OH-
19、Ⅰ、(1)H2-2e-+2OH-=2H2O;(2)氢氧化钠和氢气;
(3)负 2NaCl+2H2O=2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO;(4)3:4
Ⅱ、阳极 Cu可以发生氧化反应生成Cu2+ N 牺牲阳极的阴极保护法。
①Ni2++2e?=Ni、2H++2e?=H2↑ ②大于
20、(1)① Ag2SO4
② 有黑色固体(Ag)生成,加入KSCN溶液后变红
(2)① Fe2+ -e-=Fe3+(2分) ② 负(2分)
③ Fe2++Ag+ Fe3++Ag(2分)
(3)① 不能 因为Fe(NO3)3溶液呈酸性,酸性条件下NO3-也可能氧化Ag。
同课章节目录
