四川省绵阳市2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 四川省绵阳市2020-2021学年高一下学期期末考试化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 272.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-15 08:26:47 | ||
图片预览



文档简介
秘密 ★ 启用前 【考试时间2021年7月11日16:40~18:00】
高中2020级第一学年末教学质量测试
化 学
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。满分100分,考试时间80分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.糖类、油脂、蛋白质是生命体的重要物质,下列说法正确的是
A.蔗糖水解产物只有葡萄糖 B.鸡蛋清溶液加硫酸镁会发生变性
C.油脂的氢化是加成反应 D.淀粉和纤维素互为同分异构体
2.化学与生活密切相关,下列说法正确的是
A.棉花和保鲜膜的主要成分均属于天然高分子
B.铅蓄电池在充电过程中将电能转化为化学能
C.常温下,可用铝制贮罐贮运浓盐酸或浓硫酸
D.闪电时空气中有O3生成,O3与O2互为同位素
3. 防疫所用普通体温计中装有金属汞,汞的一种同位素为。下列关于的说法错误的是
A.质子数为80 B.核外电子数为80 C.核电荷数为120 D.中子数为120
4. 下列化学用语表达正确的是
A.次氯酸的电子式:),\s\do 7(‥))))))),\s\do 7(‥))H))))),\s\do 7(‥)))))) B.乙醇的结构简式:CH3CH2OH
C.CCl4分子的比例模型: D.N2的结构式:︰N≡N︰
5.中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是
A.铷位于周期表的第四周期第IA族 B.氢氧化铷属于弱碱
C.与钠的单质相比,铷的单质熔点更低 D.硝酸铷属于共价化合物
6.下列关于自然资源开发利用的说法中错误的是
A.工业生产镁的过程为:海水→氢氧化镁→氧化镁→金属镁
B.煤的干馏、煤的气化与石油的催化重整均属于化学变化
C.从海带中提取碘时,利用右图所示装置灼烧海带碎片
D.利用可再生资源作反应物符合绿色化学的要求
7.某化学反应的能量变化如图所示,下列说法错误的是
A.该反应可能不需要加热就能够发生
B.该反应断键吸收的总能量大于成键释放的总能量
C.该反应可能是化合反应,也可能是分解反应
D.该反应的化学方程式可能为
2Al+Fe2O3?Al2O3+2Fe
8.下列指定反应的化学方程式正确的是
A.Li在氧气中燃烧时的主要反应:4Li+O2?2Li2O
B.向稀硝酸溶液中加入少量锌粉:Zn+2H+ == Zn2++H2↑
C.乙烷与氯气的混合气体受光照:CH3CH3+Cl2??CH2ClCH2Cl+H2
D.乙烯与溴的加成:CH2=CH2+Br2?—→?CH3CHBr2
9.李华同学在学习了《有机化合物》一章后整理出以下笔记,其中错误的是
??????A.溴水可以用来区分乙酸、乙醇和苯
??????B.分子组成为C2H4Br2的物质可能是混合物
??????C.可用NaOH溶液除去溴苯中残留的溴
??????D.烷烃不能使酸性高锰酸钾溶液褪色,但能发生氧化反应
10.?设NA为阿伏加德罗常数的值。下列说法正确的是
A.36?g由35Cl和37Cl组成的氯气中所含质子数为17NA
B.3.36 L乙烯中所含碳原子数为0.3NA
C.17?g羟基(-OH)中含有的电子数为9NA
D.一定条件下,2?mol?SO2与2?mol?O2充分反应后分子总数为3NA
11.?微型银-锌电池的电极分别是Ag/Ag2O和Zn,KOH溶液作电解质溶液,电池总反应为Ag2O+Zn+H2O === 2Ag+Zn(OH)2?。对电池工作过程中的下列叙述错误的是
A.电流由Ag/Ag2O电极流出
B.电解液中OH-向负极迁移
C.负极反应为Zn-2e-+2OH-=== Zn(OH)2?
D.正极反应为Ag2O+2H++2e- === 2Ag+H2O
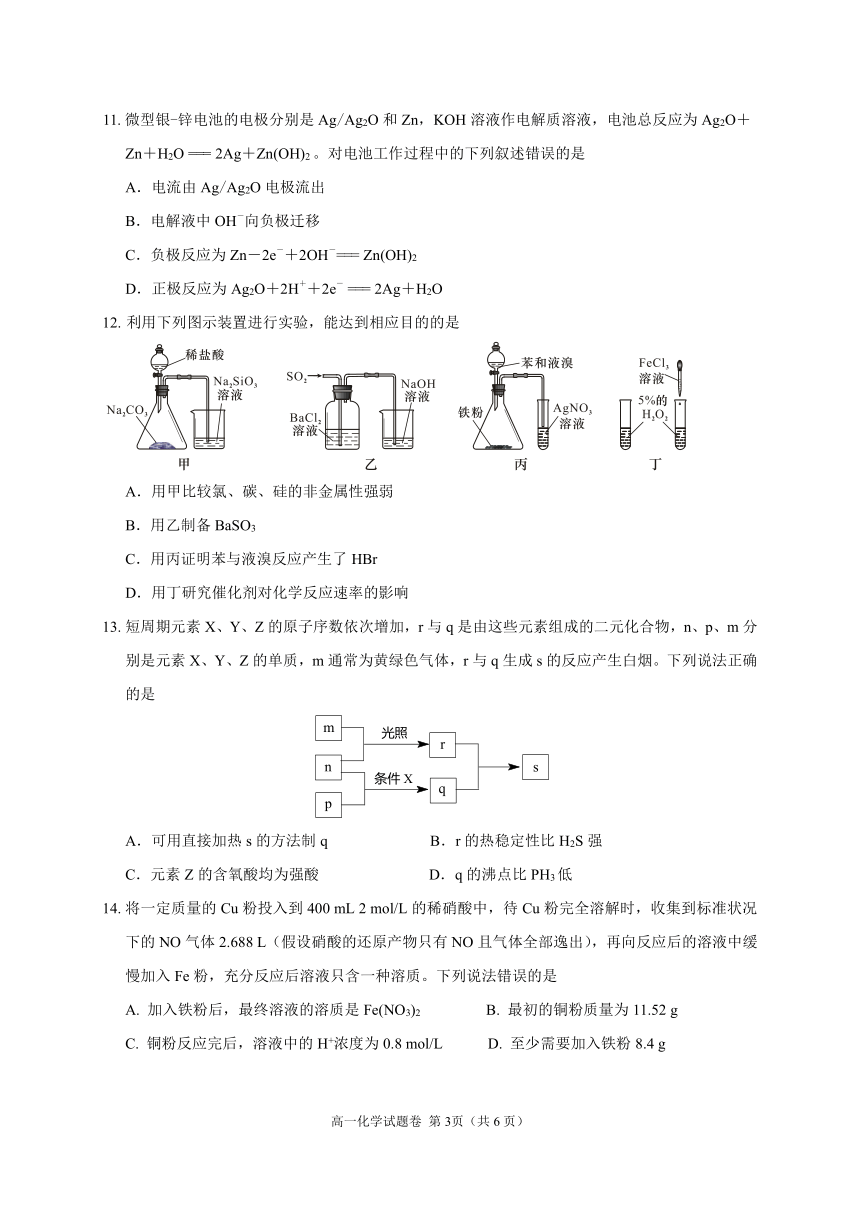
12. 利用下列图示装置进行实验,能达到相应目的的是
A.用甲比较氯、碳、硅的非金属性强弱
B.用乙制备BaSO3
C.用丙证明苯与液溴反应产生了HBr
D.用丁研究催化剂对化学反应速率的影响
13.?短周期元素X、Y、Z的原子序数依次增加,r与q是由这些元素组成的二元化合物,n、p、m分别是元素X、Y、Z的单质,m通常为黄绿色气体,r与q生成s的反应产生白烟。下列说法正确的是
A.可用直接加热s的方法制q ?B.r的热稳定性比H2S强
C.元素Z的含氧酸均为强酸 ?D.q的沸点比PH3低
14.?将一定质量的Cu粉投入到400?mL?2?mol/L的稀硝酸中,待Cu粉完全溶解时,收集到标准状况下的NO气体2.688 L(假设硝酸的还原产物只有NO且气体全部逸出),再向反应后的溶液中缓慢加入Fe粉,充分反应后溶液只含一种溶质。下列说法错误的是
A. 加入铁粉后,最终溶液的溶质是Fe(NO3)2 B. 最初的铜粉质量为11.52?g
C. 铜粉反应完后,溶液中的H+浓度为0.8 mol/L D. 至少需要加入铁粉8.4?g
第Ⅱ卷(非选择题,共58分)
二、(本题包括2小题,共24分)
15.(10分)制备乙酸乙酯是中学有机化学中的一个重要实验。某化学学习小组的同学查阅资料发现,某些无机盐类也可以催化乙酸乙酯的合成,为了探究不同盐的催化效果,设计了如下实验:
实验步骤:向大试管中加入一定量的无机盐催化剂,再加入3?mL无水乙醇和2?mL冰醋酸,按图连接装置。用酒精灯小心均匀地加热试管5?min,产生的蒸气经导管通到饱和碳酸钠溶液上方。
实验记录:使用不同的催化剂,实验得到的酯层高度如下表。
催化剂 酯层高度/cm 催化剂 酯层高度/cm
氯化铁晶体 2.7 氯化铝 3.2
A 2.2 氯化钠 0.0
(1)实验时,需要加入几粒沸石,目的是 。
(2)催化剂用量为3?mmol(以阳离子计),选用的催化剂A可能是 (填标号)。
a. 氯化铜晶体 b. 硫酸钙晶体 c. 碳酸钠晶体 d. 硝酸钾晶体
实验所用四种催化剂中,制备乙酸乙酯最好选用 。
(3)若用18O标记乙醇中的O,用氯化铝作催化剂时,产生乙酸乙酯的化学方程式为
。
(4)实验中用饱和碳酸钠溶液的作用是 。得到的混合液经 ,蒸馏,最终得到较纯净的乙酸乙酯。
16.(14分)乙酸环己酯是一种香料,可用于配制苹果、香蕉等果香型香精。一种制备乙酸环己酯的合成路线如下:
回答下列问题:
(1)反应①所用试剂是 ,由石油获得E的生产工艺称为 。
(2)G中官能团名称是 ,在反应①~④中,原子利用率理论上可达100%的是______(填序号)。
(3)反应③的化学方程式为 ,反应类型是 。
(4)下列关于合成路线中所涉及物质的说法正确的是 (填标号)。
a.A、E分子中的原子均处于同一平面 b.用水可分离A和B的混合物
c.D和E均能与KMnO4酸性溶液反应 d.F与D互为同系物
(5)X是E的同系物,其相对分子质量比E大42,X可能的结构有 种,其中含3个-CH3的X结构简式为 。
三、(本题包括2小题,共25分)
X
Y
W Q
17.(12分)短周期元素X、Y、Z、W、Q的原子序数依次增大,Z的原子半径是短周期主族元素中最大的,X、Y、W、Q在元素周期表中的位置如表所示,Y、Q的原子序数之和是X的4倍。回答下列问题:
(1)W的原子结构示意图为 ,X元素在周期表中的位置为________。
(2)Y、Z、Q三种元素所形成的简单离子,半径由大到小的顺序是 (填化学式,下同)。
(3)X与Y按原子数之比为1:2形成化合物的电子式为 ,Y与Z形成的一种化合物是淡黄色固体,该化合物中所含化学键的类型是 。
(4)以KOH稀溶液作电解质溶液,石墨作电极,X的简单氢化物甲和Y的双原子分子乙可组成燃料电池,其工作原理如右图所示。电池工作时,a极的电极反应式为 。
18.(13分)钨在冶金工业有重要作用,某化工企业以黑钨矿(主要成分FeWO4和MnWO4,W为+6价)为原料冶炼金属钨的过程如下:
回答下列问题:
(1)“熔融”前需将黑钨矿粉碎,其目的是 _____________________________。
(2)写出“熔融”过程中生成Fe2O3的化学方程式:_____________________。
(3)下列仪器中,过滤操作用到的有 (填标号),所得滤渣B的化学式为________________。
(4)检验沉淀D是否洗净的操作为 :取最后一次洗涤液少许于试管中,_________。
(5)产品E的化学式为WO3-x?,其中W的化合价有+5和+6两种。若x=0.1,则+5价的W(Ⅴ)占该化合物中钨元素总量的 ;该流程中由产品E冶炼金属钨的方法属于__________法。
四、(本题包括1小题,共9分)
19.(9分)CO2催化加氢合成二甲醚(CH3OCH3)是一种CO2转化方法,反应原理为:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
(1)加快该反应速率的措施有 (填两条)。
(2)能证明上述反应达到平衡状态是 (填标号)。
?A.v正(CO2)=3v逆(H2) B.CH3OCH3的浓度不再改变
?C.?不再变化 ?D.混合气体的平均相对分子质量不再改变
(3)某温度下,在体积为2 L的密闭容器中加入2 mol CO2与5 mol H2发生催化反应,经过10 min后CO2的浓度不再变化,测得其体积分数为20%。试计算:
①在0~10 min时段,用CH3OCH3表示的平均反应速率。
②起始状态与平衡状态容器内的压强之比。
(无计算过程不给分。)
高中2020级第一学年末教学质量测试
化学参考答案和评分标准
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.?C 2.?B 3.?C 4.?B 5.?C 6.?A 7.?D 8.?A 9.?A 10.?C 11.?D 12.?D 13.?B 14.?D
第Ⅱ卷(非选择题,共58分)
二、(本题包括2小题,共24分)
15. (10分)
(1)防暴沸(1分) (2)a(2分) 氯化铝(1分)
(3)(2分)
(4)除去乙酸和乙醇,降低乙酸乙酯的溶解度(2分) 分液(2分)
16.(14分)
(1)Fe粉、液溴(2分) 石油裂解(1分)
(2)羧基(1分) ②③(2分)
(3)CH2=CH2+H2OCH3CH2OH(2分) 加成反应(1分)
(4)a c(2分)
(5)5(2分) (1分)
三、(本题包括2小题,共25分)
17.(共12分,每空2分)
(1) 第二周期第ⅣA 族
(2)S2->O2->Na+
(3)::C:: 离子键、非极性键
(4) CH4-8e-+10OH-=== CO+7H2O
18.(13分,除最后一空1分外,其余每空2分)
(1)加快反应速率,使反应更充分
(2)4FeWO4+O2+4Na2CO3 2Fe2O3+4Na2WO4+4CO2
(3)A C E Fe2O3、MnO2
(4)滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,说明洗涤干净
(5)20% 或 热还原(1分)
四、(本题包括1小题,共9分)
19.(1)加热或升高温度,增大反应物浓度,改进催化剂,加压等(2分)
(2)B D(2分)
(3)解: 设反应达到平衡时消耗CO2 的物质的量为2x。
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
起始量/mol 2 5 0 0
变化量/mol 2 x 6 x x 3 x
平衡量/mol 2-2 x 5-6 x? ?x 3 x
由题意可得:×100%=20%
解得:x=0.5 mol ……………………………………………………………(2分)
0~10 min时段:v(CH3OCH3)==0.025 mol /(L·min) ……(1分)
同温同体积下
=== ……………(2分)
答:在0~10 min时段,用CH3OCH3表示的平均反应速率为0.025 mol /(L·min);起始状态与平衡状态容器内的压强之比为7:5?。
高一化学试题卷 第1页(共6页)
高中2020级第一学年末教学质量测试
化 学
本试卷分为试题卷和答题卡两部分,其中试题卷由第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)组成,共6页;答题卡共2页。满分100分,考试时间80分钟。
注意事项:
1. 答题前,考生务必将自己的学校、班级、姓名用0.5毫米黑色墨水签字笔填写清楚,同时用2B铅笔将考号准确填涂在“考号”栏目内。
2. 选择题使用2B铅笔填涂在答题卡对应题目标号的位置上,如需改动,用橡皮擦擦干净后再选涂其它答案;非选择题用0.5毫米黑色墨水签字笔书写在答题卡的对应框内,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
3. 考试结束后将答题卡收回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项最符合题意)
1.糖类、油脂、蛋白质是生命体的重要物质,下列说法正确的是
A.蔗糖水解产物只有葡萄糖 B.鸡蛋清溶液加硫酸镁会发生变性
C.油脂的氢化是加成反应 D.淀粉和纤维素互为同分异构体
2.化学与生活密切相关,下列说法正确的是
A.棉花和保鲜膜的主要成分均属于天然高分子
B.铅蓄电池在充电过程中将电能转化为化学能
C.常温下,可用铝制贮罐贮运浓盐酸或浓硫酸
D.闪电时空气中有O3生成,O3与O2互为同位素
3. 防疫所用普通体温计中装有金属汞,汞的一种同位素为。下列关于的说法错误的是
A.质子数为80 B.核外电子数为80 C.核电荷数为120 D.中子数为120
4. 下列化学用语表达正确的是
A.次氯酸的电子式:),\s\do 7(‥))))))),\s\do 7(‥))H))))),\s\do 7(‥)))))) B.乙醇的结构简式:CH3CH2OH
C.CCl4分子的比例模型: D.N2的结构式:︰N≡N︰
5.中国化学会遴选了118名青年化学家作为“元素代言人”,组成“中国青年化学家元素周期表”。第37号元素铷(Rb)由清华大学张如范代言。下列说法正确的是
A.铷位于周期表的第四周期第IA族 B.氢氧化铷属于弱碱
C.与钠的单质相比,铷的单质熔点更低 D.硝酸铷属于共价化合物
6.下列关于自然资源开发利用的说法中错误的是
A.工业生产镁的过程为:海水→氢氧化镁→氧化镁→金属镁
B.煤的干馏、煤的气化与石油的催化重整均属于化学变化
C.从海带中提取碘时,利用右图所示装置灼烧海带碎片
D.利用可再生资源作反应物符合绿色化学的要求
7.某化学反应的能量变化如图所示,下列说法错误的是
A.该反应可能不需要加热就能够发生
B.该反应断键吸收的总能量大于成键释放的总能量
C.该反应可能是化合反应,也可能是分解反应
D.该反应的化学方程式可能为
2Al+Fe2O3?Al2O3+2Fe
8.下列指定反应的化学方程式正确的是
A.Li在氧气中燃烧时的主要反应:4Li+O2?2Li2O
B.向稀硝酸溶液中加入少量锌粉:Zn+2H+ == Zn2++H2↑
C.乙烷与氯气的混合气体受光照:CH3CH3+Cl2??CH2ClCH2Cl+H2
D.乙烯与溴的加成:CH2=CH2+Br2?—→?CH3CHBr2
9.李华同学在学习了《有机化合物》一章后整理出以下笔记,其中错误的是
??????A.溴水可以用来区分乙酸、乙醇和苯
??????B.分子组成为C2H4Br2的物质可能是混合物
??????C.可用NaOH溶液除去溴苯中残留的溴
??????D.烷烃不能使酸性高锰酸钾溶液褪色,但能发生氧化反应
10.?设NA为阿伏加德罗常数的值。下列说法正确的是
A.36?g由35Cl和37Cl组成的氯气中所含质子数为17NA
B.3.36 L乙烯中所含碳原子数为0.3NA
C.17?g羟基(-OH)中含有的电子数为9NA
D.一定条件下,2?mol?SO2与2?mol?O2充分反应后分子总数为3NA
11.?微型银-锌电池的电极分别是Ag/Ag2O和Zn,KOH溶液作电解质溶液,电池总反应为Ag2O+Zn+H2O === 2Ag+Zn(OH)2?。对电池工作过程中的下列叙述错误的是
A.电流由Ag/Ag2O电极流出
B.电解液中OH-向负极迁移
C.负极反应为Zn-2e-+2OH-=== Zn(OH)2?
D.正极反应为Ag2O+2H++2e- === 2Ag+H2O
12. 利用下列图示装置进行实验,能达到相应目的的是
A.用甲比较氯、碳、硅的非金属性强弱
B.用乙制备BaSO3
C.用丙证明苯与液溴反应产生了HBr
D.用丁研究催化剂对化学反应速率的影响
13.?短周期元素X、Y、Z的原子序数依次增加,r与q是由这些元素组成的二元化合物,n、p、m分别是元素X、Y、Z的单质,m通常为黄绿色气体,r与q生成s的反应产生白烟。下列说法正确的是
A.可用直接加热s的方法制q ?B.r的热稳定性比H2S强
C.元素Z的含氧酸均为强酸 ?D.q的沸点比PH3低
14.?将一定质量的Cu粉投入到400?mL?2?mol/L的稀硝酸中,待Cu粉完全溶解时,收集到标准状况下的NO气体2.688 L(假设硝酸的还原产物只有NO且气体全部逸出),再向反应后的溶液中缓慢加入Fe粉,充分反应后溶液只含一种溶质。下列说法错误的是
A. 加入铁粉后,最终溶液的溶质是Fe(NO3)2 B. 最初的铜粉质量为11.52?g
C. 铜粉反应完后,溶液中的H+浓度为0.8 mol/L D. 至少需要加入铁粉8.4?g
第Ⅱ卷(非选择题,共58分)
二、(本题包括2小题,共24分)
15.(10分)制备乙酸乙酯是中学有机化学中的一个重要实验。某化学学习小组的同学查阅资料发现,某些无机盐类也可以催化乙酸乙酯的合成,为了探究不同盐的催化效果,设计了如下实验:
实验步骤:向大试管中加入一定量的无机盐催化剂,再加入3?mL无水乙醇和2?mL冰醋酸,按图连接装置。用酒精灯小心均匀地加热试管5?min,产生的蒸气经导管通到饱和碳酸钠溶液上方。
实验记录:使用不同的催化剂,实验得到的酯层高度如下表。
催化剂 酯层高度/cm 催化剂 酯层高度/cm
氯化铁晶体 2.7 氯化铝 3.2
A 2.2 氯化钠 0.0
(1)实验时,需要加入几粒沸石,目的是 。
(2)催化剂用量为3?mmol(以阳离子计),选用的催化剂A可能是 (填标号)。
a. 氯化铜晶体 b. 硫酸钙晶体 c. 碳酸钠晶体 d. 硝酸钾晶体
实验所用四种催化剂中,制备乙酸乙酯最好选用 。
(3)若用18O标记乙醇中的O,用氯化铝作催化剂时,产生乙酸乙酯的化学方程式为
。
(4)实验中用饱和碳酸钠溶液的作用是 。得到的混合液经 ,蒸馏,最终得到较纯净的乙酸乙酯。
16.(14分)乙酸环己酯是一种香料,可用于配制苹果、香蕉等果香型香精。一种制备乙酸环己酯的合成路线如下:
回答下列问题:
(1)反应①所用试剂是 ,由石油获得E的生产工艺称为 。
(2)G中官能团名称是 ,在反应①~④中,原子利用率理论上可达100%的是______(填序号)。
(3)反应③的化学方程式为 ,反应类型是 。
(4)下列关于合成路线中所涉及物质的说法正确的是 (填标号)。
a.A、E分子中的原子均处于同一平面 b.用水可分离A和B的混合物
c.D和E均能与KMnO4酸性溶液反应 d.F与D互为同系物
(5)X是E的同系物,其相对分子质量比E大42,X可能的结构有 种,其中含3个-CH3的X结构简式为 。
三、(本题包括2小题,共25分)
X
Y
W Q
17.(12分)短周期元素X、Y、Z、W、Q的原子序数依次增大,Z的原子半径是短周期主族元素中最大的,X、Y、W、Q在元素周期表中的位置如表所示,Y、Q的原子序数之和是X的4倍。回答下列问题:
(1)W的原子结构示意图为 ,X元素在周期表中的位置为________。
(2)Y、Z、Q三种元素所形成的简单离子,半径由大到小的顺序是 (填化学式,下同)。
(3)X与Y按原子数之比为1:2形成化合物的电子式为 ,Y与Z形成的一种化合物是淡黄色固体,该化合物中所含化学键的类型是 。
(4)以KOH稀溶液作电解质溶液,石墨作电极,X的简单氢化物甲和Y的双原子分子乙可组成燃料电池,其工作原理如右图所示。电池工作时,a极的电极反应式为 。
18.(13分)钨在冶金工业有重要作用,某化工企业以黑钨矿(主要成分FeWO4和MnWO4,W为+6价)为原料冶炼金属钨的过程如下:
回答下列问题:
(1)“熔融”前需将黑钨矿粉碎,其目的是 _____________________________。
(2)写出“熔融”过程中生成Fe2O3的化学方程式:_____________________。
(3)下列仪器中,过滤操作用到的有 (填标号),所得滤渣B的化学式为________________。
(4)检验沉淀D是否洗净的操作为 :取最后一次洗涤液少许于试管中,_________。
(5)产品E的化学式为WO3-x?,其中W的化合价有+5和+6两种。若x=0.1,则+5价的W(Ⅴ)占该化合物中钨元素总量的 ;该流程中由产品E冶炼金属钨的方法属于__________法。
四、(本题包括1小题,共9分)
19.(9分)CO2催化加氢合成二甲醚(CH3OCH3)是一种CO2转化方法,反应原理为:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)
(1)加快该反应速率的措施有 (填两条)。
(2)能证明上述反应达到平衡状态是 (填标号)。
?A.v正(CO2)=3v逆(H2) B.CH3OCH3的浓度不再改变
?C.?不再变化 ?D.混合气体的平均相对分子质量不再改变
(3)某温度下,在体积为2 L的密闭容器中加入2 mol CO2与5 mol H2发生催化反应,经过10 min后CO2的浓度不再变化,测得其体积分数为20%。试计算:
①在0~10 min时段,用CH3OCH3表示的平均反应速率。
②起始状态与平衡状态容器内的压强之比。
(无计算过程不给分。)
高中2020级第一学年末教学质量测试
化学参考答案和评分标准
说明:
1. 本答案供阅卷评分使用,试题的参考解答是用来说明评分标准的,考生如按其他方法或步骤解答,正确的同样给分;有错的,根据错误性质,参照评分标准中相应的规定评分。
2. 化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3. 化学方程式、离子方程式未配平的,都不给分。
4. 计算只有最后答案而无演算过程的,不给分。
第Ⅰ卷(选择题,共42分)
一、选择题(本题包括14小题,每小题3分,共42分。每小题只有一个选项符合题意)
1.?C 2.?B 3.?C 4.?B 5.?C 6.?A 7.?D 8.?A 9.?A 10.?C 11.?D 12.?D 13.?B 14.?D
第Ⅱ卷(非选择题,共58分)
二、(本题包括2小题,共24分)
15. (10分)
(1)防暴沸(1分) (2)a(2分) 氯化铝(1分)
(3)(2分)
(4)除去乙酸和乙醇,降低乙酸乙酯的溶解度(2分) 分液(2分)
16.(14分)
(1)Fe粉、液溴(2分) 石油裂解(1分)
(2)羧基(1分) ②③(2分)
(3)CH2=CH2+H2OCH3CH2OH(2分) 加成反应(1分)
(4)a c(2分)
(5)5(2分) (1分)
三、(本题包括2小题,共25分)
17.(共12分,每空2分)
(1) 第二周期第ⅣA 族
(2)S2->O2->Na+
(3)::C:: 离子键、非极性键
(4) CH4-8e-+10OH-=== CO+7H2O
18.(13分,除最后一空1分外,其余每空2分)
(1)加快反应速率,使反应更充分
(2)4FeWO4+O2+4Na2CO3 2Fe2O3+4Na2WO4+4CO2
(3)A C E Fe2O3、MnO2
(4)滴加HNO3酸化的AgNO3溶液,若不产生白色沉淀,说明洗涤干净
(5)20% 或 热还原(1分)
四、(本题包括1小题,共9分)
19.(1)加热或升高温度,增大反应物浓度,改进催化剂,加压等(2分)
(2)B D(2分)
(3)解: 设反应达到平衡时消耗CO2 的物质的量为2x。
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
起始量/mol 2 5 0 0
变化量/mol 2 x 6 x x 3 x
平衡量/mol 2-2 x 5-6 x? ?x 3 x
由题意可得:×100%=20%
解得:x=0.5 mol ……………………………………………………………(2分)
0~10 min时段:v(CH3OCH3)==0.025 mol /(L·min) ……(1分)
同温同体积下
=== ……………(2分)
答:在0~10 min时段,用CH3OCH3表示的平均反应速率为0.025 mol /(L·min);起始状态与平衡状态容器内的压强之比为7:5?。
高一化学试题卷 第1页(共6页)
同课章节目录
