人教版(2019)化学必修一 同步课件 2.3.3物质的量浓度(39张ppt)
文档属性
| 名称 | 人教版(2019)化学必修一 同步课件 2.3.3物质的量浓度(39张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-19 00:00:00 | ||
图片预览








文档简介
(共39张PPT)
必修第一册
人教版
高一上
第一节
钠及其化合物
第三节
物质的量
第二节
氯及其化合物
第二章
海水中的重要元素
——钠和氯
CONTENTS
本节内容
物质的量浓度与溶质质量分数的关系
物质的量浓度
二
一
有关溶液稀释或混合的计算
三
有关溶液稀释或混合的计算
四
【温故知新】
1.什么叫溶液?溶液是由什么组成的?溶液的浓度怎么表示?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物。溶液由溶质和溶剂组成。溶液的浓度用质量分数来表示,
2.配制100g
20%的NaCl溶液需要____g
NaCl固体
ω
=
m(质)
m(液)
×100%
20
新知导入
3.从上述溶液中取出一定物质的量的NaCl溶液,下列哪种方法更方便?
A.通过天平量取相应质量的溶液
B.通过量筒量取相应体积的溶液
结论:一般取用溶液时,并不是称量它的质量,而是_____________。
如果知道一定体积(如1L)的溶液中所含溶质的_________,对于溶液的配制则会非常便利
√
量取它的体积
物质的量
新知导入
新知导入
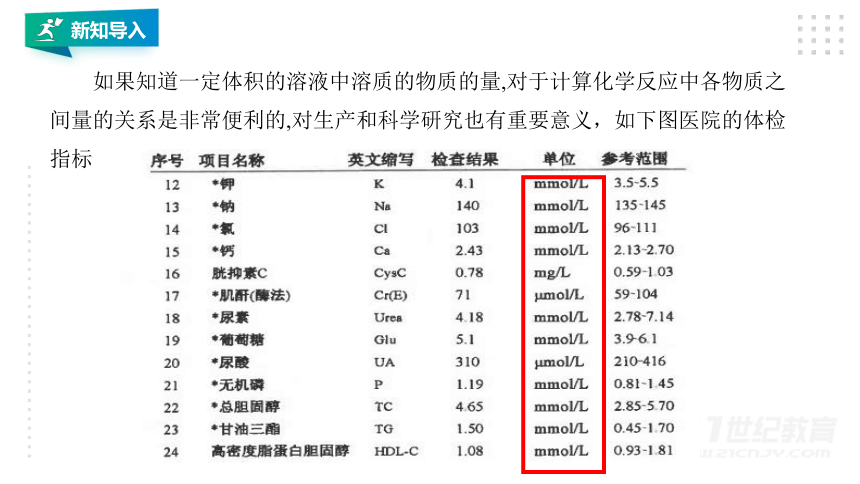
如果知道一定体积的溶液中溶质的物质的量,对于计算化学反应中各物质之间量的关系是非常便利的,对生产和科学研究也有重要意义,如下图医院的体检指标
【思考】
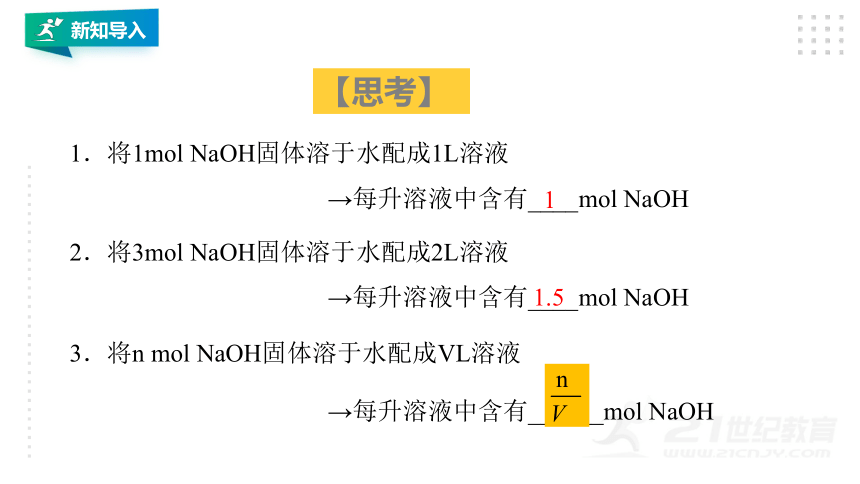
1.将1mol
NaOH固体溶于水配成1L溶液
→每升溶液中含有____mol
NaOH
2.将3mol
NaOH固体溶于水配成2L溶液
→每升溶液中含有____mol
NaOH
3.将n
mol
NaOH固体溶于水配成VL溶液
→每升溶液中含有______mol
NaOH
1
1.5
新知导入
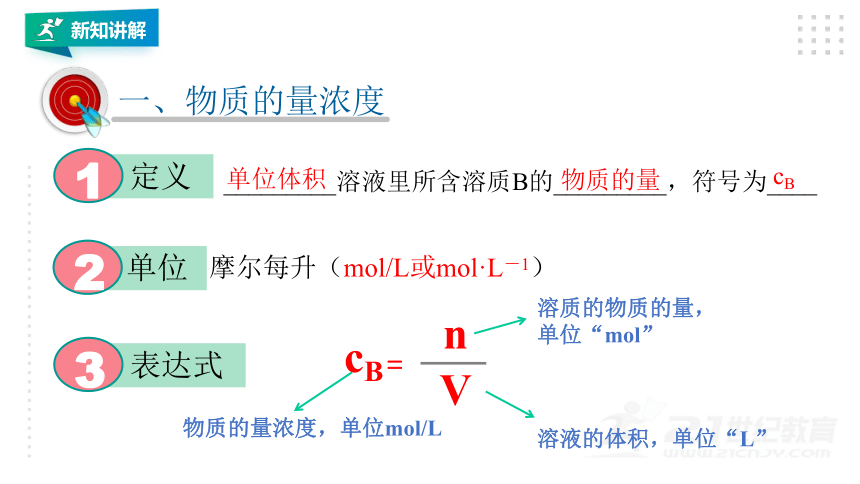
新知讲解
定义
1
摩尔每升(mol/L或mol·L-1)
一、物质的量浓度
_________溶液里所含溶质B的_________,符号为____
物质的量
单位体积
cB
单位
2
表达式
3
cB
=
n
V
溶质的物质的量,单位“mol”
溶液的体积,单位“L”
物质的量浓度,单位mol/L
课堂练习
【例1】判断正误
(1)将1molNaCl溶于1L水中形成溶液,则c=1mol/L。
(2)若从1L
1
mol/L的NaOH溶液中取出10mL,则取出的NaOH溶液浓度为0.01mol/L。
×
×
课堂练习
【例2】配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少?
m=n·M=c·V·M=0.5L×0.1mol/L×40g/mol=2g
【例3】(1)标况下将44.8LHCl溶于水配成1L溶液,cHCl=________。
(2)0.2mol/L的Na2CO3溶液中,c(
CO32-)
=_______,
c(Na+)
=________
0.2mol/L
0.4mol/L
2mol/L
【例4】下列说法正确的是(
)
A.1mol·L-1的NaCl溶液中含有1
mol
NaCl
B.从1L1mol·L-1的NaOH溶液中,氧原子的物质的量为1mol
C.将22.4
L
HCl气体溶于水配成1
L溶液,其浓度为1
mol·L-1
D.1mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为2
mol·L-1
D
课堂练习
课堂练习
【例5】下列溶液中Cl-的物质的量浓度与100
mL
1
mol·L-1
MgCl2溶液中Cl-的物质的量浓度相同的是(
)
A.50
mL
2
mol·L-1
CaCl2溶液
B.100
mL
2
mol·L-1
NaCl溶液
C.50
mL
4
mol·L-1
CaCl2溶液
D.100
mL
4
mol·L-1
NaCl溶液
B
课堂练习
【例6】下列溶液中的氯离子数目与50
mL
1
mol·L-1的AlCl3溶液中氯离子数目相等的是( )
A.150
mL
1
mol·L-1的AlCl3
B.75
mL
2
mol·L-1的NH4Cl
C.150
mL
3
mol·L-1的KCl
D.75
mL
2
mol·L-1的CaCl2
B
课堂练习
【例7】下列关于物质的量浓度的表述中正确的是(
)
A.0.3
mol·L-1K2SO4溶液中含有K+和SO42-总物质的量为0.9
mol
B.当1
L水吸收22.4
L氨气时所得氨水的浓度不是1
mol·L-1,只有当22.4
L氨气溶于水制得1
L氨水时,其浓度才是1
mol·L-1
C.在Na2SO4和KCl的中性混合水溶液中,如果
K+和SO42-的物质的量浓度相等,那么Na+和Cl-的物质的量浓度一定相等
D.10
℃时0.35mol·L-1的KCl饱和溶液100
mL,蒸发掉5
g水,冷却到10
℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol·L-1
D
课堂练习
【例8】V
L
Fe2(SO4)3溶液中含Fe3+m
g,则溶液中SO42-的物质的量浓
度为____________________。
mol·L-1
二、物质的量浓度与溶质质量分数w的关系
cB=
ωB=
m液
=
ρ液·v液
mB
=
nB·M
cB
ρ:溶液密度(单位:g·mL-1或g/cm3)
新知讲解
【例9】如图为实验室某浓盐酸试剂瓶标签上的有关数据,则该浓盐酸中HCl的物质的量浓度为______
mol/L。
11.9
课堂练习
【例10】50
mL物质的量浓度为4.4
mol/L,密度为1.24
g/mL
的稀硫酸的质量分数为_________。
34.77%
课堂练习
三、有关溶液稀释或混合的计算
1.稀释前后,溶液中溶质的_______________都不变,即:
2.同种溶质的两溶液混合,混合后溶液中溶质的物质的量等于混合前两溶液中溶质物质的量_____,即:
质量和物质的量
m(浓)·ω(浓)=m(稀)·ω(稀);m(稀)=m(浓)+m(水);
c(浓)·c(浓)=c(稀)·c(稀)
之和
m1ω1+m2ω2=m(混)·ω(混);m1+m2=(混)
新知讲解
课堂练习
【例11】将20mL物质的量浓度为0.5mol/L的NaOH溶液加水稀释至500mL,再取出50mL,这50mL溶液中溶质的质量为_______,溶质的物质的量浓度为__________。
【例12】1L溶有0.1mol/L
NaCl和0.1mol/L
MgCl2的混合溶液中,Cl-的物质的量浓度为__________。
0.04g
0.02mol/L
0.3
mol/L
课堂练习
【例13】300mL某浓度的NaOH溶液中含有60g溶质,现欲配制1mol/L
NaOH溶液,应取该溶液与蒸馏水的体积比约为______。
1:4
四、配制一定浓度的溶液
主要仪器
1
容量瓶
(2)特点:容量瓶上标有_____、_____和_______
(3)常用规格:100ml,250ml,500ml,1000ml
(1)构造:细颈、平底玻璃瓶,瓶口配有磨口塞或塑料塞
温度
容量
刻度线
只能配制相应体积的溶液
新知讲解
(4)注意事项
①使用容量瓶的第一步操作是检查是否漏水
检漏方法:向容量瓶中注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立,观察是否漏水。如不漏水,将瓶正立并将塞子旋转180°后塞紧,再检查是否漏水。如不漏水,该容量瓶才能使用
【即:注水→盖塞→倒立→观察→正立→旋180°→倒立→观察】
新知讲解
②选择容量瓶的原则——“大而近”原则
选择容量瓶遵循“大而近”原则:所配溶液的体积等于或略小于容量瓶的容积,如:需用480
mL某溶液应选500
mL容量瓶
③使用容量瓶注意“四不能”
a.不能将固体或浓溶液直接在容量瓶中溶解或稀释;
b.不能作为反应容器或长期贮存溶液的容器;
c.不能加入过冷或过热的液体;
d.不能配制任意体积的溶液
新知讲解
实验
2
配制100mL
2
mol/L的NaCl溶液
(1)仪器:烧杯、玻璃棒、量筒、____________、胶头滴管、药匙、托盘天平
(2)试剂:NaCl固体、蒸馏水
(3)步骤:八字方针
①计算:需要NaCl固体的质量:
②称量:用托盘天平称量氯化钠
③溶解:在_____中用适量蒸馏水溶解
计→量→溶(或稀释)→转→洗→定→摇→装
m(NaCl)=c×V×M=2×0.1×58.5
=11.7g
100mL容量瓶
烧杯
新知讲解
④转移:将烧杯中的溶液小心沿________注入到容量瓶中
⑤洗涤振荡:将烧杯内壁洗涤_____次,洗涤液也注入________中,轻轻振荡容量瓶,使溶液充分混合
⑥定容:继续加水至刻度线下_______,改用_________加水至溶液________恰好与刻度线相切
⑦摇匀:
将瓶塞盖好,反复上下颠倒,摇匀
⑧装贴:将配制好的溶液转移到试剂瓶中,贴好标签
玻璃棒
2~3
容量瓶
1~2cm
胶头滴管
凹液面
新知讲解
新知讲解
误差分析
3
判断依据:cB=
误差
来源
操作
直接影响
对浓度的影响
称量
量取
称量时托盘天平左盘高,右盘低
称量时左盘放砝码,右盘放药品
(使用了游码)
天平的砝码沾有其他物质或已生锈
能潮解或吸水的物质称量时间过长
用量筒量取液体药品时,仰视读数
↓
n↓
↓
n↓
↑
n↑
↓
n↓
↑
n↑
新知讲解
误差
来源
操作
直接影响
对浓度的影响
转移
定容
摇匀
溶解过程中有少量液体溅出烧杯
转移溶液前容量瓶中含有少量的水
未洗涤溶解用的玻璃棒和烧杯
洗涤液未转入容量瓶中
定容时仰视刻度
↓
n↓
—
—
↓
n↓
↓
n↓
V↑
↓
新知讲解
误差
来源
操作
直接影响
对浓度的影响
转移
定容
摇匀
未等溶液冷却就定容
定容超过刻度线,用滴管吸出少量溶液
摇匀后发现液面低于刻度再加水
配好的溶液转入试剂瓶时,不慎溅出部分溶液
V↓
↑
↓
n↓
V↑
↓
—
—
新知讲解
【例14】下列有关实验的叙述正确的是(
)
A.容量瓶不能用作长期存放试剂的容器,但溶液配制完后,可用来存放配制的试剂
B.用500
mL的容量瓶可以直接配制480
mL溶液
C.容量瓶不可以用来溶解固体,但是可以用来稀释浓的溶液
D.容量瓶不可以用来加热,但是锥形瓶可以用来加热
D
课堂练习
课堂练习
【例15】精确配制250
mL一定物质的量浓度的NaOH溶液,下列实验操作正确的是(
)
A.选择仪器时,使用500
mL容量瓶
B.将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解氢氧化钠固体后,立即将所得溶液注入容量瓶中
D.将烧杯中的氢氧化钠溶液注入未经干燥的洁净容量瓶中
D
课堂练习
【例16】使用胆矾配制0.1
mol·L-1硫酸铜溶液,正确的操作是(
)
A.将胆矾加热除去结晶水后,称取16
g溶解在1
L水中
B.称取胆矾25
g溶解在1
L水中
C.将25
g胆矾溶于水,然后将此溶液稀释至1
L
D.将16
g胆矾溶于水,然后将此溶液稀释至1
L
D
课堂练习
【例17】配制100
mL
1.0
mol·L-1的Na2CO3溶液,下列情况会导致溶液浓度偏高的是(
)
A.容量瓶使用前用1.0
mol·L-1的Na2CO3溶液润洗
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.定容时仰视,确定凹液面与刻度线相切
D.用敞口容器称量Na2CO3且时间过长
D
课堂练习
【例18】实验室配制480
mL
0.5
mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解
②把①所得溶液小心转入容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2
cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为______________(填序号)。
(2)本实验用到的基本实验仪器有天平、药匙、玻璃棒、烧杯、___________。
①②④③⑤
胶头滴管、
500mL容量瓶
课堂练习
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何
影响?_______。
(4)若出现如下情况,对所配溶液浓度将有何影响?
(填“偏高”、“偏低”或“无影响”)
没有进行操作步骤④______;
加蒸馏水时不慎超过了刻度_____。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度___________;
向容量瓶中转移溶液时溶液流到容量瓶外面___________。
偏高
偏低
偏低
重新配制
重新配制
必修第一册
人教版
高一上
第一节
钠及其化合物
第三节
物质的量
第二节
氯及其化合物
第二章
海水中的重要元素
——钠和氯
CONTENTS
本节内容
物质的量浓度与溶质质量分数的关系
物质的量浓度
二
一
有关溶液稀释或混合的计算
三
有关溶液稀释或混合的计算
四
【温故知新】
1.什么叫溶液?溶液是由什么组成的?溶液的浓度怎么表示?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物。溶液由溶质和溶剂组成。溶液的浓度用质量分数来表示,
2.配制100g
20%的NaCl溶液需要____g
NaCl固体
ω
=
m(质)
m(液)
×100%
20
新知导入
3.从上述溶液中取出一定物质的量的NaCl溶液,下列哪种方法更方便?
A.通过天平量取相应质量的溶液
B.通过量筒量取相应体积的溶液
结论:一般取用溶液时,并不是称量它的质量,而是_____________。
如果知道一定体积(如1L)的溶液中所含溶质的_________,对于溶液的配制则会非常便利
√
量取它的体积
物质的量
新知导入
新知导入
如果知道一定体积的溶液中溶质的物质的量,对于计算化学反应中各物质之间量的关系是非常便利的,对生产和科学研究也有重要意义,如下图医院的体检指标
【思考】
1.将1mol
NaOH固体溶于水配成1L溶液
→每升溶液中含有____mol
NaOH
2.将3mol
NaOH固体溶于水配成2L溶液
→每升溶液中含有____mol
NaOH
3.将n
mol
NaOH固体溶于水配成VL溶液
→每升溶液中含有______mol
NaOH
1
1.5
新知导入
新知讲解
定义
1
摩尔每升(mol/L或mol·L-1)
一、物质的量浓度
_________溶液里所含溶质B的_________,符号为____
物质的量
单位体积
cB
单位
2
表达式
3
cB
=
n
V
溶质的物质的量,单位“mol”
溶液的体积,单位“L”
物质的量浓度,单位mol/L
课堂练习
【例1】判断正误
(1)将1molNaCl溶于1L水中形成溶液,则c=1mol/L。
(2)若从1L
1
mol/L的NaOH溶液中取出10mL,则取出的NaOH溶液浓度为0.01mol/L。
×
×
课堂练习
【例2】配制500mL0.1mol/LNaOH溶液,需要NaOH的质量是多少?
m=n·M=c·V·M=0.5L×0.1mol/L×40g/mol=2g
【例3】(1)标况下将44.8LHCl溶于水配成1L溶液,cHCl=________。
(2)0.2mol/L的Na2CO3溶液中,c(
CO32-)
=_______,
c(Na+)
=________
0.2mol/L
0.4mol/L
2mol/L
【例4】下列说法正确的是(
)
A.1mol·L-1的NaCl溶液中含有1
mol
NaCl
B.从1L1mol·L-1的NaOH溶液中,氧原子的物质的量为1mol
C.将22.4
L
HCl气体溶于水配成1
L溶液,其浓度为1
mol·L-1
D.1mol·L-1的CaCl2溶液中,Cl-的物质的量浓度为2
mol·L-1
D
课堂练习
课堂练习
【例5】下列溶液中Cl-的物质的量浓度与100
mL
1
mol·L-1
MgCl2溶液中Cl-的物质的量浓度相同的是(
)
A.50
mL
2
mol·L-1
CaCl2溶液
B.100
mL
2
mol·L-1
NaCl溶液
C.50
mL
4
mol·L-1
CaCl2溶液
D.100
mL
4
mol·L-1
NaCl溶液
B
课堂练习
【例6】下列溶液中的氯离子数目与50
mL
1
mol·L-1的AlCl3溶液中氯离子数目相等的是( )
A.150
mL
1
mol·L-1的AlCl3
B.75
mL
2
mol·L-1的NH4Cl
C.150
mL
3
mol·L-1的KCl
D.75
mL
2
mol·L-1的CaCl2
B
课堂练习
【例7】下列关于物质的量浓度的表述中正确的是(
)
A.0.3
mol·L-1K2SO4溶液中含有K+和SO42-总物质的量为0.9
mol
B.当1
L水吸收22.4
L氨气时所得氨水的浓度不是1
mol·L-1,只有当22.4
L氨气溶于水制得1
L氨水时,其浓度才是1
mol·L-1
C.在Na2SO4和KCl的中性混合水溶液中,如果
K+和SO42-的物质的量浓度相等,那么Na+和Cl-的物质的量浓度一定相等
D.10
℃时0.35mol·L-1的KCl饱和溶液100
mL,蒸发掉5
g水,冷却到10
℃时,其体积小于100mL,它的物质的量浓度仍为0.35mol·L-1
D
课堂练习
【例8】V
L
Fe2(SO4)3溶液中含Fe3+m
g,则溶液中SO42-的物质的量浓
度为____________________。
mol·L-1
二、物质的量浓度与溶质质量分数w的关系
cB=
ωB=
m液
=
ρ液·v液
mB
=
nB·M
cB
ρ:溶液密度(单位:g·mL-1或g/cm3)
新知讲解
【例9】如图为实验室某浓盐酸试剂瓶标签上的有关数据,则该浓盐酸中HCl的物质的量浓度为______
mol/L。
11.9
课堂练习
【例10】50
mL物质的量浓度为4.4
mol/L,密度为1.24
g/mL
的稀硫酸的质量分数为_________。
34.77%
课堂练习
三、有关溶液稀释或混合的计算
1.稀释前后,溶液中溶质的_______________都不变,即:
2.同种溶质的两溶液混合,混合后溶液中溶质的物质的量等于混合前两溶液中溶质物质的量_____,即:
质量和物质的量
m(浓)·ω(浓)=m(稀)·ω(稀);m(稀)=m(浓)+m(水);
c(浓)·c(浓)=c(稀)·c(稀)
之和
m1ω1+m2ω2=m(混)·ω(混);m1+m2=(混)
新知讲解
课堂练习
【例11】将20mL物质的量浓度为0.5mol/L的NaOH溶液加水稀释至500mL,再取出50mL,这50mL溶液中溶质的质量为_______,溶质的物质的量浓度为__________。
【例12】1L溶有0.1mol/L
NaCl和0.1mol/L
MgCl2的混合溶液中,Cl-的物质的量浓度为__________。
0.04g
0.02mol/L
0.3
mol/L
课堂练习
【例13】300mL某浓度的NaOH溶液中含有60g溶质,现欲配制1mol/L
NaOH溶液,应取该溶液与蒸馏水的体积比约为______。
1:4
四、配制一定浓度的溶液
主要仪器
1
容量瓶
(2)特点:容量瓶上标有_____、_____和_______
(3)常用规格:100ml,250ml,500ml,1000ml
(1)构造:细颈、平底玻璃瓶,瓶口配有磨口塞或塑料塞
温度
容量
刻度线
只能配制相应体积的溶液
新知讲解
(4)注意事项
①使用容量瓶的第一步操作是检查是否漏水
检漏方法:向容量瓶中注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把瓶倒立,观察是否漏水。如不漏水,将瓶正立并将塞子旋转180°后塞紧,再检查是否漏水。如不漏水,该容量瓶才能使用
【即:注水→盖塞→倒立→观察→正立→旋180°→倒立→观察】
新知讲解
②选择容量瓶的原则——“大而近”原则
选择容量瓶遵循“大而近”原则:所配溶液的体积等于或略小于容量瓶的容积,如:需用480
mL某溶液应选500
mL容量瓶
③使用容量瓶注意“四不能”
a.不能将固体或浓溶液直接在容量瓶中溶解或稀释;
b.不能作为反应容器或长期贮存溶液的容器;
c.不能加入过冷或过热的液体;
d.不能配制任意体积的溶液
新知讲解
实验
2
配制100mL
2
mol/L的NaCl溶液
(1)仪器:烧杯、玻璃棒、量筒、____________、胶头滴管、药匙、托盘天平
(2)试剂:NaCl固体、蒸馏水
(3)步骤:八字方针
①计算:需要NaCl固体的质量:
②称量:用托盘天平称量氯化钠
③溶解:在_____中用适量蒸馏水溶解
计→量→溶(或稀释)→转→洗→定→摇→装
m(NaCl)=c×V×M=2×0.1×58.5
=11.7g
100mL容量瓶
烧杯
新知讲解
④转移:将烧杯中的溶液小心沿________注入到容量瓶中
⑤洗涤振荡:将烧杯内壁洗涤_____次,洗涤液也注入________中,轻轻振荡容量瓶,使溶液充分混合
⑥定容:继续加水至刻度线下_______,改用_________加水至溶液________恰好与刻度线相切
⑦摇匀:
将瓶塞盖好,反复上下颠倒,摇匀
⑧装贴:将配制好的溶液转移到试剂瓶中,贴好标签
玻璃棒
2~3
容量瓶
1~2cm
胶头滴管
凹液面
新知讲解
新知讲解
误差分析
3
判断依据:cB=
误差
来源
操作
直接影响
对浓度的影响
称量
量取
称量时托盘天平左盘高,右盘低
称量时左盘放砝码,右盘放药品
(使用了游码)
天平的砝码沾有其他物质或已生锈
能潮解或吸水的物质称量时间过长
用量筒量取液体药品时,仰视读数
↓
n↓
↓
n↓
↑
n↑
↓
n↓
↑
n↑
新知讲解
误差
来源
操作
直接影响
对浓度的影响
转移
定容
摇匀
溶解过程中有少量液体溅出烧杯
转移溶液前容量瓶中含有少量的水
未洗涤溶解用的玻璃棒和烧杯
洗涤液未转入容量瓶中
定容时仰视刻度
↓
n↓
—
—
↓
n↓
↓
n↓
V↑
↓
新知讲解
误差
来源
操作
直接影响
对浓度的影响
转移
定容
摇匀
未等溶液冷却就定容
定容超过刻度线,用滴管吸出少量溶液
摇匀后发现液面低于刻度再加水
配好的溶液转入试剂瓶时,不慎溅出部分溶液
V↓
↑
↓
n↓
V↑
↓
—
—
新知讲解
【例14】下列有关实验的叙述正确的是(
)
A.容量瓶不能用作长期存放试剂的容器,但溶液配制完后,可用来存放配制的试剂
B.用500
mL的容量瓶可以直接配制480
mL溶液
C.容量瓶不可以用来溶解固体,但是可以用来稀释浓的溶液
D.容量瓶不可以用来加热,但是锥形瓶可以用来加热
D
课堂练习
课堂练习
【例15】精确配制250
mL一定物质的量浓度的NaOH溶液,下列实验操作正确的是(
)
A.选择仪器时,使用500
mL容量瓶
B.将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解
C.在烧杯中溶解氢氧化钠固体后,立即将所得溶液注入容量瓶中
D.将烧杯中的氢氧化钠溶液注入未经干燥的洁净容量瓶中
D
课堂练习
【例16】使用胆矾配制0.1
mol·L-1硫酸铜溶液,正确的操作是(
)
A.将胆矾加热除去结晶水后,称取16
g溶解在1
L水中
B.称取胆矾25
g溶解在1
L水中
C.将25
g胆矾溶于水,然后将此溶液稀释至1
L
D.将16
g胆矾溶于水,然后将此溶液稀释至1
L
D
课堂练习
【例17】配制100
mL
1.0
mol·L-1的Na2CO3溶液,下列情况会导致溶液浓度偏高的是(
)
A.容量瓶使用前用1.0
mol·L-1的Na2CO3溶液润洗
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.定容时仰视,确定凹液面与刻度线相切
D.用敞口容器称量Na2CO3且时间过长
D
课堂练习
【例18】实验室配制480
mL
0.5
mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解
②把①所得溶液小心转入容量瓶中
③继续向容量瓶中加蒸馏水至液面距刻度1~2
cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤的正确顺序为______________(填序号)。
(2)本实验用到的基本实验仪器有天平、药匙、玻璃棒、烧杯、___________。
①②④③⑤
胶头滴管、
500mL容量瓶
课堂练习
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何
影响?_______。
(4)若出现如下情况,对所配溶液浓度将有何影响?
(填“偏高”、“偏低”或“无影响”)
没有进行操作步骤④______;
加蒸馏水时不慎超过了刻度_____。
(5)若实验过程中出现如下情况应如何处理?
加蒸馏水时不慎超过了刻度___________;
向容量瓶中转移溶液时溶液流到容量瓶外面___________。
偏高
偏低
偏低
重新配制
重新配制
