第五单元 课题1 质量守恒定律---2021-2022学年人教版化学九年级上册(word版含解析)
文档属性
| 名称 | 第五单元 课题1 质量守恒定律---2021-2022学年人教版化学九年级上册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 198.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-21 19:14:15 | ||
图片预览



文档简介
2021年秋人教版初中九年级化学培优训练卷.
第五单元 化学方程式
课题1 质量守恒定律
一、选择题
1.下列关于S+O2 SO2的说法不正确的是 ( )
A.表示硫与氧气在点燃条件下反应生成二氧化硫
B.参加反应的硫与氧气的质量比为2∶1
C.反应前后硫原子、氧原子的个数均不变
D.参加反应的氧气与生成的二氧化硫的分子个数比为1∶1
2. 根据化学方程式不能获得该反应的信息是 ( )
A.化学反应的快慢 B.生成物
C.反应条件 D.反应物
3. 如图是某反应的微观示意图(反应条件已省略),下列有关该反应的说法正确的是 ( )
A.反应后原子的数目增多
B.生成物的分子个数比为1∶1∶1
C.化学反应是原子的重新组合
D.反应前后分子的种类不变
4. 已知某反应为MnO2+H2SO4+H2O2MnSO4+O2↑+2X,则X的化学式是 ( )
A.SO2 B.H2O C.H2 D.H2SO3
5. 一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是 ( )
物质
甲
乙
丙
丁
反应前的质量/g
50
0.5
0
0
反应后的质量/g
23
x
24
3
A.x的值等于0.5
B.甲一定是化合物
C.丙和丁的质量变化比为8∶1
D.该反应是化合反应
6.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是 ( )
A.a=56% B.b=6%
C.c=17% D.d=8%
7. 偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为C2H8N2+2N2O42X↑+3N2↑+4H2O↑,下列说法正确的是 ( )
A.X的化学式为CO
B.偏二甲肼中碳元素的质量分数为40%
C.该反应属于分解反应
D.生成N2和H2O的质量比为14∶9
8. 煤油中含有噻吩(用X表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式为X+6O2 4CO2+SO2+2H2O,则噻吩的化学式为 ( )
A.CH4 B.C4H4S
C.C4H6S D.C4H8S
9.已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:
(说明:一种小球代表一种元素的原子)
下列说法中正确的是 ( )
A.图示中的反应物都是单质
B.该反应属于化合反应
C.图示中共有4种物质
D.该图示不符合质量守恒定律
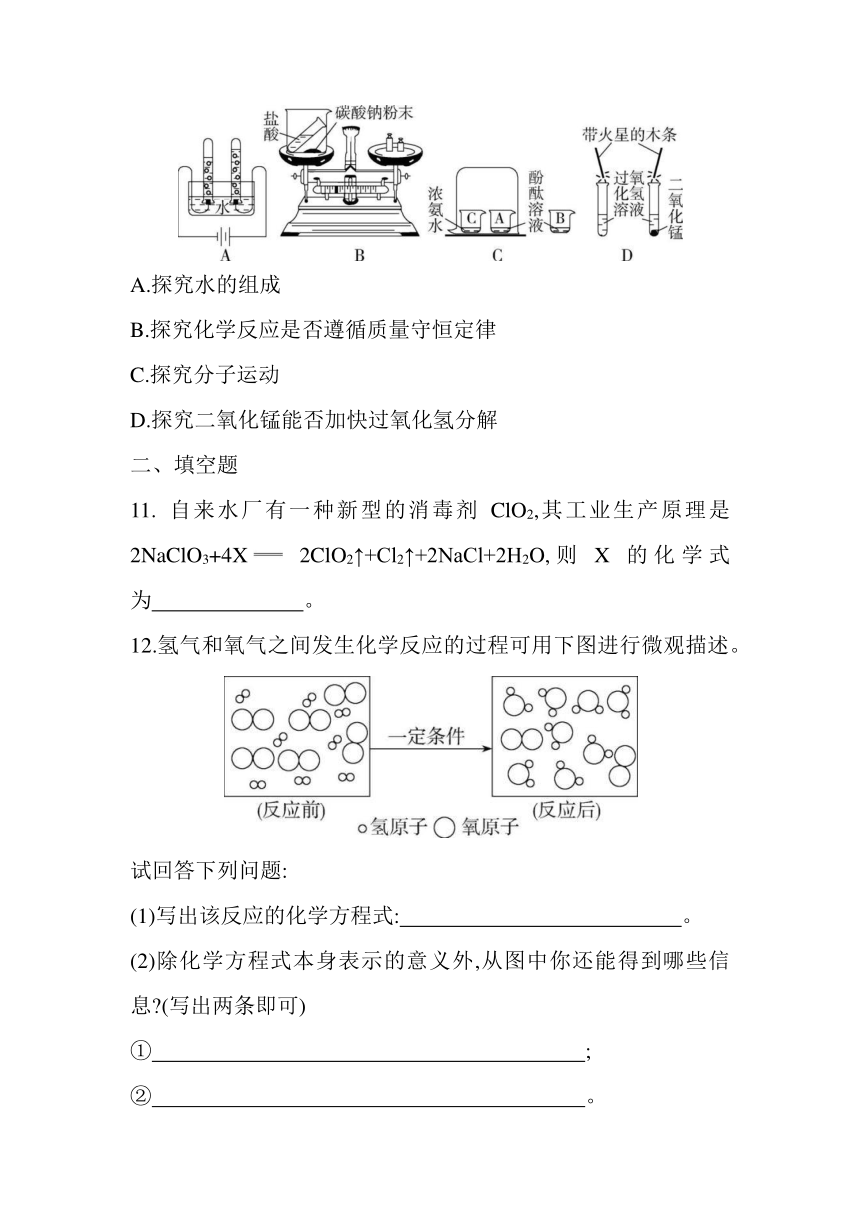
10.下列实验不能达到实验目的的是 ( )
A.探究水的组成
B.探究化学反应是否遵循质量守恒定律
C.探究分子运动
D.探究二氧化锰能否加快过氧化氢分解
二、填空题
11. 自来水厂有一种新型的消毒剂ClO2,其工业生产原理是2NaClO3+4X 2ClO2↑+Cl2↑+2NaCl+2H2O,则X的化学式为 。?
12.氢气和氧气之间发生化学反应的过程可用下图进行微观描述。
试回答下列问题:
(1)写出该反应的化学方程式: 。?
(2)除化学方程式本身表示的意义外,从图中你还能得到哪些信息?(写出两条即可)
① ;?
② 。?
13. 某化学反应的微观示意图如图所示,其中相同的球代表同种原子。
(1)该化学反应中,发生变化的是 (填“分子”或“原子”),参加反应的两种分子的个数比为 。?
(2)该反应的生成物是 。?
A.化合物 B.单质 C.混合物
(3)该反应的微观示意图说明,化学反应遵守质量守恒定律的原因是 。?
答案解析
一、选择题
1.答案 B 参加反应的硫与氧气的质量比是1∶1,故B错误。
2.答案 A 从化学方程式中获得的信息主要有反应物、生成物、反应条件、各物质间的质量关系等,根据化学方程式无法确定化学反应的快慢,故选A。
3.答案 C 由反应的微观示意图可知,反应后原子的数目不变,A错误;生成物的分子个数比为2∶1或1∶2,B错误;化学变化的实质是分子分为原子,原子重新组合成新的分子,故化学反应是原子的重新组合,C正确;反应前后物质的种类发生改变,分子的种类发生了变化,D错误。
4.答案 B 根据反应前后原子种类和数目不变可知,每个X中含有2个氢原子;反应前共有8个氧原子,反应后2个X中应含有2个氧原子,则每个X中含有2个氢原子和1个氧原子,所以X的化学式为H2O,故选B。
5.答案 D 根据质量守恒定律可得,50+0.5=23+x+24+3,解得x=0.5,A正确;反应后,甲质量减少27 g,丙质量增加24 g,丁质量增加3 g,则该反应可表示为甲丙+丁,为分解反应,甲一定是化合物,B正确、D错误;丙和丁的质量变化比为24∶3=8∶1,C正确。
6.答案 A 根据质量守恒定律可得,b=1-40%-10%-42%=8%,参加反应的甲和乙的质量比为(70%-42%)∶(14%-8%)=14∶3,当乙的质量分数减少14%-11%=3%时,甲的质量分数应减少14%,则a=70%-14%=56%;生成的丙和参加反应的乙的质量比为(40%-6%)∶(14%-8%)=17∶3,当乙的质量分数减少14%-11%=3%时,丙的质量分数应增加17%,则c=6%+17%=23%;反应前后,丁的质量分数不变,所以d=10%。
7.答案 B 反应的化学方程式为C2H8N2+2N2O43N2↑+2X↑+4H2O↑,反应前碳、氢、氮、氧原子个数分别为2、8、6、8,反应后已知的生成物中碳、氢、氮、氧原子个数分别为0、8、6、4,根据反应前后原子种类、数目不变知,2X中含有2个碳原子和4个氧原子,则每个X由1个碳原子和2个氧原子构成,X的化学式为CO2,A错误;偏二甲肼中碳元素的质量分数为12×212×2+1×8+14×2×100%=40%,B正确;分解反应的特征为“一变多”,C错误;生成N2和H2O的质量比为(3×28)∶(4×18)=7∶6,D错误。
8.答案 B 由质量守恒定律,反应前后,原子种类、数目均不变知,每个X由4个碳原子、4个氢原子和1个硫原子构成,则物质X的化学式为C4H4S。
9.答案 C 由图示可知,反应物中既有单质,又有化合物,A项错误;图示反应的生成物有两种,不属于化合反应,B项错误;图示中共有4种物质,C项正确;图示反应符合质量守恒定律,D项错误。
10.答案 B 电解水得到氢气和氧气,根据反应前后元素种类不变可知,水是由氢元素和氧元素组成的,A能达到实验目的;探究质量守恒定律时,凡是有气体参加或有气体生成的反应一定要在密闭容器中进行,B不能达到实验目的;浓氨水具有挥发性,挥发出的NH3运动到A中,NH3溶于水使A中酚酞溶液变红,说明分子在不断地运动,C能达到实验目的;通过对比实验,加有二氧化锰的试管口处的带火星的木条复燃,而另一木条未复燃,说明二氧化锰能加快过氧化氢的分解,D能达到实验目的。
二、填空题
11.答案 HCl
解析 根据反应前后原子种类、个数不变可知,X的化学式为HCl。
12.答案 (1)2H2+O2 2H2O
(2)①在化学反应中,分子可以再分,原子不能再分
②反应前后,原子的种类、数目不变(其他合理答案 也可)
解析 (1)通过观察、分析示意图可知,8个氢分子与4个氧分子反应,生成8个水分子,在该反应中,参加反应的氢分子、氧分子与生成的水分子的个数比为8∶4∶8=2∶1∶2,该反应的化学方程式为2H2+O2 2H2O。
13.答案 (1)分子 3∶1(或1∶3) (2)A (3)化学反应中,反应前后,参与反应的原子种类和数目保持不变
解析 (1)由微粒的变化可知,该化学反应中,发生变化的是分子,参加反应的两种分子的个数比为3∶1(或1∶3)。(2)该反应的生成物由同种分子构成,且这种分子由不同种原子构成,属于化合物。(3)由反应的微观示意图中微粒的变化可知,化学反应遵守质量守恒定律的原因是:化学反应中,反应前后,参与反应的原子种类及数目保持不变。
第五单元 化学方程式
课题1 质量守恒定律
一、选择题
1.下列关于S+O2 SO2的说法不正确的是 ( )
A.表示硫与氧气在点燃条件下反应生成二氧化硫
B.参加反应的硫与氧气的质量比为2∶1
C.反应前后硫原子、氧原子的个数均不变
D.参加反应的氧气与生成的二氧化硫的分子个数比为1∶1
2. 根据化学方程式不能获得该反应的信息是 ( )
A.化学反应的快慢 B.生成物
C.反应条件 D.反应物
3. 如图是某反应的微观示意图(反应条件已省略),下列有关该反应的说法正确的是 ( )
A.反应后原子的数目增多
B.生成物的分子个数比为1∶1∶1
C.化学反应是原子的重新组合
D.反应前后分子的种类不变
4. 已知某反应为MnO2+H2SO4+H2O2MnSO4+O2↑+2X,则X的化学式是 ( )
A.SO2 B.H2O C.H2 D.H2SO3
5. 一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是 ( )
物质
甲
乙
丙
丁
反应前的质量/g
50
0.5
0
0
反应后的质量/g
23
x
24
3
A.x的值等于0.5
B.甲一定是化合物
C.丙和丁的质量变化比为8∶1
D.该反应是化合反应
6.在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是 ( )
A.a=56% B.b=6%
C.c=17% D.d=8%
7. 偏二甲肼(C2H8N2)与N2O4反应放出的能量能把火箭送入太空,该化学方程式为C2H8N2+2N2O42X↑+3N2↑+4H2O↑,下列说法正确的是 ( )
A.X的化学式为CO
B.偏二甲肼中碳元素的质量分数为40%
C.该反应属于分解反应
D.生成N2和H2O的质量比为14∶9
8. 煤油中含有噻吩(用X表示),噻吩具有令人不愉快的气味,其燃烧时发生反应的化学方程式为X+6O2 4CO2+SO2+2H2O,则噻吩的化学式为 ( )
A.CH4 B.C4H4S
C.C4H6S D.C4H8S
9.已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:
(说明:一种小球代表一种元素的原子)
下列说法中正确的是 ( )
A.图示中的反应物都是单质
B.该反应属于化合反应
C.图示中共有4种物质
D.该图示不符合质量守恒定律
10.下列实验不能达到实验目的的是 ( )
A.探究水的组成
B.探究化学反应是否遵循质量守恒定律
C.探究分子运动
D.探究二氧化锰能否加快过氧化氢分解
二、填空题
11. 自来水厂有一种新型的消毒剂ClO2,其工业生产原理是2NaClO3+4X 2ClO2↑+Cl2↑+2NaCl+2H2O,则X的化学式为 。?
12.氢气和氧气之间发生化学反应的过程可用下图进行微观描述。
试回答下列问题:
(1)写出该反应的化学方程式: 。?
(2)除化学方程式本身表示的意义外,从图中你还能得到哪些信息?(写出两条即可)
① ;?
② 。?
13. 某化学反应的微观示意图如图所示,其中相同的球代表同种原子。
(1)该化学反应中,发生变化的是 (填“分子”或“原子”),参加反应的两种分子的个数比为 。?
(2)该反应的生成物是 。?
A.化合物 B.单质 C.混合物
(3)该反应的微观示意图说明,化学反应遵守质量守恒定律的原因是 。?
答案解析
一、选择题
1.答案 B 参加反应的硫与氧气的质量比是1∶1,故B错误。
2.答案 A 从化学方程式中获得的信息主要有反应物、生成物、反应条件、各物质间的质量关系等,根据化学方程式无法确定化学反应的快慢,故选A。
3.答案 C 由反应的微观示意图可知,反应后原子的数目不变,A错误;生成物的分子个数比为2∶1或1∶2,B错误;化学变化的实质是分子分为原子,原子重新组合成新的分子,故化学反应是原子的重新组合,C正确;反应前后物质的种类发生改变,分子的种类发生了变化,D错误。
4.答案 B 根据反应前后原子种类和数目不变可知,每个X中含有2个氢原子;反应前共有8个氧原子,反应后2个X中应含有2个氧原子,则每个X中含有2个氢原子和1个氧原子,所以X的化学式为H2O,故选B。
5.答案 D 根据质量守恒定律可得,50+0.5=23+x+24+3,解得x=0.5,A正确;反应后,甲质量减少27 g,丙质量增加24 g,丁质量增加3 g,则该反应可表示为甲丙+丁,为分解反应,甲一定是化合物,B正确、D错误;丙和丁的质量变化比为24∶3=8∶1,C正确。
6.答案 A 根据质量守恒定律可得,b=1-40%-10%-42%=8%,参加反应的甲和乙的质量比为(70%-42%)∶(14%-8%)=14∶3,当乙的质量分数减少14%-11%=3%时,甲的质量分数应减少14%,则a=70%-14%=56%;生成的丙和参加反应的乙的质量比为(40%-6%)∶(14%-8%)=17∶3,当乙的质量分数减少14%-11%=3%时,丙的质量分数应增加17%,则c=6%+17%=23%;反应前后,丁的质量分数不变,所以d=10%。
7.答案 B 反应的化学方程式为C2H8N2+2N2O43N2↑+2X↑+4H2O↑,反应前碳、氢、氮、氧原子个数分别为2、8、6、8,反应后已知的生成物中碳、氢、氮、氧原子个数分别为0、8、6、4,根据反应前后原子种类、数目不变知,2X中含有2个碳原子和4个氧原子,则每个X由1个碳原子和2个氧原子构成,X的化学式为CO2,A错误;偏二甲肼中碳元素的质量分数为12×212×2+1×8+14×2×100%=40%,B正确;分解反应的特征为“一变多”,C错误;生成N2和H2O的质量比为(3×28)∶(4×18)=7∶6,D错误。
8.答案 B 由质量守恒定律,反应前后,原子种类、数目均不变知,每个X由4个碳原子、4个氢原子和1个硫原子构成,则物质X的化学式为C4H4S。
9.答案 C 由图示可知,反应物中既有单质,又有化合物,A项错误;图示反应的生成物有两种,不属于化合反应,B项错误;图示中共有4种物质,C项正确;图示反应符合质量守恒定律,D项错误。
10.答案 B 电解水得到氢气和氧气,根据反应前后元素种类不变可知,水是由氢元素和氧元素组成的,A能达到实验目的;探究质量守恒定律时,凡是有气体参加或有气体生成的反应一定要在密闭容器中进行,B不能达到实验目的;浓氨水具有挥发性,挥发出的NH3运动到A中,NH3溶于水使A中酚酞溶液变红,说明分子在不断地运动,C能达到实验目的;通过对比实验,加有二氧化锰的试管口处的带火星的木条复燃,而另一木条未复燃,说明二氧化锰能加快过氧化氢的分解,D能达到实验目的。
二、填空题
11.答案 HCl
解析 根据反应前后原子种类、个数不变可知,X的化学式为HCl。
12.答案 (1)2H2+O2 2H2O
(2)①在化学反应中,分子可以再分,原子不能再分
②反应前后,原子的种类、数目不变(其他合理答案 也可)
解析 (1)通过观察、分析示意图可知,8个氢分子与4个氧分子反应,生成8个水分子,在该反应中,参加反应的氢分子、氧分子与生成的水分子的个数比为8∶4∶8=2∶1∶2,该反应的化学方程式为2H2+O2 2H2O。
13.答案 (1)分子 3∶1(或1∶3) (2)A (3)化学反应中,反应前后,参与反应的原子种类和数目保持不变
解析 (1)由微粒的变化可知,该化学反应中,发生变化的是分子,参加反应的两种分子的个数比为3∶1(或1∶3)。(2)该反应的生成物由同种分子构成,且这种分子由不同种原子构成,属于化合物。(3)由反应的微观示意图中微粒的变化可知,化学反应遵守质量守恒定律的原因是:化学反应中,反应前后,参与反应的原子种类及数目保持不变。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
