广西南宁第十高中2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 广西南宁第十高中2020-2021学年高一下学期期末考试化学试题 Word版含答案 |
|
|
| 格式 | doc | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-21 00:00:00 | ||
图片预览




文档简介
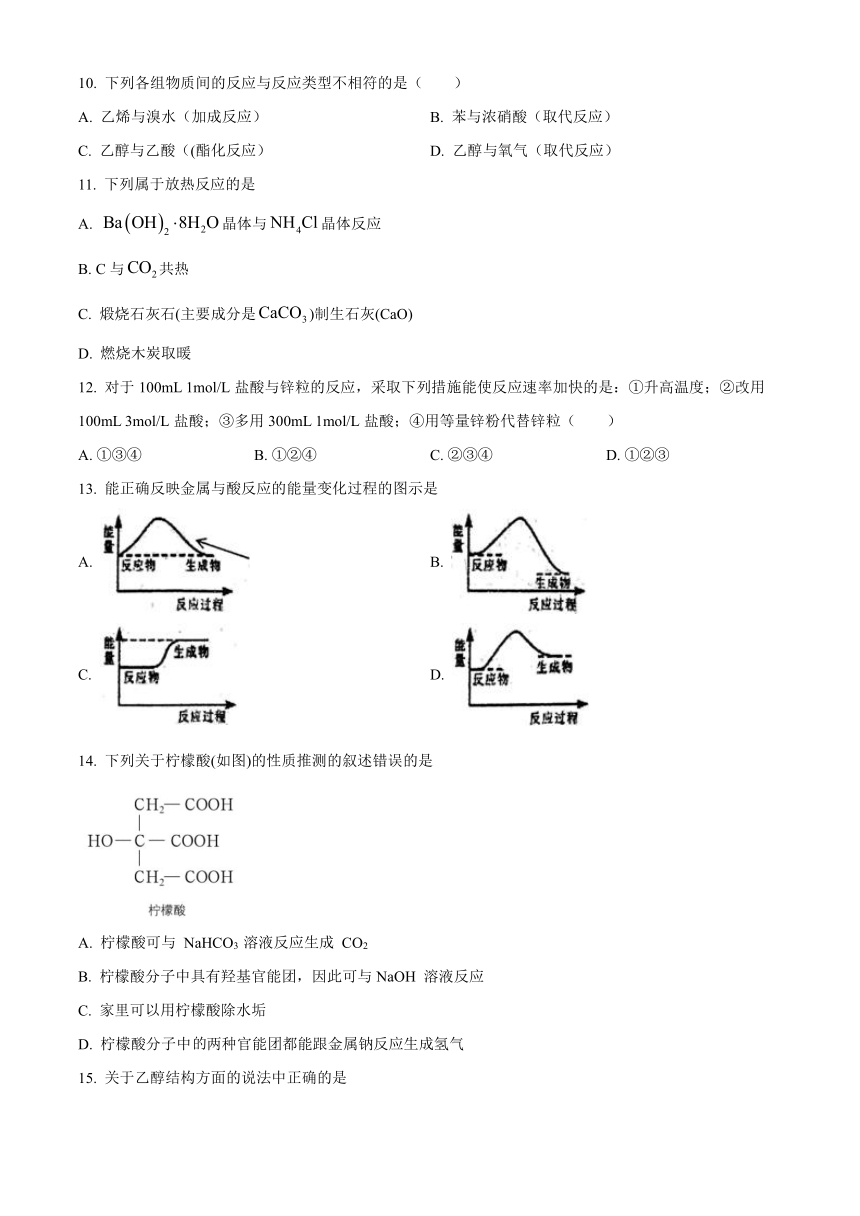
南宁市第十中学2020-2021学年度下学期
期末高一年级化学科考试(理科)
考试时间:90分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Al-27 Mg-24 Cl-35.5
一、单项选择题(每小题2分,共70分。温馨提示:请在答题卡上作答,在本试题上作答无效)
1. 《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”主要成分分别属于
A. 纤维素、蛋白质 B. 糖类、油脂 C. 纤维素、油脂 D. 单糖、蛋白质
2. 下列关于化学能转化为电能的四种装置的说法正确的是
A. 电池Ⅰ中锌是正极
B. 电池Ⅱ是一次性电池
C. 电池Ⅲ工作时,氢气发生还原反应
D. 电池Ⅳ工作时,电子由锌通过导线流向碳棒
3. 下列解释事实的离子方程式中,不正确的是
A. 向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B. 向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO=Cu2++ 2NO2↑+ 2H2O
C. 向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D. 自来水中通入Cl2可以杀菌消毒:Cl2+H2OH++Cl-+HClO
4. 下列关于化学与生产、生活的认识不正确的是
A. CO2、CH4、N2等均是造成温室效应的气体
B. 使用清洁能源是防止酸雨发生的重要措施之一
C. 节能减排符合低碳经济的要求
D. 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
5. 下列有关化学用语表示不正确的是( )
A. 氯离子的结构示意图: B. 乙醇分子式:C2H6O
C. 乙烯的结构式:CH2=CH2 D. 苯分子的比例模型:
6. 下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
化学键类型 离子键、共价键 共价键 离子键 离子键
化合物类型 离子化合物 共价化合物 离子化合物 离子化合物
A. A B. B C. C D. D
7. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是
A. 加热氧化铝 B. 加热氧化汞
C. 电解熔融氯化钠 D. 氢气还原氧化铁
8. 下列有关元素周期律的叙述中,正确的是
A. 氧化性强弱:F2<Cl2 B. 金属性强弱:K<Na
C. 酸性强弱:H3PO4<H2SO4 D. 碱性强弱:NaOH<Mg(OH)2
9. 一定温度下,在容积为1L的密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
A. 该反应的化学方程式为
B. 时间内,
C. 时,正、逆反应速率相等,反应达到平衡状态
D. 平衡时,物质N的转化率为75%
10. 下列各组物质间的反应与反应类型不相符的是( )
A. 乙烯与溴水(加成反应) B. 苯与浓硝酸(取代反应)
C. 乙醇与乙酸((酯化反应) D. 乙醇与氧气(取代反应)
11. 下列属于放热反应的是
A. 晶体与晶体反应
B. C与共热
C. 煅烧石灰石(主要成分是)制生石灰(CaO)
D. 燃烧木炭取暖
12. 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒( )
A. ①③④ B. ①②④ C. ②③④ D. ①②③
13. 能正确反映金属与酸反应的能量变化过程的图示是
A. B.
C. D.
14. 下列关于柠檬酸(如图)的性质推测的叙述错误的是
A. 柠檬酸可与 NaHCO3 溶液反应生成 CO2
B. 柠檬酸分子中具有羟基官能团,因此可与NaOH 溶液反应
C. 家里可以用柠檬酸除水垢
D. 柠檬酸分子中两种官能团都能跟金属钠反应生成氢气
15. 关于乙醇结构方面的说法中正确的是
A. 乙醇结构中有,所以乙醇溶解于水,可以电离出而显碱性
B. 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
C. 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
D. 乙醇与钠反应可以产生氢气,所以乙醇显酸性
16. 下列说法正确的是 ( )
A. 通过石油裂化制得的汽油是纯净物
B. 煤的气化是将煤在高温条件由固态转化为气态的过程,属于物理变化过程
C. 天然气是一种清洁的化石燃料
D. 煤的主要成分是碳,它是一种碳的同素异形体
17. 从海水中提取部分物质的过程如下图所示,粗盐中含Ca2+、Mg2+、等杂质离了。下列有关说法错误的是
A. 过程①可依次加入足量BaCl2、NaOH、Na2CO3后过滤,再通入适量HCl后蒸发结晶
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用电解氯化镁溶液制取Mg单质
D. 反应②和③均由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
18. 根据如图转化关系判断下列说法中正确的是( )
A. (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体
B. 可以利用银镜反应证明反应①的最终产物为葡萄糖
C. 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中可得到大量乙酸
D. 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
19. (核磁共振)可用于含碳化合物的结构分析,下列有的说法正确的是
A. 的质量数是13,原子序数是6,核内有6个中子
B. 与金刚石、石墨、等互为同素异形
C. 碳元素的相对原子质量为13
D. 是碳的一种核素,与互为同位素
20. 某糕点主要由面粉、花生油和鸡蛋清焙制而成。下列说法正确的是( )
A. 该糕点不含糖类物质 B. 淀粉与葡萄糖互为同分异构体
C. 淀粉、油脂和蛋白质都能水解 D. 淀粉、油脂和蛋白质都是高分子化合物
21. 一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2nmolAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的生成速率的2倍
D. 容器中各组分的物质的量分数不随时间变化
22. 下列有机物中所有原子不在同一平面的是
A. 乙烷 B. 乙烯 C. 苯 D. 氯乙烯
23. 兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法正确的是
A. 实验时先通甲烷再点燃A处酒精灯
B. 装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C. 从D中分离出盐酸方法为过滤
D. 装置C经过一段时间的强光照射后,生成的液态有机物有4种
24. 根据能量变化示意图,下列说法正确是
A. 断开1molHCl(g)中的H-Cl键需要吸收bkJ能量
B. 反应H2(g)+Cl2(g)=2HCl(g),反应物的总能量小于生成物的总能量
C. 2molHCl(1)分解成1molH2(g)和1molCl2(g)需要吸收ckJ热量
D. b-a=c
25. 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中不正确的是
A. 产物乙酸乙酯不属于油脂
B. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
26. 从海水晒盐后的母液中提取镁,最基本的方法是往海水中加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2溶液;之后经结晶、过滤、干燥、电解,即可得到金属镁(已知镁在热水中能反应生成氢气)。工艺流程如下:
下列对从海水中提取镁的有关说法正确的是
A. 电解MgCl2溶液即可得到金属镁
B. 电解后得到的镁应在氮气氛围中冷却
C. 上述从母液中提取镁的变化过程中不存在分解反应
D. 制备过程中产生的氯气可以用来制备盐酸,循环使用
27. 从海水中提取溴常用的一种工艺涉及以下过程:
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr;则正确的步骤为( )
A. ②①③④ B. ①②③④ C. ②①④③ D. ③②①④
28. 短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,XY2为红棕色气体,Z的焰色反应呈黄色。下列叙述正确的是
A. 原子半径的大小顺序:r(X)>r(Y)>r(Z)
B. 气态氢化物的热稳定性:X>Y
C. 元素X的最高价氧化物对应的水化物是强酸
D. 化合物XY、Z2Y、Z2Y2中化学键的类型相同
29. 下表中金属的冶炼原理与方法不完全正确的是
冶炼原理 方法
A
热分解
B
电解法
C
热分解
D
热还原
A. A B. B C. C D. D
30. 下列叙述错误的是
A. 乙醇()和二甲醚()互为同分异构体
B. 和属于同系物
C. 和属于同素异形体
D. 、、是氢的三种同位素
31. 下列由实验得出的结论正确的是
实验 结论
A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2—二溴乙烷无色、可溶于四氯化碳
B 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性弱于碳酸的酸性
D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
A. A B. B C. C D. D
32. 进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
A. (CH3)2CHCH2CH2CH3 B. (CH3CH2)2CHCH3
C. (CH3)2CHCH(CH3)2 D. (CH3)3CCH2CH3
33. 设为阿伏加德罗常数的值,下列叙述中正确的是
A. 中含有的碳碳单键数为
B. 和苯蒸气的混合气体中所含的碳原子数为
C. 标准状况下,2.24L四氯化碳中所含分子数为0.1
D. 1mol羟基所含电子数为10
34. 使1乙烯与氯气先发生加成反应,然后使该加成反应产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气总的物质的量最多是
A. 3 B. 4 C. 5 D. 6
35. 利用如图装置做铝热反应实验,下列说法不正确的是
A. 该反应的化学方程式是
B. 该反应会产生高温、发出强光
C. 根据铝热反应的原理,可以冶炼某些高熔点的金属
D. 若反应中转移3mol电子,则消耗氧化剂的物质的量是1mol
二、填空题(含3小题,共30分。温馨提示:请在答题卡上作答,在本试题上作答无效)
36. 碘是人体必需的微量元素之一,海带、海藻等海洋植物中均含有丰富的碘元素。实验室从海带中提取I2的流程如图:
(1)步骤③的实验操作名称是_______。
(2)步骤④发生反应的离子方程式是_______。
(3)步骤⑤的实验操作名称是萃取、分液,该操作必须用到的主要玻璃仪器是_______和烧杯,可选择的萃取剂_______(填字母)。
A.盐酸 B.酒精 C.四氯化碳 D.苯
(4)检验水溶液中是否含有I2的方法是向溶液中加入_______溶液,若溶液变为_______色,则含有I2。
(5)从含I2的有机溶剂中提取I2和回收有机溶剂,还需要经过蒸馏。蒸馏时,温度计水银球应置于蒸馏烧瓶的_______处。
37. 一定温度下,向体积为2L的密闭容器中通入(气体)和(无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:
(1)0~3min内用表示的平均反应速率为_______。
(2)若升高温度,则v(正)_______(填“加快”“减慢”或“不变”,下同),v(逆)_______。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中,乙中,则_______(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是_______
A.
B.体系的颜色不再改变
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol Y的同时消耗2n mol X
E.单位时间内消耗n mol Y的同时生成2n mol X
38. 己知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
(1)A分子中官能团的名称是_______,D中官能团的名称是_______;反应①的反应类型是_______反应。
(2)反应②的化学方程式是_______,反应型:_______;反应④的化学方程式是_______,反应类型:_______。
(3)E是常见的高分子材料,合成E的化学方程式是_______。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①装置中使用球形干燥管除起到冷凝作用外,另一重要作用是_______,b中分离乙酸乙酯必须使用的一种玻璃仪器是_______。
②b试管中饱和溶液的作用是_______(填字母)。
A.降低乙酸乙酯的溶解度
B.除去实验中挥发出来的硫酸
C.除去乙酸乙酯中混有的乙酸和乙醇
南宁市第十中学2020-2021学年度下学期
期末高一年级化学科考试(理科) 答案版
考试时间:90分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Al-27 Mg-24 Cl-35.5
一、单项选择题(每小题2分,共70分。温馨提示:请在答题卡上作答,在本试题上作答无效)
1. 《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”主要成分分别属于
A. 纤维素、蛋白质 B. 糖类、油脂 C. 纤维素、油脂 D. 单糖、蛋白质
【答案】A
2. 下列关于化学能转化为电能的四种装置的说法正确的是
A. 电池Ⅰ中锌是正极
B. 电池Ⅱ是一次性电池
C. 电池Ⅲ工作时,氢气发生还原反应
D. 电池Ⅳ工作时,电子由锌通过导线流向碳棒
【答案】D
3. 下列解释事实的离子方程式中,不正确的是
A. 向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B. 向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO=Cu2++ 2NO2↑+ 2H2O
C. 向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D. 自来水中通入Cl2可以杀菌消毒:Cl2+H2OH++Cl-+HClO
【答案】B
4. 下列关于化学与生产、生活的认识不正确的是
A. CO2、CH4、N2等均是造成温室效应的气体
B. 使用清洁能源是防止酸雨发生的重要措施之一
C. 节能减排符合低碳经济的要求
D. 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
【答案】A
5. 下列有关化学用语表示不正确的是( )
A. 氯离子的结构示意图: B. 乙醇分子式:C2H6O
C. 乙烯的结构式:CH2=CH2 D. 苯分子的比例模型:
【答案】C
6. 下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
化学键类型 离子键、共价键 共价键 离子键 离子键
化合物类型 离子化合物 共价化合物 离子化合物 离子化合物
A. A B. B C. C D. D
【答案】B
7. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是
A. 加热氧化铝 B. 加热氧化汞
C. 电解熔融氯化钠 D. 氢气还原氧化铁
【答案】A
8. 下列有关元素周期律的叙述中,正确的是
A. 氧化性强弱:F2<Cl2 B. 金属性强弱:K<Na
C. 酸性强弱:H3PO4<H2SO4 D. 碱性强弱:NaOH<Mg(OH)2
【答案】C
9. 一定温度下,在容积为1L的密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
A. 该反应的化学方程式为
B. 时间内,
C. 时,正、逆反应速率相等,反应达到平衡状态
D. 平衡时,物质N的转化率为75%
【答案】D
10. 下列各组物质间的反应与反应类型不相符的是( )
A. 乙烯与溴水(加成反应) B. 苯与浓硝酸(取代反应)
C. 乙醇与乙酸((酯化反应) D. 乙醇与氧气(取代反应)
【答案】D
11. 下列属于放热反应的是
A. 晶体与晶体反应
B. C与共热
C. 煅烧石灰石(主要成分是)制生石灰(CaO)
D. 燃烧木炭取暖
【答案】D
12. 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒( )
A. ①③④ B. ①②④ C. ②③④ D. ①②③
【答案】B
13. 能正确反映金属与酸反应的能量变化过程的图示是
A. B.
C. D.
【答案】B
14. 下列关于柠檬酸(如图)的性质推测的叙述错误的是
A. 柠檬酸可与 NaHCO3 溶液反应生成 CO2
B. 柠檬酸分子中具有羟基官能团,因此可与NaOH 溶液反应
C. 家里可以用柠檬酸除水垢
D. 柠檬酸分子中两种官能团都能跟金属钠反应生成氢气
【答案】B
15. 关于乙醇结构方面的说法中正确的是
A. 乙醇结构中有,所以乙醇溶解于水,可以电离出而显碱性
B. 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
C. 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
D. 乙醇与钠反应可以产生氢气,所以乙醇显酸性
【答案】B
16. 下列说法正确的是 ( )
A. 通过石油裂化制得的汽油是纯净物
B. 煤的气化是将煤在高温条件由固态转化为气态的过程,属于物理变化过程
C. 天然气是一种清洁的化石燃料
D. 煤的主要成分是碳,它是一种碳的同素异形体
【答案】C
17. 从海水中提取部分物质的过程如下图所示,粗盐中含Ca2+、Mg2+、等杂质离了。下列有关说法错误的是
A. 过程①可依次加入足量BaCl2、NaOH、Na2CO3后过滤,再通入适量HCl后蒸发结晶
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用电解氯化镁溶液制取Mg单质
D. 反应②和③均由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
【答案】C
18. 根据如图转化关系判断下列说法中正确的是( )
A. (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体
B. 可以利用银镜反应证明反应①的最终产物为葡萄糖
C. 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中可得到大量乙酸
D. 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
【答案】B
19. (核磁共振)可用于含碳化合物的结构分析,下列有的说法正确的是
A. 的质量数是13,原子序数是6,核内有6个中子
B. 与金刚石、石墨、等互为同素异形
C. 碳元素的相对原子质量为13
D. 是碳的一种核素,与互为同位素
【答案】D
20. 某糕点主要由面粉、花生油和鸡蛋清焙制而成。下列说法正确的是( )
A. 该糕点不含糖类物质 B. 淀粉与葡萄糖互为同分异构体
C. 淀粉、油脂和蛋白质都能水解 D. 淀粉、油脂和蛋白质都是高分子化合物
【答案】C
21. 一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2nmolAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的生成速率的2倍
D. 容器中各组分的物质的量分数不随时间变化
【答案】D
22. 下列有机物中所有原子不在同一平面的是
A. 乙烷 B. 乙烯 C. 苯 D. 氯乙烯
【答案】A
23. 兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法正确的是
A. 实验时先通甲烷再点燃A处酒精灯
B. 装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C. 从D中分离出盐酸方法为过滤
D. 装置C经过一段时间的强光照射后,生成的液态有机物有4种
【答案】B
24. 根据能量变化示意图,下列说法正确是
A. 断开1molHCl(g)中的H-Cl键需要吸收bkJ能量
B. 反应H2(g)+Cl2(g)=2HCl(g),反应物的总能量小于生成物的总能量
C. 2molHCl(1)分解成1molH2(g)和1molCl2(g)需要吸收ckJ热量
D. b-a=c
【答案】D
25. 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中不正确的是
A. 产物乙酸乙酯不属于油脂
B. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
【答案】D
26. 从海水晒盐后的母液中提取镁,最基本的方法是往海水中加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2溶液;之后经结晶、过滤、干燥、电解,即可得到金属镁(已知镁在热水中能反应生成氢气)。工艺流程如下:
下列对从海水中提取镁的有关说法正确的是
A. 电解MgCl2溶液即可得到金属镁
B. 电解后得到的镁应在氮气氛围中冷却
C. 上述从母液中提取镁的变化过程中不存在分解反应
D. 制备过程中产生的氯气可以用来制备盐酸,循环使用
【答案】D
27. 从海水中提取溴常用的一种工艺涉及以下过程:
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr;则正确的步骤为( )
A. ②①③④ B. ①②③④ C. ②①④③ D. ③②①④
【答案】C
28. 短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,XY2为红棕色气体,Z的焰色反应呈黄色。下列叙述正确的是
A. 原子半径的大小顺序:r(X)>r(Y)>r(Z)
B. 气态氢化物的热稳定性:X>Y
C. 元素X的最高价氧化物对应的水化物是强酸
D. 化合物XY、Z2Y、Z2Y2中化学键的类型相同
【答案】C
29. 下表中金属的冶炼原理与方法不完全正确的是
冶炼原理 方法
A
热分解
B
电解法
C
热分解
D
热还原
A. A B. B C. C D. D
【答案】C
30. 下列叙述错误的是
A. 乙醇()和二甲醚()互为同分异构体
B. 和属于同系物
C. 和属于同素异形体
D. 、、是氢的三种同位素
【答案】B
31. 下列由实验得出的结论正确的是
实验 结论
A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2—二溴乙烷无色、可溶于四氯化碳
B 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性弱于碳酸的酸性
D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
A. A B. B C. C D. D
【答案】A
32. 进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
A. (CH3)2CHCH2CH2CH3 B. (CH3CH2)2CHCH3
C. (CH3)2CHCH(CH3)2 D. (CH3)3CCH2CH3
【答案】D
33. 设为阿伏加德罗常数的值,下列叙述中正确的是
A. 中含有的碳碳单键数为
B. 和苯蒸气的混合气体中所含的碳原子数为
C. 标准状况下,2.24L四氯化碳中所含分子数为0.1
D. 1mol羟基所含电子数为10
【答案】B
34. 使1乙烯与氯气先发生加成反应,然后使该加成反应产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气总的物质的量最多是
A. 3 B. 4 C. 5 D. 6
【答案】C
35. 利用如图装置做铝热反应实验,下列说法不正确的是
A. 该反应的化学方程式是
B. 该反应会产生高温、发出强光
C. 根据铝热反应的原理,可以冶炼某些高熔点的金属
D. 若反应中转移3mol电子,则消耗氧化剂的物质的量是1mol
【答案】D
二、填空题(含3小题,共30分。温馨提示:请在答题卡上作答,在本试题上作答无效)
36. 碘是人体必需的微量元素之一,海带、海藻等海洋植物中均含有丰富的碘元素。实验室从海带中提取I2的流程如图:
(1)步骤③的实验操作名称是_______。
(2)步骤④发生反应的离子方程式是_______。
(3)步骤⑤的实验操作名称是萃取、分液,该操作必须用到的主要玻璃仪器是_______和烧杯,可选择的萃取剂_______(填字母)。
A.盐酸 B.酒精 C.四氯化碳 D.苯
(4)检验水溶液中是否含有I2的方法是向溶液中加入_______溶液,若溶液变为_______色,则含有I2。
(5)从含I2的有机溶剂中提取I2和回收有机溶剂,还需要经过蒸馏。蒸馏时,温度计水银球应置于蒸馏烧瓶的_______处。
【答案】 ①. 过滤 ②. Cl2+2I-=2Cl-+I2 ③. 分液漏斗 ④. CD ⑤. 淀粉 ⑥. 蓝 ⑦. 支管口
37. 一定温度下,向体积为2L的密闭容器中通入(气体)和(无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:
(1)0~3min内用表示的平均反应速率为_______。
(2)若升高温度,则v(正)_______(填“加快”“减慢”或“不变”,下同),v(逆)_______。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中,乙中,则_______(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是_______
A.
B.体系的颜色不再改变
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol Y的同时消耗2n mol X
E.单位时间内消耗n mol Y的同时生成2n mol X
【答案】 ①. 0.05 ②. 加快 ③. 加快 ④. 乙 ⑤. BD
38. 己知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
(1)A分子中官能团的名称是_______,D中官能团的名称是_______;反应①的反应类型是_______反应。
(2)反应②的化学方程式是_______,反应型:_______;反应④的化学方程式是_______,反应类型:_______。
(3)E是常见的高分子材料,合成E的化学方程式是_______。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①装置中使用球形干燥管除起到冷凝作用外,另一重要作用是_______,b中分离乙酸乙酯必须使用的一种玻璃仪器是_______。
②b试管中饱和溶液的作用是_______(填字母)。
A.降低乙酸乙酯的溶解度
B.除去实验中挥发出来的硫酸
C.除去乙酸乙酯中混有的乙酸和乙醇
【答案】 ①. 碳碳双键 ②. 羧基 ③. 加成 ④. 2CH3CH2OH+O2 2CH3CHO+ 2H2O ⑤. 氧化反应 ⑥. CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O ⑦. 取代反应 ⑧. n CH2=CH2 ⑨. 防止倒吸 ⑩. 分液漏斗 ?. AC
期末高一年级化学科考试(理科)
考试时间:90分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Al-27 Mg-24 Cl-35.5
一、单项选择题(每小题2分,共70分。温馨提示:请在答题卡上作答,在本试题上作答无效)
1. 《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”主要成分分别属于
A. 纤维素、蛋白质 B. 糖类、油脂 C. 纤维素、油脂 D. 单糖、蛋白质
2. 下列关于化学能转化为电能的四种装置的说法正确的是
A. 电池Ⅰ中锌是正极
B. 电池Ⅱ是一次性电池
C. 电池Ⅲ工作时,氢气发生还原反应
D. 电池Ⅳ工作时,电子由锌通过导线流向碳棒
3. 下列解释事实的离子方程式中,不正确的是
A. 向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B. 向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO=Cu2++ 2NO2↑+ 2H2O
C. 向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D. 自来水中通入Cl2可以杀菌消毒:Cl2+H2OH++Cl-+HClO
4. 下列关于化学与生产、生活的认识不正确的是
A. CO2、CH4、N2等均是造成温室效应的气体
B. 使用清洁能源是防止酸雨发生的重要措施之一
C. 节能减排符合低碳经济的要求
D. 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
5. 下列有关化学用语表示不正确的是( )
A. 氯离子的结构示意图: B. 乙醇分子式:C2H6O
C. 乙烯的结构式:CH2=CH2 D. 苯分子的比例模型:
6. 下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
化学键类型 离子键、共价键 共价键 离子键 离子键
化合物类型 离子化合物 共价化合物 离子化合物 离子化合物
A. A B. B C. C D. D
7. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是
A. 加热氧化铝 B. 加热氧化汞
C. 电解熔融氯化钠 D. 氢气还原氧化铁
8. 下列有关元素周期律的叙述中,正确的是
A. 氧化性强弱:F2<Cl2 B. 金属性强弱:K<Na
C. 酸性强弱:H3PO4<H2SO4 D. 碱性强弱:NaOH<Mg(OH)2
9. 一定温度下,在容积为1L的密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
A. 该反应的化学方程式为
B. 时间内,
C. 时,正、逆反应速率相等,反应达到平衡状态
D. 平衡时,物质N的转化率为75%
10. 下列各组物质间的反应与反应类型不相符的是( )
A. 乙烯与溴水(加成反应) B. 苯与浓硝酸(取代反应)
C. 乙醇与乙酸((酯化反应) D. 乙醇与氧气(取代反应)
11. 下列属于放热反应的是
A. 晶体与晶体反应
B. C与共热
C. 煅烧石灰石(主要成分是)制生石灰(CaO)
D. 燃烧木炭取暖
12. 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒( )
A. ①③④ B. ①②④ C. ②③④ D. ①②③
13. 能正确反映金属与酸反应的能量变化过程的图示是
A. B.
C. D.
14. 下列关于柠檬酸(如图)的性质推测的叙述错误的是
A. 柠檬酸可与 NaHCO3 溶液反应生成 CO2
B. 柠檬酸分子中具有羟基官能团,因此可与NaOH 溶液反应
C. 家里可以用柠檬酸除水垢
D. 柠檬酸分子中两种官能团都能跟金属钠反应生成氢气
15. 关于乙醇结构方面的说法中正确的是
A. 乙醇结构中有,所以乙醇溶解于水,可以电离出而显碱性
B. 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
C. 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
D. 乙醇与钠反应可以产生氢气,所以乙醇显酸性
16. 下列说法正确的是 ( )
A. 通过石油裂化制得的汽油是纯净物
B. 煤的气化是将煤在高温条件由固态转化为气态的过程,属于物理变化过程
C. 天然气是一种清洁的化石燃料
D. 煤的主要成分是碳,它是一种碳的同素异形体
17. 从海水中提取部分物质的过程如下图所示,粗盐中含Ca2+、Mg2+、等杂质离了。下列有关说法错误的是
A. 过程①可依次加入足量BaCl2、NaOH、Na2CO3后过滤,再通入适量HCl后蒸发结晶
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用电解氯化镁溶液制取Mg单质
D. 反应②和③均由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
18. 根据如图转化关系判断下列说法中正确的是( )
A. (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体
B. 可以利用银镜反应证明反应①的最终产物为葡萄糖
C. 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中可得到大量乙酸
D. 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
19. (核磁共振)可用于含碳化合物的结构分析,下列有的说法正确的是
A. 的质量数是13,原子序数是6,核内有6个中子
B. 与金刚石、石墨、等互为同素异形
C. 碳元素的相对原子质量为13
D. 是碳的一种核素,与互为同位素
20. 某糕点主要由面粉、花生油和鸡蛋清焙制而成。下列说法正确的是( )
A. 该糕点不含糖类物质 B. 淀粉与葡萄糖互为同分异构体
C. 淀粉、油脂和蛋白质都能水解 D. 淀粉、油脂和蛋白质都是高分子化合物
21. 一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2nmolAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的生成速率的2倍
D. 容器中各组分的物质的量分数不随时间变化
22. 下列有机物中所有原子不在同一平面的是
A. 乙烷 B. 乙烯 C. 苯 D. 氯乙烯
23. 兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法正确的是
A. 实验时先通甲烷再点燃A处酒精灯
B. 装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C. 从D中分离出盐酸方法为过滤
D. 装置C经过一段时间的强光照射后,生成的液态有机物有4种
24. 根据能量变化示意图,下列说法正确是
A. 断开1molHCl(g)中的H-Cl键需要吸收bkJ能量
B. 反应H2(g)+Cl2(g)=2HCl(g),反应物的总能量小于生成物的总能量
C. 2molHCl(1)分解成1molH2(g)和1molCl2(g)需要吸收ckJ热量
D. b-a=c
25. 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中不正确的是
A. 产物乙酸乙酯不属于油脂
B. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
26. 从海水晒盐后的母液中提取镁,最基本的方法是往海水中加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2溶液;之后经结晶、过滤、干燥、电解,即可得到金属镁(已知镁在热水中能反应生成氢气)。工艺流程如下:
下列对从海水中提取镁的有关说法正确的是
A. 电解MgCl2溶液即可得到金属镁
B. 电解后得到的镁应在氮气氛围中冷却
C. 上述从母液中提取镁的变化过程中不存在分解反应
D. 制备过程中产生的氯气可以用来制备盐酸,循环使用
27. 从海水中提取溴常用的一种工艺涉及以下过程:
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr;则正确的步骤为( )
A. ②①③④ B. ①②③④ C. ②①④③ D. ③②①④
28. 短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,XY2为红棕色气体,Z的焰色反应呈黄色。下列叙述正确的是
A. 原子半径的大小顺序:r(X)>r(Y)>r(Z)
B. 气态氢化物的热稳定性:X>Y
C. 元素X的最高价氧化物对应的水化物是强酸
D. 化合物XY、Z2Y、Z2Y2中化学键的类型相同
29. 下表中金属的冶炼原理与方法不完全正确的是
冶炼原理 方法
A
热分解
B
电解法
C
热分解
D
热还原
A. A B. B C. C D. D
30. 下列叙述错误的是
A. 乙醇()和二甲醚()互为同分异构体
B. 和属于同系物
C. 和属于同素异形体
D. 、、是氢的三种同位素
31. 下列由实验得出的结论正确的是
实验 结论
A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2—二溴乙烷无色、可溶于四氯化碳
B 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性弱于碳酸的酸性
D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
A. A B. B C. C D. D
32. 进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
A. (CH3)2CHCH2CH2CH3 B. (CH3CH2)2CHCH3
C. (CH3)2CHCH(CH3)2 D. (CH3)3CCH2CH3
33. 设为阿伏加德罗常数的值,下列叙述中正确的是
A. 中含有的碳碳单键数为
B. 和苯蒸气的混合气体中所含的碳原子数为
C. 标准状况下,2.24L四氯化碳中所含分子数为0.1
D. 1mol羟基所含电子数为10
34. 使1乙烯与氯气先发生加成反应,然后使该加成反应产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气总的物质的量最多是
A. 3 B. 4 C. 5 D. 6
35. 利用如图装置做铝热反应实验,下列说法不正确的是
A. 该反应的化学方程式是
B. 该反应会产生高温、发出强光
C. 根据铝热反应的原理,可以冶炼某些高熔点的金属
D. 若反应中转移3mol电子,则消耗氧化剂的物质的量是1mol
二、填空题(含3小题,共30分。温馨提示:请在答题卡上作答,在本试题上作答无效)
36. 碘是人体必需的微量元素之一,海带、海藻等海洋植物中均含有丰富的碘元素。实验室从海带中提取I2的流程如图:
(1)步骤③的实验操作名称是_______。
(2)步骤④发生反应的离子方程式是_______。
(3)步骤⑤的实验操作名称是萃取、分液,该操作必须用到的主要玻璃仪器是_______和烧杯,可选择的萃取剂_______(填字母)。
A.盐酸 B.酒精 C.四氯化碳 D.苯
(4)检验水溶液中是否含有I2的方法是向溶液中加入_______溶液,若溶液变为_______色,则含有I2。
(5)从含I2的有机溶剂中提取I2和回收有机溶剂,还需要经过蒸馏。蒸馏时,温度计水银球应置于蒸馏烧瓶的_______处。
37. 一定温度下,向体积为2L的密闭容器中通入(气体)和(无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:
(1)0~3min内用表示的平均反应速率为_______。
(2)若升高温度,则v(正)_______(填“加快”“减慢”或“不变”,下同),v(逆)_______。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中,乙中,则_______(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是_______
A.
B.体系的颜色不再改变
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol Y的同时消耗2n mol X
E.单位时间内消耗n mol Y的同时生成2n mol X
38. 己知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
(1)A分子中官能团的名称是_______,D中官能团的名称是_______;反应①的反应类型是_______反应。
(2)反应②的化学方程式是_______,反应型:_______;反应④的化学方程式是_______,反应类型:_______。
(3)E是常见的高分子材料,合成E的化学方程式是_______。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①装置中使用球形干燥管除起到冷凝作用外,另一重要作用是_______,b中分离乙酸乙酯必须使用的一种玻璃仪器是_______。
②b试管中饱和溶液的作用是_______(填字母)。
A.降低乙酸乙酯的溶解度
B.除去实验中挥发出来的硫酸
C.除去乙酸乙酯中混有的乙酸和乙醇
南宁市第十中学2020-2021学年度下学期
期末高一年级化学科考试(理科) 答案版
考试时间:90分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 N-14 Na-23 Al-27 Mg-24 Cl-35.5
一、单项选择题(每小题2分,共70分。温馨提示:请在答题卡上作答,在本试题上作答无效)
1. 《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”主要成分分别属于
A. 纤维素、蛋白质 B. 糖类、油脂 C. 纤维素、油脂 D. 单糖、蛋白质
【答案】A
2. 下列关于化学能转化为电能的四种装置的说法正确的是
A. 电池Ⅰ中锌是正极
B. 电池Ⅱ是一次性电池
C. 电池Ⅲ工作时,氢气发生还原反应
D. 电池Ⅳ工作时,电子由锌通过导线流向碳棒
【答案】D
3. 下列解释事实的离子方程式中,不正确的是
A. 向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B. 向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO=Cu2++ 2NO2↑+ 2H2O
C. 向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D. 自来水中通入Cl2可以杀菌消毒:Cl2+H2OH++Cl-+HClO
【答案】B
4. 下列关于化学与生产、生活的认识不正确的是
A. CO2、CH4、N2等均是造成温室效应的气体
B. 使用清洁能源是防止酸雨发生的重要措施之一
C. 节能减排符合低碳经济的要求
D. 合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
【答案】A
5. 下列有关化学用语表示不正确的是( )
A. 氯离子的结构示意图: B. 乙醇分子式:C2H6O
C. 乙烯的结构式:CH2=CH2 D. 苯分子的比例模型:
【答案】C
6. 下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 A B C D
物质 MgCl2 CO2 HCl NaOH
化学键类型 离子键、共价键 共价键 离子键 离子键
化合物类型 离子化合物 共价化合物 离子化合物 离子化合物
A. A B. B C. C D. D
【答案】B
7. 下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是
A. 加热氧化铝 B. 加热氧化汞
C. 电解熔融氯化钠 D. 氢气还原氧化铁
【答案】A
8. 下列有关元素周期律的叙述中,正确的是
A. 氧化性强弱:F2<Cl2 B. 金属性强弱:K<Na
C. 酸性强弱:H3PO4<H2SO4 D. 碱性强弱:NaOH<Mg(OH)2
【答案】C
9. 一定温度下,在容积为1L的密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
A. 该反应的化学方程式为
B. 时间内,
C. 时,正、逆反应速率相等,反应达到平衡状态
D. 平衡时,物质N的转化率为75%
【答案】D
10. 下列各组物质间的反应与反应类型不相符的是( )
A. 乙烯与溴水(加成反应) B. 苯与浓硝酸(取代反应)
C. 乙醇与乙酸((酯化反应) D. 乙醇与氧气(取代反应)
【答案】D
11. 下列属于放热反应的是
A. 晶体与晶体反应
B. C与共热
C. 煅烧石灰石(主要成分是)制生石灰(CaO)
D. 燃烧木炭取暖
【答案】D
12. 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量锌粉代替锌粒( )
A. ①③④ B. ①②④ C. ②③④ D. ①②③
【答案】B
13. 能正确反映金属与酸反应的能量变化过程的图示是
A. B.
C. D.
【答案】B
14. 下列关于柠檬酸(如图)的性质推测的叙述错误的是
A. 柠檬酸可与 NaHCO3 溶液反应生成 CO2
B. 柠檬酸分子中具有羟基官能团,因此可与NaOH 溶液反应
C. 家里可以用柠檬酸除水垢
D. 柠檬酸分子中两种官能团都能跟金属钠反应生成氢气
【答案】B
15. 关于乙醇结构方面的说法中正确的是
A. 乙醇结构中有,所以乙醇溶解于水,可以电离出而显碱性
B. 乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼
C. 乙醇与乙酸反应生成乙酸乙酯,所以乙醇显碱性
D. 乙醇与钠反应可以产生氢气,所以乙醇显酸性
【答案】B
16. 下列说法正确的是 ( )
A. 通过石油裂化制得的汽油是纯净物
B. 煤的气化是将煤在高温条件由固态转化为气态的过程,属于物理变化过程
C. 天然气是一种清洁的化石燃料
D. 煤的主要成分是碳,它是一种碳的同素异形体
【答案】C
17. 从海水中提取部分物质的过程如下图所示,粗盐中含Ca2+、Mg2+、等杂质离了。下列有关说法错误的是
A. 过程①可依次加入足量BaCl2、NaOH、Na2CO3后过滤,再通入适量HCl后蒸发结晶
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用电解氯化镁溶液制取Mg单质
D. 反应②和③均由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
【答案】C
18. 根据如图转化关系判断下列说法中正确的是( )
A. (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体
B. 可以利用银镜反应证明反应①的最终产物为葡萄糖
C. 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中可得到大量乙酸
D. 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
【答案】B
19. (核磁共振)可用于含碳化合物的结构分析,下列有的说法正确的是
A. 的质量数是13,原子序数是6,核内有6个中子
B. 与金刚石、石墨、等互为同素异形
C. 碳元素的相对原子质量为13
D. 是碳的一种核素,与互为同位素
【答案】D
20. 某糕点主要由面粉、花生油和鸡蛋清焙制而成。下列说法正确的是( )
A. 该糕点不含糖类物质 B. 淀粉与葡萄糖互为同分异构体
C. 淀粉、油脂和蛋白质都能水解 D. 淀粉、油脂和蛋白质都是高分子化合物
【答案】C
21. 一定条件下反应2AB(g)?A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2nmolAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的生成速率的2倍
D. 容器中各组分的物质的量分数不随时间变化
【答案】D
22. 下列有机物中所有原子不在同一平面的是
A. 乙烷 B. 乙烯 C. 苯 D. 氯乙烯
【答案】A
23. 兴趣小组在实验室中模拟利用甲烷和氯气发生取代反应制取副产品盐酸,设计如图装置,下列说法正确的是
A. 实验时先通甲烷再点燃A处酒精灯
B. 装置B有均匀混合气体、控制气流速度、干燥混合气体等作用
C. 从D中分离出盐酸方法为过滤
D. 装置C经过一段时间的强光照射后,生成的液态有机物有4种
【答案】B
24. 根据能量变化示意图,下列说法正确是
A. 断开1molHCl(g)中的H-Cl键需要吸收bkJ能量
B. 反应H2(g)+Cl2(g)=2HCl(g),反应物的总能量小于生成物的总能量
C. 2molHCl(1)分解成1molH2(g)和1molCl2(g)需要吸收ckJ热量
D. b-a=c
【答案】D
25. 如图为实验室制取少量乙酸乙酯的装置图,下列关于该实验的叙述中不正确的是
A. 产物乙酸乙酯不属于油脂
B. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C. 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸
【答案】D
26. 从海水晒盐后的母液中提取镁,最基本的方法是往海水中加石灰乳,得到Mg(OH)2沉淀,将沉淀分离后再加入盐酸变成MgCl2溶液;之后经结晶、过滤、干燥、电解,即可得到金属镁(已知镁在热水中能反应生成氢气)。工艺流程如下:
下列对从海水中提取镁的有关说法正确的是
A. 电解MgCl2溶液即可得到金属镁
B. 电解后得到的镁应在氮气氛围中冷却
C. 上述从母液中提取镁的变化过程中不存在分解反应
D. 制备过程中产生的氯气可以用来制备盐酸,循环使用
【答案】D
27. 从海水中提取溴常用的一种工艺涉及以下过程:
①氧化:用Cl2将海水中的NaBr氧化成Br2;
②将海水浓缩;
③提取:用Cl2将HBr氧化成Br2得到产品;
④富集:用空气和水蒸气将Br2吹入吸收塔与吸收剂SO2水溶液反应生成HBr;则正确的步骤为( )
A. ②①③④ B. ①②③④ C. ②①④③ D. ③②①④
【答案】C
28. 短周期元素X、Y、Z的原子序数依次增大,Y原子的最外层电子数是次外层的3倍,XY2为红棕色气体,Z的焰色反应呈黄色。下列叙述正确的是
A. 原子半径的大小顺序:r(X)>r(Y)>r(Z)
B. 气态氢化物的热稳定性:X>Y
C. 元素X的最高价氧化物对应的水化物是强酸
D. 化合物XY、Z2Y、Z2Y2中化学键的类型相同
【答案】C
29. 下表中金属的冶炼原理与方法不完全正确的是
冶炼原理 方法
A
热分解
B
电解法
C
热分解
D
热还原
A. A B. B C. C D. D
【答案】C
30. 下列叙述错误的是
A. 乙醇()和二甲醚()互为同分异构体
B. 和属于同系物
C. 和属于同素异形体
D. 、、是氢的三种同位素
【答案】B
31. 下列由实验得出的结论正确的是
实验 结论
A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2—二溴乙烷无色、可溶于四氯化碳
B 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性弱于碳酸的酸性
D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
A. A B. B C. C D. D
【答案】A
32. 进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
A. (CH3)2CHCH2CH2CH3 B. (CH3CH2)2CHCH3
C. (CH3)2CHCH(CH3)2 D. (CH3)3CCH2CH3
【答案】D
33. 设为阿伏加德罗常数的值,下列叙述中正确的是
A. 中含有的碳碳单键数为
B. 和苯蒸气的混合气体中所含的碳原子数为
C. 标准状况下,2.24L四氯化碳中所含分子数为0.1
D. 1mol羟基所含电子数为10
【答案】B
34. 使1乙烯与氯气先发生加成反应,然后使该加成反应产物与氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气总的物质的量最多是
A. 3 B. 4 C. 5 D. 6
【答案】C
35. 利用如图装置做铝热反应实验,下列说法不正确的是
A. 该反应的化学方程式是
B. 该反应会产生高温、发出强光
C. 根据铝热反应的原理,可以冶炼某些高熔点的金属
D. 若反应中转移3mol电子,则消耗氧化剂的物质的量是1mol
【答案】D
二、填空题(含3小题,共30分。温馨提示:请在答题卡上作答,在本试题上作答无效)
36. 碘是人体必需的微量元素之一,海带、海藻等海洋植物中均含有丰富的碘元素。实验室从海带中提取I2的流程如图:
(1)步骤③的实验操作名称是_______。
(2)步骤④发生反应的离子方程式是_______。
(3)步骤⑤的实验操作名称是萃取、分液,该操作必须用到的主要玻璃仪器是_______和烧杯,可选择的萃取剂_______(填字母)。
A.盐酸 B.酒精 C.四氯化碳 D.苯
(4)检验水溶液中是否含有I2的方法是向溶液中加入_______溶液,若溶液变为_______色,则含有I2。
(5)从含I2的有机溶剂中提取I2和回收有机溶剂,还需要经过蒸馏。蒸馏时,温度计水银球应置于蒸馏烧瓶的_______处。
【答案】 ①. 过滤 ②. Cl2+2I-=2Cl-+I2 ③. 分液漏斗 ④. CD ⑤. 淀粉 ⑥. 蓝 ⑦. 支管口
37. 一定温度下,向体积为2L的密闭容器中通入(气体)和(无色气体),二者之间可相互转化,反应过程中各物质的物质的量随时间的变化曲线如图所示。回答下列问题:
(1)0~3min内用表示的平均反应速率为_______。
(2)若升高温度,则v(正)_______(填“加快”“减慢”或“不变”,下同),v(逆)_______。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得:甲中,乙中,则_______(填“甲”或“乙”)中反应更快。
(4)下列叙述能说明该反应已达到化学平衡状态的是_______
A.
B.体系的颜色不再改变
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol Y的同时消耗2n mol X
E.单位时间内消耗n mol Y的同时生成2n mol X
【答案】 ①. 0.05 ②. 加快 ③. 加快 ④. 乙 ⑤. BD
38. 己知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
(1)A分子中官能团的名称是_______,D中官能团的名称是_______;反应①的反应类型是_______反应。
(2)反应②的化学方程式是_______,反应型:_______;反应④的化学方程式是_______,反应类型:_______。
(3)E是常见的高分子材料,合成E的化学方程式是_______。
(4)某同学用如图所示的实验装置制取少量乙酸乙酯,实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①装置中使用球形干燥管除起到冷凝作用外,另一重要作用是_______,b中分离乙酸乙酯必须使用的一种玻璃仪器是_______。
②b试管中饱和溶液的作用是_______(填字母)。
A.降低乙酸乙酯的溶解度
B.除去实验中挥发出来的硫酸
C.除去乙酸乙酯中混有的乙酸和乙醇
【答案】 ①. 碳碳双键 ②. 羧基 ③. 加成 ④. 2CH3CH2OH+O2 2CH3CHO+ 2H2O ⑤. 氧化反应 ⑥. CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O ⑦. 取代反应 ⑧. n CH2=CH2 ⑨. 防止倒吸 ⑩. 分液漏斗 ?. AC
同课章节目录
