1.3 怎样学习和研究化学 课件(19张PPT)
文档属性
| 名称 | 1.3 怎样学习和研究化学 课件(19张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-21 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
第三节
怎样学习和研究化学
怎样学习和研究化学(学习化学的方法)
一、学习化学需要进行化学实验;
二、学习化学需要进行科学探究;
三、学习化学需要使用化学符号。
一、学习化学需要进行_______;
3、实验步骤:
化学实验
【“铜绿”性质研究实验】
1、实验目的:
(1)研究靠铜绿”的性质、组成
(2)学习实验基本操作
2、实验用品:
稀盐酸、铜绿(碱式碳酸铜)、药匙、酒精汀、试管、试管夹、试管刷等
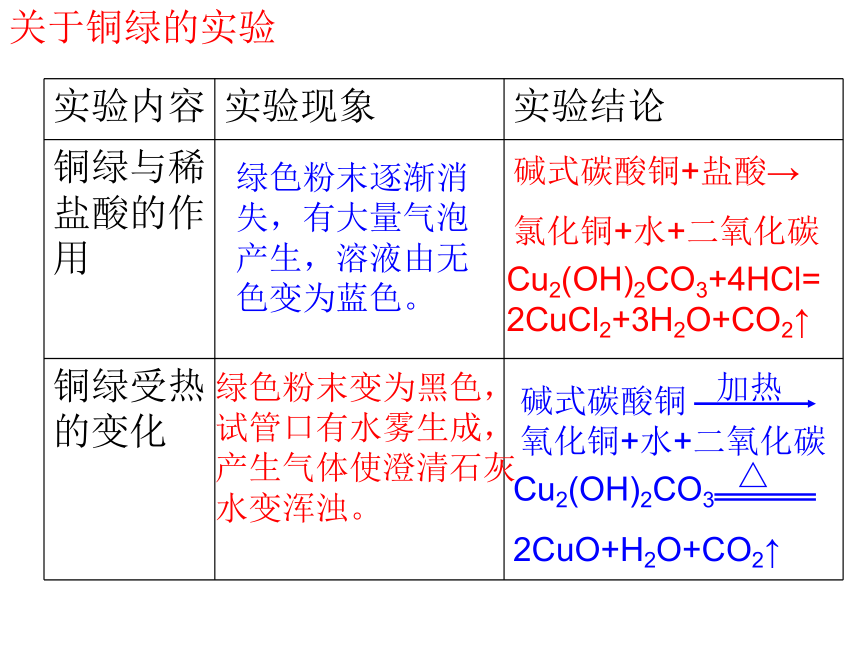
关于铜绿的实验
实验内容 实验现象 实验结论
铜绿与稀盐酸的作用
铜绿受热的变化
绿色粉末逐渐消失,有大量气泡产生,溶液由无色变为蓝色。
碱式碳酸铜+盐酸→
氯化铜+水+二氧化碳
Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
绿色粉末变为黑色,试管口有水雾生成,产生气体使澄清石灰水变浑浊。
碱式碳酸铜
氧化铜+水+二氧化碳
加热
Cu2(OH)2CO3
2CuO+H2O+CO2↑
△
二、学习化学需要进行________;
为了认识某种物质,探究某种化学变化,我们常常要提出一个或多个_____,依据已有的______、______作出与问题有关的______,制定解决问题的_____与_____,进行______,查阅_____,收集_____,通过_____、_____、_____和_____,证实、_____或_____自己的猜测,得出__________和___________。这就是科学探究的一般过程。
科学探究
问题
知识
经验
猜测
思路
方案
化学实验
资料
证据
分析
归纳
推理
论证
修正
否定
合理的结论
问题的答案
【探究金属镁的性质】
引言:镁是一种重要的金属,在一些烟花和照明弹中都含有镁粉。
[提出问题] ____________________?
金属镁有哪些性质
[作出推测]
[实验方案]
探究金属镁的性质:
实验内容 实验步骤 实验现象 实验结论
1.观察镁带外观 观察镁条的颜色、状态,试试看是否容易折弯、扭断。
用砂纸打磨镁带,观察外观是否有变化。
2.镁条的导电性 用打磨好的镁带代替铜丝连接两节干电池和电珠,观察电珠是否发光。
黑色或灰白色条状固体,易弯曲扭断
表面具有银白色金属光泽
镁是一种具有银白色金属光泽的金属,质软。
灯泡发光
镁具有良好的导电性
探究金属镁的性质:
实验内容 实验步骤 实验现象 实验结论
3.镁条燃烧 取一段打磨好的镁带,用坩埚钳夹持,用酒精灯外焰加热。当镁带开始燃烧时,移到石棉网上方,让它继续燃烧,观察燃烧现象及产物的颜色、状态。
4.镁条与白醋反应 取一段打磨好的镁带,放入干净的试管中,注入少量稀盐酸,使镁条大部分浸没在稀盐酸中,观察现象。
镁带在空气中剧烈燃烧,发出耀眼白光,放出大量热,产生一缕白烟,生成白色粉末状固体。
镁+氧气
氧化镁
点燃
2Mg+O2
2MgO
点燃
镁带逐渐减少直至消失,有大量气泡产生,放出大量热
镁+盐酸→
氯化镁+氢气
Mg+2HCl=
MgCl2+H2↑
[得出结论] 镁具有哪些性质?
镁是一种具有银白色金属光泽的金属,质软,具有良好的导电性。
镁能在空气中燃烧,能与酸反应。
【实验反思】
镁粉可用于制作烟花和照明弹,这里用了镁的哪一性质?从而说明了什么?
镁粉用于制作烟花和照明弹,利用了镁在空气中能燃烧并发出耀眼的白光的性质。
这说明物质的性质决定了物质的用途。
三、学习化学需要使用_____________。
三、学习化学需要使用_____________。
化学符号
(一)元素符号
1、元素周期表中前20号元素的元素符号
2、金属活动性顺序及其他元素
物质
组成元素
物质
组成元素
氧气(O2)
氯化氢(HCl)
金刚石(C)
氧化镁(MgO)
镁条(Mg)
二氧化碳(CO2)
氨气(NH3)
碳酸氢铵
(NH4HCO3)
3、写出下列物质的组成元素:
O
H Cl
C
Mg O
Mg
C O
N H
N H C O
(二)化学式
(三)化学方程式
写出本章化学反应的化学方程式
1)碳酸氢铵受热分解:
2)红磷燃烧
3)氨气和氯化氢气体反应
4)碘化钾溶液和硝酸银溶液反应
NH4HCO3 NH3 ↑ +H2O+CO2↑
Δ
4P+5O2 2P2O5
点燃
HCl+NH3=NH4Cl
KI+AgNO3=AgI↓+KNO3
5)碱式碳酸铜和稀盐酸反应
6)碱式碳酸铜受热分解
7)镁带燃烧
8)镁带和稀盐酸反应
Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
Cu2(OH)2CO3 2CuO+H2O+CO2↑
Δ
2Mg+O2 2MgO
点燃
Mg+2HCl=MgCl2+H2↑
1.根据课本第20页研究“铜绿”的实验,写出下列实验操作的正确方法。
(1)向试管中倾倒液体
_____________________________________;
(2)将粉末状药品放入试管中
_____________________________________;
(3)给酒精灯添加酒精
_____________________________________;
取用细口瓶里的药液时,先拿下瓶塞,倒放在桌上,然后拿起瓶子,标签向着手心,瓶口要紧挨着试管口,将液体缓缓倒入试管。倒完液体,立即塞紧瓶塞,把瓶子放回原处。
先使试管倾斜,把盛有药品的药匙(或纸槽)小心地送入试管底部,然后使试管直立起来,让药品全部落到试管底部。
向酒精灯中添加酒精时,将灯头拉出少许,通过漏斗向酒精灯中添加酒精,添加酒精的量不能超过酒精灯容积的2/3
(4)加热试管中的固体药品
_____________________________________;
(5)点燃、熄灭酒精灯
_____________________________________;
(6)处理实验产生的废液、废渣
_____________________________________。
给试管里的固体加热,使管口略向下倾斜。应先进行预热,待试管均匀受热后,再把酒精灯外延固定在放固体的部位加热
应用火柴点燃酒精灯,绝对禁止用燃着的酒精灯引燃另一个酒精灯。用完后必须用灯帽盖灭,切不可用嘴吹灭
废液倒在废液缸中,废渣倒在指定的容器中,不能随意丢弃
2.铜是生活中常见的金属。某同学在实验室完成镁的相关探究后,对铜产生深厚兴趣,请你与他一起完成下列探究实验,并在实验步骤后的横线上填写实验现象。
实验步骤:
(1)找一段废铜电线,小心剥去外层橡胶,观察铜丝的颜色和状态。
_______________________________________
(2)尝试弯折铜丝,感受其硬度和韧性。
______________________________________
(3)取一段铜丝,用坩埚钳夹住,用酒精灯加热,观察现象。
______________________________________
铜丝呈光亮的红色、固体
铜丝有较好的硬度和韧性
亮红色的铜丝表面变黑
(4)另取一段铜丝,放入小试管中,加入白醋,观察现象。
______________________________________
根据上述铜的探究实验,请你总结出有关铜的物理性质和化学性质。
______________________________________
3.写出你知道的元素符号3~4个,并指出它们分别表示哪种元素,能组成哪些物质。
放入白醋中的铜丝表面无明显变化
通常状况下,铜丝是亮红色的固体,有良好的硬度和韧性;加热时能与氧气反应,不能与白醋反应
如氢元素H,碳元素C,氧元素O,等,可以组成的物质有:水(H2O)二氧化碳(CO2)甲烷(CH4)等
第三节
怎样学习和研究化学
怎样学习和研究化学(学习化学的方法)
一、学习化学需要进行化学实验;
二、学习化学需要进行科学探究;
三、学习化学需要使用化学符号。
一、学习化学需要进行_______;
3、实验步骤:
化学实验
【“铜绿”性质研究实验】
1、实验目的:
(1)研究靠铜绿”的性质、组成
(2)学习实验基本操作
2、实验用品:
稀盐酸、铜绿(碱式碳酸铜)、药匙、酒精汀、试管、试管夹、试管刷等
关于铜绿的实验
实验内容 实验现象 实验结论
铜绿与稀盐酸的作用
铜绿受热的变化
绿色粉末逐渐消失,有大量气泡产生,溶液由无色变为蓝色。
碱式碳酸铜+盐酸→
氯化铜+水+二氧化碳
Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
绿色粉末变为黑色,试管口有水雾生成,产生气体使澄清石灰水变浑浊。
碱式碳酸铜
氧化铜+水+二氧化碳
加热
Cu2(OH)2CO3
2CuO+H2O+CO2↑
△
二、学习化学需要进行________;
为了认识某种物质,探究某种化学变化,我们常常要提出一个或多个_____,依据已有的______、______作出与问题有关的______,制定解决问题的_____与_____,进行______,查阅_____,收集_____,通过_____、_____、_____和_____,证实、_____或_____自己的猜测,得出__________和___________。这就是科学探究的一般过程。
科学探究
问题
知识
经验
猜测
思路
方案
化学实验
资料
证据
分析
归纳
推理
论证
修正
否定
合理的结论
问题的答案
【探究金属镁的性质】
引言:镁是一种重要的金属,在一些烟花和照明弹中都含有镁粉。
[提出问题] ____________________?
金属镁有哪些性质
[作出推测]
[实验方案]
探究金属镁的性质:
实验内容 实验步骤 实验现象 实验结论
1.观察镁带外观 观察镁条的颜色、状态,试试看是否容易折弯、扭断。
用砂纸打磨镁带,观察外观是否有变化。
2.镁条的导电性 用打磨好的镁带代替铜丝连接两节干电池和电珠,观察电珠是否发光。
黑色或灰白色条状固体,易弯曲扭断
表面具有银白色金属光泽
镁是一种具有银白色金属光泽的金属,质软。
灯泡发光
镁具有良好的导电性
探究金属镁的性质:
实验内容 实验步骤 实验现象 实验结论
3.镁条燃烧 取一段打磨好的镁带,用坩埚钳夹持,用酒精灯外焰加热。当镁带开始燃烧时,移到石棉网上方,让它继续燃烧,观察燃烧现象及产物的颜色、状态。
4.镁条与白醋反应 取一段打磨好的镁带,放入干净的试管中,注入少量稀盐酸,使镁条大部分浸没在稀盐酸中,观察现象。
镁带在空气中剧烈燃烧,发出耀眼白光,放出大量热,产生一缕白烟,生成白色粉末状固体。
镁+氧气
氧化镁
点燃
2Mg+O2
2MgO
点燃
镁带逐渐减少直至消失,有大量气泡产生,放出大量热
镁+盐酸→
氯化镁+氢气
Mg+2HCl=
MgCl2+H2↑
[得出结论] 镁具有哪些性质?
镁是一种具有银白色金属光泽的金属,质软,具有良好的导电性。
镁能在空气中燃烧,能与酸反应。
【实验反思】
镁粉可用于制作烟花和照明弹,这里用了镁的哪一性质?从而说明了什么?
镁粉用于制作烟花和照明弹,利用了镁在空气中能燃烧并发出耀眼的白光的性质。
这说明物质的性质决定了物质的用途。
三、学习化学需要使用_____________。
三、学习化学需要使用_____________。
化学符号
(一)元素符号
1、元素周期表中前20号元素的元素符号
2、金属活动性顺序及其他元素
物质
组成元素
物质
组成元素
氧气(O2)
氯化氢(HCl)
金刚石(C)
氧化镁(MgO)
镁条(Mg)
二氧化碳(CO2)
氨气(NH3)
碳酸氢铵
(NH4HCO3)
3、写出下列物质的组成元素:
O
H Cl
C
Mg O
Mg
C O
N H
N H C O
(二)化学式
(三)化学方程式
写出本章化学反应的化学方程式
1)碳酸氢铵受热分解:
2)红磷燃烧
3)氨气和氯化氢气体反应
4)碘化钾溶液和硝酸银溶液反应
NH4HCO3 NH3 ↑ +H2O+CO2↑
Δ
4P+5O2 2P2O5
点燃
HCl+NH3=NH4Cl
KI+AgNO3=AgI↓+KNO3
5)碱式碳酸铜和稀盐酸反应
6)碱式碳酸铜受热分解
7)镁带燃烧
8)镁带和稀盐酸反应
Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
Cu2(OH)2CO3 2CuO+H2O+CO2↑
Δ
2Mg+O2 2MgO
点燃
Mg+2HCl=MgCl2+H2↑
1.根据课本第20页研究“铜绿”的实验,写出下列实验操作的正确方法。
(1)向试管中倾倒液体
_____________________________________;
(2)将粉末状药品放入试管中
_____________________________________;
(3)给酒精灯添加酒精
_____________________________________;
取用细口瓶里的药液时,先拿下瓶塞,倒放在桌上,然后拿起瓶子,标签向着手心,瓶口要紧挨着试管口,将液体缓缓倒入试管。倒完液体,立即塞紧瓶塞,把瓶子放回原处。
先使试管倾斜,把盛有药品的药匙(或纸槽)小心地送入试管底部,然后使试管直立起来,让药品全部落到试管底部。
向酒精灯中添加酒精时,将灯头拉出少许,通过漏斗向酒精灯中添加酒精,添加酒精的量不能超过酒精灯容积的2/3
(4)加热试管中的固体药品
_____________________________________;
(5)点燃、熄灭酒精灯
_____________________________________;
(6)处理实验产生的废液、废渣
_____________________________________。
给试管里的固体加热,使管口略向下倾斜。应先进行预热,待试管均匀受热后,再把酒精灯外延固定在放固体的部位加热
应用火柴点燃酒精灯,绝对禁止用燃着的酒精灯引燃另一个酒精灯。用完后必须用灯帽盖灭,切不可用嘴吹灭
废液倒在废液缸中,废渣倒在指定的容器中,不能随意丢弃
2.铜是生活中常见的金属。某同学在实验室完成镁的相关探究后,对铜产生深厚兴趣,请你与他一起完成下列探究实验,并在实验步骤后的横线上填写实验现象。
实验步骤:
(1)找一段废铜电线,小心剥去外层橡胶,观察铜丝的颜色和状态。
_______________________________________
(2)尝试弯折铜丝,感受其硬度和韧性。
______________________________________
(3)取一段铜丝,用坩埚钳夹住,用酒精灯加热,观察现象。
______________________________________
铜丝呈光亮的红色、固体
铜丝有较好的硬度和韧性
亮红色的铜丝表面变黑
(4)另取一段铜丝,放入小试管中,加入白醋,观察现象。
______________________________________
根据上述铜的探究实验,请你总结出有关铜的物理性质和化学性质。
______________________________________
3.写出你知道的元素符号3~4个,并指出它们分别表示哪种元素,能组成哪些物质。
放入白醋中的铜丝表面无明显变化
通常状况下,铜丝是亮红色的固体,有良好的硬度和韧性;加热时能与氧气反应,不能与白醋反应
如氢元素H,碳元素C,氧元素O,等,可以组成的物质有:水(H2O)二氧化碳(CO2)甲烷(CH4)等
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
