3.1 构成物质的基本微粒 课件(50张PPT)
文档属性
| 名称 | 3.1 构成物质的基本微粒 课件(50张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-21 00:00:00 | ||
图片预览









文档简介
(共50张PPT)
构成物质的基本微粒
微粒的性质
实验1:
向烧杯A中加入20ml蒸馏水,滴入两滴酚酞试液,形成溶液甲。
现象:
溶液为无色
结论:
水不能使酚酞变色
实验2:
向甲溶液中滴加1-2滴浓氨水,观察现象。
现象:
溶液变为红色
结论:
氨水能使酚酞变红
微粒的性质
实验3:
在烧杯C中重新配制溶液甲,在烧杯B中加入3—5ml浓氨水,用以大烧杯把两个烧杯罩在一起,观察现象。
现象:
B烧杯中溶液不变色,C烧杯中溶液变红
结论:
浓氨水中挥发出的氨气微粒不断运动,并进入滴有酚酞的蒸馏水中,使溶液变红。
总结:
构成物质的微粒是在不停地运动的。
微粒的性质
实验4:
微粒的性质
提出问题:将等体积的水和酒精混合,体积
和将如何变化?
作出猜想:
1、体积和变大
2、体积和变小
3、体积和不变
取一根约30cm长一段封口的细玻璃管,先往玻璃管中加入滴油红墨水的水,使其充满玻璃管容积的1/2,再滴入无水酒精,使其充满玻璃管。用手指堵紧开口的一端,颠倒数次。
微粒的性质
微粒的性质
现象:
玻璃管上方出现空隙
结论:
等体积的水和酒精混合,体积和变小
总结:
构成物质的微粒之间都有一定的空隙。
实验5:
取两只大小相同的医用注射器,将拴塞向外拉,分别吸入等体积的空气和水,用手指顶住注射器末端的小孔,将拴塞慢慢推入。
微粒的性质
现象:
空气易被压缩,水不易被压缩
结论:
气体比较容易被压缩,固体和液体物质不易被压缩。
总结:
在固体和液体中,微粒之间的空隙比较小,在气体物质中,微粒之间的空隙比较大。
微粒的性质
(1)物质都是由极其微小的,肉眼看不见的微粒构成的。
(2)构成物质的微粒总是在不停地运动的。微粒质量越小,运动速度越快,质量越大,运动速度越慢。
(3)不论固体、液体还是气体,构成物质的微粒之间都有一定的空隙。在固体、液体中,微粒间的距离比较小,在气体物质中,微粒之间的距离比较大。所以气体往往比较容易被压缩,固体和液体物质不易被压缩。
构成物质的基本微粒
构成物质的微粒有:
分子
原子
离子
金刚石是由碳原子构成的
食盐是由钠离子和氯离子构成的
干冰是由二氧化碳分子构成的
构成物质的基本微粒
分子
定义:
分子是保持物质化学性质的一种微粒。
特点:
(1)分子很小,即体积小,质量小。
(2)分子在不停地运动。
(3)分子之间有一定空隙。
(4)分子间有作用力。
(5)由分子构成的物质,其化学性质由分子保持。同种分子性质相同,不同种分子性质不同。
构成物质的基本微粒
原子
定义:
原子是化学变化中的最小微粒。
特点:
(1)原子很小,即体积小,质量小。
(2)原子在不停地运动。
(3)原子之间有一定空隙。
(4)原子间有作用力。
(5)由原子构成的物质,其化学性质由原子保持。同种原子性质相同,不同种原子性质不同。
构成物质的基本微粒
离子
定义:
离子是带电的原子或原子团。
特点:
(1)离子很小,即体积小,质量小。
(2)离子在不停地运动。
(3)离子之间有一定空隙。
(4)离子间有作用力。
(5)由离子构成的物质,其化学性质由阴离子、阳离子共同保持。同种离子性质相同,不同种离子性质不同。
构成物质的基本微粒
分子、原子、离子的区别
(1)化学变化中分子可以再分,原子不能再分。
(2)原子能构成分子,也能构成物质;而分子不能再构成分子。离子不能构成分子,直接构成物质。
(3)分子、原子呈电中性。阳离子呈正电性,阴离子呈负电性 。
构成物质的基本微粒
用分子和原子的观点解释物理变化和化学变化:
(1)物质在发生物理变化时,分子本身没有改变,变的是分子的运动状态和分子间的距离。
(2)物质发生化学变化的实质就是,反应物的分子被破坏,分解成原子,原子重新组合形成新的分子或新的物质。
构成物质的基本微粒
用分子和原子的观点解释纯净物和混合物 :
混合物是由不同种分子构成的,或由不同种原子构成。
纯净物是由同种分子构成的,或由同种原子构成。
原子结构
原子结构发现历程
1803年,英国科学家道尔顿提出了近代原子学说
1897年,英国科学家汤姆生发现了电子
原子结构
1911年,英国科学家卢瑟福利用α粒子轰击金箔实验发现了原子核,并提出原子的核状结构。1919年,卢瑟福用α粒子轰击氮原子核等,发现原子核里有质子,并于1920年预言原子核中有中子 ;1932年经过不少科学家反复实验,证实中子的存在。
原子结构
原子结构
现代原子结构理论
科学家们研究发现,原子是由带正电荷的原子核和带负电荷的电子构成的。
原子核是由质子和中子两种微粒构成`。
原子
原子核
电子
质子
中子
(带一个单位正电荷)
(不带电)
(带正电)
(带一个单位负电荷)
在原子中,核电荷数=质子数=核外电子数。
原子核所带的电量与核外电子的电量相等,电性相反,因而原子呈电中性。
原子结构
常见原子的结构
原子 核电荷数 质子数 电子数 中子数
氢 1 1 1 0
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 11 12
铁 26 26 26 30
相对原子质量
以一种碳原子的质量的1/12作为基准,其它原子的质量与这一基准的比称为这种原子的相对原子质量。(用Ar表示)
相对原子质量
其它原子的质量
碳原子的质量的1/12
相对原子质量
已知作为相对原子质量基准的l个碳原子的质量为l.993×10-26kg,1个氧原子的质量为 2.657×10-26kg,求氧的相对原子质量,
氧的相对原子质量【Ar(O)】
2.657×10-26kg
l.993×10-26kg×
1
12
16
相对原子质量
质子和中子的质量大约相等,且质子的质量大约为碳原子质量的1/12。
=某种原子的质量/碳原子质量的1/12
相对原子质量
=(原子核质量+核外电子质量)/碳原子质量的1/12
电子质量极小,相当于质子质量的1/1836。
≈原子核质量/碳原子质量的1/12
=(质子的质量+中子的质量)/碳原子质量的1/12
=(质子数×一个质子的质量+中子数×一个中子的质量)/碳原子质量的1/12
=质子数+中子数
相对原子质量≈质子数+中子数
常见原子的结构
原子 核电荷数 质子数 电子数 中子数 相对原子质量
氢 1 1 1 0
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 11 12
铁 26 26 26 30
1
12
16
23
56
相对原子质量
相对原子质量
相对分子质量(Mr)等于构成分子的各原子的相对原子质量(Ar)的总和。
O2的相对分子质量
例如:计算O2、CO2、H2CO3的相对分子质量。
=16×2
=32
CO2的相对分子质量
=12+16×2
=44
H2CO3的相对分子质量
=1×2+12+16×3
=62
核外电子排布
核外电子排布
核外电子排布
核外电子排布
核外电子排布
在含有多个电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动。能量高的,通常在离核较远的区域运动。我们把电子离核远近的不同的运动区域叫做电子层,能量稍低、离核稍近的叫第一层,能量高、离核稍远的叫第二层,由里往外依次类推,分别叫做第三、四、五……层。由此可见,核外电子是在能量不同的层次上运动的,也就是说核外电子是分层排布的。
核外电子排布
原子结构示意图:
用圆圈表示原子核,在圆圈内用正数表示核电荷数数(或核内质子数),用弧线表示电子层,用弧线上的数字表示该电子层所排电子数。
核外电子排布
(1)电子总是从能量最低的电子层排起,然后再由里往外,依次排在能量逐渐升高的电子层里。
核外电子的分层排布规律
核外电子排布
核外电子的分层排布规律
(2)每个电子层只能容纳一定数目的电子,所容纳的电子数最多只能容纳2n2个(n为电子层数)
核外电子排布
核外电子的分层排布规律
(3)最外层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)。次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
以上三点规律是相互联系的,必须同时遵守。
核外电子排布
稀有气体元素的原子最外层电子数一般是8个(氦原子是2个),属于稳定结构,因此它们的化学性质稳定。
各类元素原子最外层电子数特点
核外电子排布
金属元素的原子最外层电子数一般少于4个,在化学反应中易失去最外层电子,使次外层变为最外层,达到稳定结构
各类元素原子最外层电子数特点
核外电子排布
非金属元素的原子最外层电子数则一般多于或等于4个,在化学反应中易得到电子,使最外层达到8个电子的稳定结构。
各类元素原子最外层电子数特点
核外电子排布
稀有气体元素的原子最外层电子数一般是8个(氦原子是2个),属于稳定结构,因此它们的化学性质稳定。
各类元素原子最外层电子数特点
金属元素的原子最外层电子数一般少于4个,在化学反应中易失去最外层电子,使次外层变为最外层,达到稳定结构
非金属元素的原子最外层电子数则一般多于或等于4个,在化学反应中易得到电子,使最外层达到8个电子的稳定结构。
所以元素的化学性质与该元素原子的最外层电子数关系密切。
化合物形成——氯化钠的形成
钠在氯气中燃烧
现象:
1、产生黄色火焰
2、放出大量热
3、产生浓厚白烟
结论:
钠+氯气 氯化钠
点燃
2Na+Cl2 2NaCl
点燃
化合物形成——氯化钠的形成
氯化钠的形成过程:
钠原子的质子数为11,最外电子层上有1个电子,在化学反应中容易失去电子,使次外层变为最外层,达到稳定结构。但是这时钠的原子核内仍然是11个质子,带11个正电荷,而核外电子变为10个,带10个负电荷,正负电荷数目不同,原子显正电性。
同样的,氯原子的质子数为17,最外电子层上有7个电子,在化学反应中容易得到1个电子,使最外层变为8个电子,达到稳定结构。但是这时氯的原子核内仍然是17个质子,带17个正电荷,而核外电子变为18个,带18个负电荷,正负电荷数目不同,原子显负电性。
化合物形成——氯化钠的形成
氯化钠的形成过程:
我们把这种带电的原子或原子团叫做离子。其中带正电的离子叫阳离子,带负电的离子叫阴离子。
象氯化钠这样由阴阳离子相互作用形成的化合物叫做离子化合物。在离子化合物中不存在分子,只存在阴阳离子。
化合物形成——氯化氢的形成
氢气在氯气中燃烧
现象:
1、产生苍白色火焰
2、放出大量热
3、集气瓶口出现白雾
结论:
氢气+氯气 氯化氢
点燃
H2+Cl2 2HCl
点燃
化合物形成——氯化氢的形成
氯化氢的形成过程
氢原子的质子数为1,第一电子层(最外电子层)上有1个电子,在化学反应中容易得到1个电子,使最外层变为2个电子,达到稳定结构。同样的,氯原子的质子数为17,最外电子层上有7个电子,在化学反应中也容易得到1个电子,使最外层变为8个电子,达到稳定结构。
这样,氢原子和氯原子各拿出一个电子形成一个电子对,为两个原子共用,围绕两个原子核运动,使两个原子都达到稳定结构,这个电子对称为共用电子对。一个氢原子和一个氯原子就通过共用电子对形成了一个氯化氢分子。
化合物形成——氯化氢的形成
氯化氢的形成过程
象氯化氢这样由共用电子对形成分子的化合物叫做共价化合物。共价化合物由分子构成。
1、工业上用甲和乙在一定条件下通过化合反应制备丙,下列是三种分子的模型图,根据下列微观示意图得出的结论错误的是( )
A.甲的化学式为C2H4
B.保持乙化学性质的最小微粒是水分子
C.乙和丙都属于氧化物
D.化学反应前后分子发生了改变
C
2、如图是某化学反应过程的微观示意图,下列有关说法正确的是( )
A.反应前后分子的个数不变
B.生成物有三种
C.反应前后汞原子和氧原子的个数不变
D.汞和氧气都由分子构成
C
3、汤姆森和卢瑟福都对现代原子结构理论做出了巨大贡献。下列关于原子结构的论述中,不属于他们两人共同观点的是 ( )
A.原子很小,但可以分
B.原子是构成物质的基本粒子
C.原子的电子带负电荷
D.原子由原子核和核外电子构成
4、关于原子、分子、离子的说法中,错误的是 ( )
A.原子不能直接构成物质
B.分子可以保持物质的化学性质
C.原子的质量主要集中在原子核上
D.金属原子失去电子会形成阳离子
D
A
5、下列对分子、原子、离子的认识,正确的是 ( )
A.原子是一切变化中最小粒子,不可再分
B.在化学变化中分子不改变
C.温度越高,分子运动越快
D.钠原子和钠离子的化学性质相同
6、某微粒的结构示意图如图所示,下列有关该微粒的说法错误的是 ( )
A.该微粒的原子核内有11个质子
B.该微粒在化学反应中易失去1个电子
C.该微粒的原子核外有3个电子层
D.该图表示的微粒是一种离子
C
D
7、下列微粒结构示意图中,表示阴离子的是 ( )
A. B . C. D.
8、铀235(其原子核内有92个质子,相对原子质量为235)是核电站的主要燃料,下列有关说法正确的是 ( )
A.铀属于非金属元素 B.该原子的核电荷数为92
C.该原子核内有51个中子 D.该原子核外有143个电子
9、钛合金在生产、生活的多个领域应用广泛.有一种钛原子核内有22个质子、26个中子,则该钛原子的核外电子数是 ( )
A.22 B.26 C.58 D.48
8
17
B
B
A
构成物质的基本微粒
微粒的性质
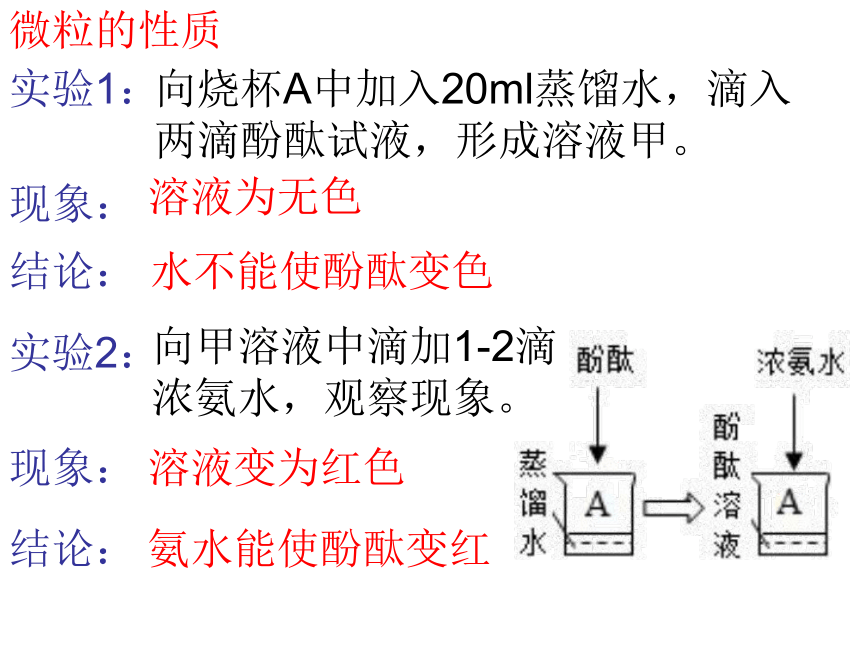
实验1:
向烧杯A中加入20ml蒸馏水,滴入两滴酚酞试液,形成溶液甲。
现象:
溶液为无色
结论:
水不能使酚酞变色
实验2:
向甲溶液中滴加1-2滴浓氨水,观察现象。
现象:
溶液变为红色
结论:
氨水能使酚酞变红
微粒的性质
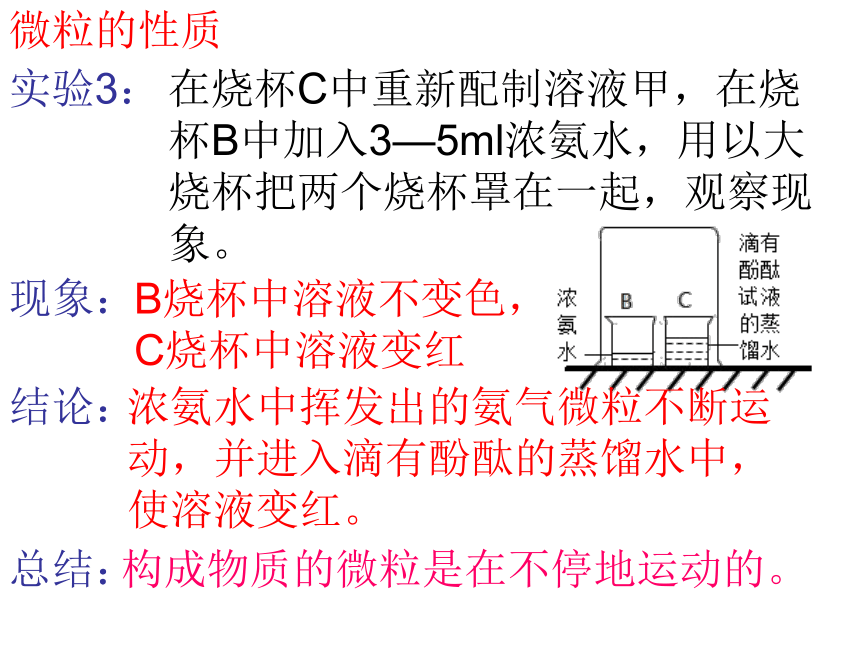
实验3:
在烧杯C中重新配制溶液甲,在烧杯B中加入3—5ml浓氨水,用以大烧杯把两个烧杯罩在一起,观察现象。
现象:
B烧杯中溶液不变色,C烧杯中溶液变红
结论:
浓氨水中挥发出的氨气微粒不断运动,并进入滴有酚酞的蒸馏水中,使溶液变红。
总结:
构成物质的微粒是在不停地运动的。
微粒的性质
实验4:
微粒的性质
提出问题:将等体积的水和酒精混合,体积
和将如何变化?
作出猜想:
1、体积和变大
2、体积和变小
3、体积和不变
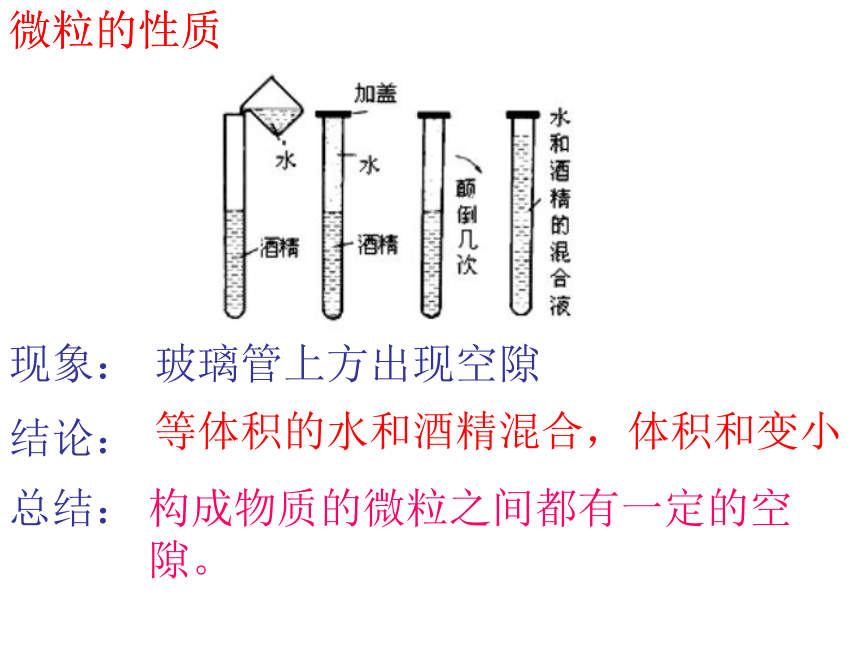
取一根约30cm长一段封口的细玻璃管,先往玻璃管中加入滴油红墨水的水,使其充满玻璃管容积的1/2,再滴入无水酒精,使其充满玻璃管。用手指堵紧开口的一端,颠倒数次。
微粒的性质
微粒的性质
现象:
玻璃管上方出现空隙
结论:
等体积的水和酒精混合,体积和变小
总结:
构成物质的微粒之间都有一定的空隙。
实验5:
取两只大小相同的医用注射器,将拴塞向外拉,分别吸入等体积的空气和水,用手指顶住注射器末端的小孔,将拴塞慢慢推入。
微粒的性质
现象:
空气易被压缩,水不易被压缩
结论:
气体比较容易被压缩,固体和液体物质不易被压缩。
总结:
在固体和液体中,微粒之间的空隙比较小,在气体物质中,微粒之间的空隙比较大。
微粒的性质
(1)物质都是由极其微小的,肉眼看不见的微粒构成的。
(2)构成物质的微粒总是在不停地运动的。微粒质量越小,运动速度越快,质量越大,运动速度越慢。
(3)不论固体、液体还是气体,构成物质的微粒之间都有一定的空隙。在固体、液体中,微粒间的距离比较小,在气体物质中,微粒之间的距离比较大。所以气体往往比较容易被压缩,固体和液体物质不易被压缩。
构成物质的基本微粒
构成物质的微粒有:
分子
原子
离子
金刚石是由碳原子构成的
食盐是由钠离子和氯离子构成的
干冰是由二氧化碳分子构成的
构成物质的基本微粒
分子
定义:
分子是保持物质化学性质的一种微粒。
特点:
(1)分子很小,即体积小,质量小。
(2)分子在不停地运动。
(3)分子之间有一定空隙。
(4)分子间有作用力。
(5)由分子构成的物质,其化学性质由分子保持。同种分子性质相同,不同种分子性质不同。
构成物质的基本微粒
原子
定义:
原子是化学变化中的最小微粒。
特点:
(1)原子很小,即体积小,质量小。
(2)原子在不停地运动。
(3)原子之间有一定空隙。
(4)原子间有作用力。
(5)由原子构成的物质,其化学性质由原子保持。同种原子性质相同,不同种原子性质不同。
构成物质的基本微粒
离子
定义:
离子是带电的原子或原子团。
特点:
(1)离子很小,即体积小,质量小。
(2)离子在不停地运动。
(3)离子之间有一定空隙。
(4)离子间有作用力。
(5)由离子构成的物质,其化学性质由阴离子、阳离子共同保持。同种离子性质相同,不同种离子性质不同。
构成物质的基本微粒
分子、原子、离子的区别
(1)化学变化中分子可以再分,原子不能再分。
(2)原子能构成分子,也能构成物质;而分子不能再构成分子。离子不能构成分子,直接构成物质。
(3)分子、原子呈电中性。阳离子呈正电性,阴离子呈负电性 。
构成物质的基本微粒
用分子和原子的观点解释物理变化和化学变化:
(1)物质在发生物理变化时,分子本身没有改变,变的是分子的运动状态和分子间的距离。
(2)物质发生化学变化的实质就是,反应物的分子被破坏,分解成原子,原子重新组合形成新的分子或新的物质。
构成物质的基本微粒
用分子和原子的观点解释纯净物和混合物 :
混合物是由不同种分子构成的,或由不同种原子构成。
纯净物是由同种分子构成的,或由同种原子构成。
原子结构
原子结构发现历程
1803年,英国科学家道尔顿提出了近代原子学说
1897年,英国科学家汤姆生发现了电子
原子结构
1911年,英国科学家卢瑟福利用α粒子轰击金箔实验发现了原子核,并提出原子的核状结构。1919年,卢瑟福用α粒子轰击氮原子核等,发现原子核里有质子,并于1920年预言原子核中有中子 ;1932年经过不少科学家反复实验,证实中子的存在。
原子结构
原子结构
现代原子结构理论
科学家们研究发现,原子是由带正电荷的原子核和带负电荷的电子构成的。
原子核是由质子和中子两种微粒构成`。
原子
原子核
电子
质子
中子
(带一个单位正电荷)
(不带电)
(带正电)
(带一个单位负电荷)
在原子中,核电荷数=质子数=核外电子数。
原子核所带的电量与核外电子的电量相等,电性相反,因而原子呈电中性。
原子结构
常见原子的结构
原子 核电荷数 质子数 电子数 中子数
氢 1 1 1 0
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 11 12
铁 26 26 26 30
相对原子质量
以一种碳原子的质量的1/12作为基准,其它原子的质量与这一基准的比称为这种原子的相对原子质量。(用Ar表示)
相对原子质量
其它原子的质量
碳原子的质量的1/12
相对原子质量
已知作为相对原子质量基准的l个碳原子的质量为l.993×10-26kg,1个氧原子的质量为 2.657×10-26kg,求氧的相对原子质量,
氧的相对原子质量【Ar(O)】
2.657×10-26kg
l.993×10-26kg×
1
12
16
相对原子质量
质子和中子的质量大约相等,且质子的质量大约为碳原子质量的1/12。
=某种原子的质量/碳原子质量的1/12
相对原子质量
=(原子核质量+核外电子质量)/碳原子质量的1/12
电子质量极小,相当于质子质量的1/1836。
≈原子核质量/碳原子质量的1/12
=(质子的质量+中子的质量)/碳原子质量的1/12
=(质子数×一个质子的质量+中子数×一个中子的质量)/碳原子质量的1/12
=质子数+中子数
相对原子质量≈质子数+中子数
常见原子的结构
原子 核电荷数 质子数 电子数 中子数 相对原子质量
氢 1 1 1 0
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 11 12
铁 26 26 26 30
1
12
16
23
56
相对原子质量
相对原子质量
相对分子质量(Mr)等于构成分子的各原子的相对原子质量(Ar)的总和。
O2的相对分子质量
例如:计算O2、CO2、H2CO3的相对分子质量。
=16×2
=32
CO2的相对分子质量
=12+16×2
=44
H2CO3的相对分子质量
=1×2+12+16×3
=62
核外电子排布
核外电子排布
核外电子排布
核外电子排布
核外电子排布
在含有多个电子的原子里,电子的能量并不相同。能量低的,通常在离核近的区域运动。能量高的,通常在离核较远的区域运动。我们把电子离核远近的不同的运动区域叫做电子层,能量稍低、离核稍近的叫第一层,能量高、离核稍远的叫第二层,由里往外依次类推,分别叫做第三、四、五……层。由此可见,核外电子是在能量不同的层次上运动的,也就是说核外电子是分层排布的。
核外电子排布
原子结构示意图:
用圆圈表示原子核,在圆圈内用正数表示核电荷数数(或核内质子数),用弧线表示电子层,用弧线上的数字表示该电子层所排电子数。
核外电子排布
(1)电子总是从能量最低的电子层排起,然后再由里往外,依次排在能量逐渐升高的电子层里。
核外电子的分层排布规律
核外电子排布
核外电子的分层排布规律
(2)每个电子层只能容纳一定数目的电子,所容纳的电子数最多只能容纳2n2个(n为电子层数)
核外电子排布
核外电子的分层排布规律
(3)最外层最多只能容纳8个电子(K层为最外层时,最多只能容纳2个电子)。次外层电子数目不超过18个,倒数第三层电子数目不超过32个。
以上三点规律是相互联系的,必须同时遵守。
核外电子排布
稀有气体元素的原子最外层电子数一般是8个(氦原子是2个),属于稳定结构,因此它们的化学性质稳定。
各类元素原子最外层电子数特点
核外电子排布
金属元素的原子最外层电子数一般少于4个,在化学反应中易失去最外层电子,使次外层变为最外层,达到稳定结构
各类元素原子最外层电子数特点
核外电子排布
非金属元素的原子最外层电子数则一般多于或等于4个,在化学反应中易得到电子,使最外层达到8个电子的稳定结构。
各类元素原子最外层电子数特点
核外电子排布
稀有气体元素的原子最外层电子数一般是8个(氦原子是2个),属于稳定结构,因此它们的化学性质稳定。
各类元素原子最外层电子数特点
金属元素的原子最外层电子数一般少于4个,在化学反应中易失去最外层电子,使次外层变为最外层,达到稳定结构
非金属元素的原子最外层电子数则一般多于或等于4个,在化学反应中易得到电子,使最外层达到8个电子的稳定结构。
所以元素的化学性质与该元素原子的最外层电子数关系密切。
化合物形成——氯化钠的形成
钠在氯气中燃烧
现象:
1、产生黄色火焰
2、放出大量热
3、产生浓厚白烟
结论:
钠+氯气 氯化钠
点燃
2Na+Cl2 2NaCl
点燃
化合物形成——氯化钠的形成
氯化钠的形成过程:
钠原子的质子数为11,最外电子层上有1个电子,在化学反应中容易失去电子,使次外层变为最外层,达到稳定结构。但是这时钠的原子核内仍然是11个质子,带11个正电荷,而核外电子变为10个,带10个负电荷,正负电荷数目不同,原子显正电性。
同样的,氯原子的质子数为17,最外电子层上有7个电子,在化学反应中容易得到1个电子,使最外层变为8个电子,达到稳定结构。但是这时氯的原子核内仍然是17个质子,带17个正电荷,而核外电子变为18个,带18个负电荷,正负电荷数目不同,原子显负电性。
化合物形成——氯化钠的形成
氯化钠的形成过程:
我们把这种带电的原子或原子团叫做离子。其中带正电的离子叫阳离子,带负电的离子叫阴离子。
象氯化钠这样由阴阳离子相互作用形成的化合物叫做离子化合物。在离子化合物中不存在分子,只存在阴阳离子。
化合物形成——氯化氢的形成
氢气在氯气中燃烧
现象:
1、产生苍白色火焰
2、放出大量热
3、集气瓶口出现白雾
结论:
氢气+氯气 氯化氢
点燃
H2+Cl2 2HCl
点燃
化合物形成——氯化氢的形成
氯化氢的形成过程
氢原子的质子数为1,第一电子层(最外电子层)上有1个电子,在化学反应中容易得到1个电子,使最外层变为2个电子,达到稳定结构。同样的,氯原子的质子数为17,最外电子层上有7个电子,在化学反应中也容易得到1个电子,使最外层变为8个电子,达到稳定结构。
这样,氢原子和氯原子各拿出一个电子形成一个电子对,为两个原子共用,围绕两个原子核运动,使两个原子都达到稳定结构,这个电子对称为共用电子对。一个氢原子和一个氯原子就通过共用电子对形成了一个氯化氢分子。
化合物形成——氯化氢的形成
氯化氢的形成过程
象氯化氢这样由共用电子对形成分子的化合物叫做共价化合物。共价化合物由分子构成。
1、工业上用甲和乙在一定条件下通过化合反应制备丙,下列是三种分子的模型图,根据下列微观示意图得出的结论错误的是( )
A.甲的化学式为C2H4
B.保持乙化学性质的最小微粒是水分子
C.乙和丙都属于氧化物
D.化学反应前后分子发生了改变
C
2、如图是某化学反应过程的微观示意图,下列有关说法正确的是( )
A.反应前后分子的个数不变
B.生成物有三种
C.反应前后汞原子和氧原子的个数不变
D.汞和氧气都由分子构成
C
3、汤姆森和卢瑟福都对现代原子结构理论做出了巨大贡献。下列关于原子结构的论述中,不属于他们两人共同观点的是 ( )
A.原子很小,但可以分
B.原子是构成物质的基本粒子
C.原子的电子带负电荷
D.原子由原子核和核外电子构成
4、关于原子、分子、离子的说法中,错误的是 ( )
A.原子不能直接构成物质
B.分子可以保持物质的化学性质
C.原子的质量主要集中在原子核上
D.金属原子失去电子会形成阳离子
D
A
5、下列对分子、原子、离子的认识,正确的是 ( )
A.原子是一切变化中最小粒子,不可再分
B.在化学变化中分子不改变
C.温度越高,分子运动越快
D.钠原子和钠离子的化学性质相同
6、某微粒的结构示意图如图所示,下列有关该微粒的说法错误的是 ( )
A.该微粒的原子核内有11个质子
B.该微粒在化学反应中易失去1个电子
C.该微粒的原子核外有3个电子层
D.该图表示的微粒是一种离子
C
D
7、下列微粒结构示意图中,表示阴离子的是 ( )
A. B . C. D.
8、铀235(其原子核内有92个质子,相对原子质量为235)是核电站的主要燃料,下列有关说法正确的是 ( )
A.铀属于非金属元素 B.该原子的核电荷数为92
C.该原子核内有51个中子 D.该原子核外有143个电子
9、钛合金在生产、生活的多个领域应用广泛.有一种钛原子核内有22个质子、26个中子,则该钛原子的核外电子数是 ( )
A.22 B.26 C.58 D.48
8
17
B
B
A
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
