5.1 金属的性质和利用 课件(46张PPT)
文档属性
| 名称 | 5.1 金属的性质和利用 课件(46张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-21 00:00:00 | ||
图片预览











文档简介
金属的性质和利用
伦敦奥运会的金牌味道真不错哦!
这些是什么?
好炫啊!
真气魄
!
好
壮
观啊!
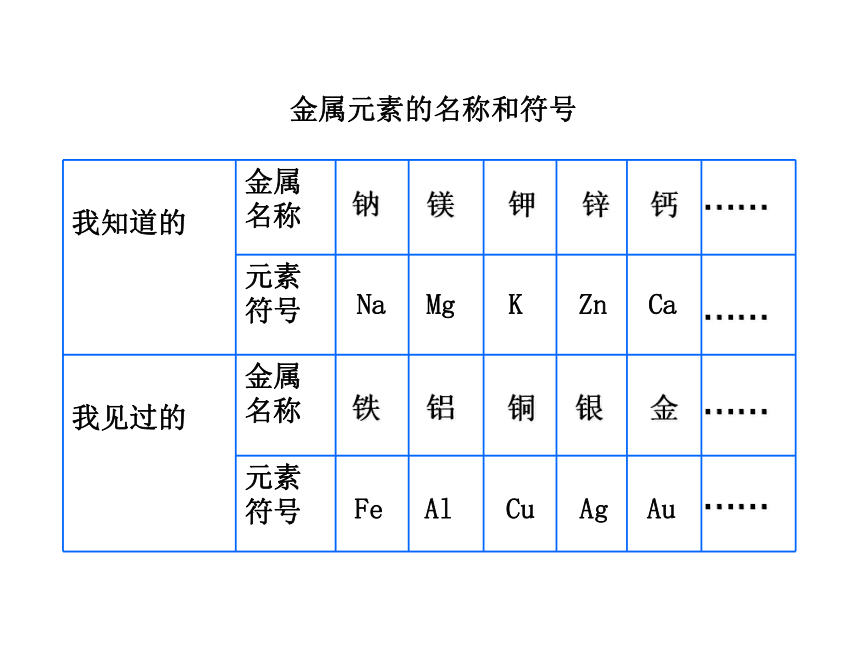
你知道哪些金属?见过哪些金属?说出它们的名称和元素符号,完成学案中表格。看看谁知道的最多!
其实我们知道很多
我知道的
金属名称
元素符号
我见过的
金属名称
元素符号
钠
镁
钾
锌
钙
Na
Mg
K
Zn
Ca
铁
铝
铜
银
金
Fe
Al
Cu
Ag
Au
……
……
……
……
金属元素的名称和符号
铁锅
铝锅
金属的物理性质
铜线
常见金属的导电和导热能力顺序(由大到小):
Ag、Cu、Au、Al、Zn、Pt、Sn、Fe、Pb、Hg
导电性
和
导热性
铝锭可压成很薄的铝箔用来包装糖果等
延展性
金属的物理性质
Fe
Cu
Zn
在粉末状时,金属吸收可见光后辐射不出去,所以这时金属一般呈暗灰色或黑色。
金属光泽
金属的物理性质
金属都具有一定的金属光泽,一般都呈银白色,而少量金属呈现特殊的颜色,如:金(Au)是黄色、铜(Cu)是紫红色、铅(Pb)是灰蓝色、锌(Zn)是青白色等。
金 属 锌
铜 块
金 条
汞
熔点
金属的熔点一般较大,但高低差别较大。最难熔的是钨,最易熔的是汞、铯和镓。
金属的物理性质
硬度和密度
金属的硬度一般较大,但它们之间有很大差别。
大多数的金属密度较大,少数金属(如Li、Na、K)比水轻。
金属的物理性质
金属之最
展性最强的金属——金。
延性最好的金属——铂。
导电性性最强的金属——银。
地壳中含量最高的金属——铝。
熔点最低的金属——汞。
熔点最高的金属——钨。
最硬的金属——铬。
制造新型高速飞机最重要的金属——钛,也被科学家称为“21世纪的金属”,或被称为未来的钢铁。
价格最高的金属——锎。1克锎的价格为10亿美元。
金属的物理性质
联想与启示
金属的物理性质
(1)金属纽扣表面涂的“银粉”实际上是______粉;
(2)体温计中液态的“银”是________;
(3)热水瓶胆壁的金属是________;
(4)联合国卫生组织为什么推荐使用中国的铁锅?
铝
汞
银
铁锅作炊具,可以补充人体所需的铁元素,防止缺铁性贫血。
(5)为什么铁制锅铲需要加上木柄或塑料柄?
防止烫手。因为铁具有良好的导热性,而木柄或塑料柄的导热性较差,这样就可以防止手拿锅铲时被烫伤。
(6)选择铸造硬币的金属材料需要考虑哪些因素?
需要考虑价格、硬度、无毒、耐磨、耐腐蚀、色泽美观、性质稳定等因素。
金属的物理性质
金属的化学性质:
1、金属与氧气的反应:将镁带、锌粒、铝片、铜片用砂纸打磨后用镊子夹持在酒精灯上点燃或加热,观察现象。
实验内容
实验现象
化学方程式
镁带在空气中点燃
锌粒在空气中加热
铝片在空气中加热
铁丝在氧气中燃烧
铜片在空气中加热
剧烈燃烧,发出耀眼的强光,放热,生成白色固体
锌粒熔化,呈灰白色,失去金属光泽
铝片熔化,但不滴落,呈灰白色,失去金属光泽
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
表面由红色变成黑色
3Fe+2O2 Fe3O4
点燃
2Cu+O2 2CuO
△
2Mg+O2 2MgO
点燃
4Al+3O2 2Al2O3
△
2Zn+O2 2ZnO
△
反应物
反应现象
反应速度
反应方程式
稀盐酸 或
稀硫酸
镁
铝
锌
铁
铜
剧烈反应,金属逐渐减少,产生大量气泡
剧烈反应,金属逐渐减少,产生大量气泡
剧烈较反应,金属逐渐减少,产生大量气泡
反应缓慢,金属逐渐
减少,有气泡产生,
溶液由无色变为浅绿色
不反应
Mg + H2 SO4 == MgSO4 + H2 ↑
Mg + 2HCl == MgCl2 + H2 ↑
Zn + H2 SO4 == Zn SO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Fe + H2 SO4 == FeSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
2Al + 6HCl = 2AlCl3 +3H2↑
很快
很快
较快
较慢
不反应
金属的化学性质:
2、金属与酸的反应:将镁带、锌粒、铝片铁丝、铜片用砂纸打磨后放入小试管中,分别加入2mL左右的稀盐酸或稀硫酸,观察现象。
3、金属与某些盐的反应:将铁丝用砂纸打磨后放入小试管中,加入2mL左右的硫酸铜溶液,观察现象。
金属的化学性质:
实验内容
实验现象
化学方程式
铁丝与硫酸铜溶液反应
铜片与硝酸银溶液反应
铁片表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色
铜片表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Fe+CuSO4=FeSO4+Cu
Cu+AgNO3=Cu(NO3)2+2Ag
金属的化学性质:
小结:
金属化学性质总结:
1、金属与氧气在一定条件下反应生成金属氧化物
金属+氧气→金属氧化物
2、活泼金属与酸反应生成盐和氢气
金属+酸→盐+氢气
3、某些金属与某些盐反应生成另一种金属和另一种盐
金属+盐→新金属+新盐
Mg + 2HCl = H2↑ + MgCl2
从物质分类的角度分析,反应物与生成物有何相同点:
单质
化合物
单质
化合物
Fe + H2SO4 = H2↑ + FeSO4
Fe + CuSO4 = Cu + FeSO4
讨论与分析
置换反应:
置换反应:
由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应
11
特点:
A
B
C
A
A
B
下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2
高温
点燃
化合反应:A+B+…→C
分解反应:A→B+C+…
置换反应:A+BC→B+AC
置换反应:
Cl2 + 2KI ==== I2 + 2KCl
CH4 + 2O2 ==== CO2 + 2H2O
C
不是
不是
是
铁和稀盐酸
镁和稀盐酸
锌和稀盐酸
铜和稀盐酸
金属活动性顺序:
盐酸
God
Save
me!
无所谓, 我无所谓…
为什么受伤的总是我!
我得意的笑,又得意的笑…
金属与盐酸的反应
镁、锌、铁、铜的金属活动性由强到弱
Al
金属活动性顺序:
小结:
1。根据金属能否与酸反应或反应的剧烈程度也可以来比较金属的活动性较强弱。
2.金属活动性顺序:
人们经过长期的实践,总结出常见金属在溶液中的活动性顺序如下:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中,金属的位置越靠前,它的活动性就越强;
在金属活动性顺序中,排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
金属活动性顺序:
在金属活动性顺序中,位于前面的金属能把位于其后面的金属从它们盐溶液中置换出来。(不适用于K、Ca、Na)
达标检测
1、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl====2AlCl3+3H2↑( )
(2)H2CO3====CO2↑+H2O ( )
(3)Fe+CuSO4====FeSO4+Cu ( )
(4)CaO+H2O====Ca(OH)2 ( )
C
B
C
A
金属活动性顺序:
2.判断下列物质能否发生反应?若能,写出相关化学方程式。
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液
(5)银与氯化铜溶液
(6)镁与硫酸亚铁溶液
(2) Zn + CuSO4 = Cu + ZnSO4
(4) Al + 3AgNO3 = Al(NO3)3 + 3Ag
(6) Mg + FeSO4 = MgSO4 +Fe
(1) 金属活动性顺序中,银在氢后
(3) 金属活动性顺序中,铜在锌后
(5) 金属活动性顺序中,银在铜后
金属活动性顺序:
氢气的制取
1、原料:
锌粒
、稀硫酸
2、原理:
Zn+H2SO4=ZnSO4+H2↑
不选用镁的原因是
反应速度过快,难以控制
不选用铁的原因是
反应速度过慢
不选用浓硫酸和硝酸的原因是
浓硫酸和硝酸有强氧
化性,与金属反应不产生氢气
不使用盐酸的原因是
盐酸有挥发性,挥发出氯化氢
气体使氢气不纯
3、装置:
氢气的制取
a、b、c三种装置均可用于制取氢气,其中
a装置的优点在于
装置简单
b装置的优点在于
便于添加液体药品
c装置的优点在于
便于使反应随时发生随时停止
4、收集方法:
氢气的制取
排水法
(氢气难溶于水,且不与水反应)
向下排空气法
(氢气密度小于同条件下空气)
5、操作步骤:
实验室用右图装置制取氢气有如下操作步骤:
①检查装置的气密性
②按要求装配好仪器
③注入液体药品
④加入固体药品
⑤收集气体
⑥验纯
找出正确的操作顺序______________________。
② ① ④ ③ ⑤ ⑥
定 义:合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
合金是混合物,不是纯净物哟!
有金属光泽、硬度、延展性…
合金
铜 合 金
钛 合 金
合 金 钢
铂 铱 合 金
几种合金
合金
记 忆 合 金
不 锈 钢
高 温 合 金
合金
通常所说的“金属材料”,既包括各种纯金属,也包括各种合金。
人类历史上使用最早的青铜是由铜、锡等元素形成的合金。世界上最常见、应用最广的钢是由铁、碳等元素形成的合金。
合金
合金具有许多良好的物理、化学或机械性能。
合金的硬度一般比各成分金属大;
多数合金的熔点低于组成它的成分金属。
——合金的性能一般由组成它的成分元素的种类和数量决定。
合金
名称
主要组
成元素
特性
用途
黄铜
铜、锌
坚硬、耐腐蚀
制造机械零件、电器零
件等
青铜
铜、锡
耐腐蚀、易铸造成形
制造形状复杂的铸件、
精致的工艺品、塑像等
硬铝
铝、铜、
镁、锰
质轻而坚硬
制造飞机、汽车、作建
筑材料等
焊锡
锡、铅
熔点低、能粘接金属
焊接电子元件、金属片等
不锈钢
铁、铬、镍
耐腐蚀
制造医疗器械、化工设
备、日用品等
碳素钢
铁、碳
坚硬
作建筑材料、制造机器零件、铁轨、船舶、桥梁等
常见合金的性质和用途
合金
生铁:
合金
含碳量:
2%~4.3%
其它元素:
较多硫、磷、硅、锰(少量)等
分类:
白口铁
灰口铁
球墨铸铁
性能:
坚硬、韧性差,一般用于铸造
生铁的冶炼
合金
炼铁的原料:
铁矿石、焦炭、石灰石和空气
炼铁的设备:
高炉
炼铁的原理:
在高温条件下,利用还原剂一氧化碳从铁的氧化物中将铁还原出来。
炼铁的过程及反应(以赤铁矿为例):
合金
炼铁产物:
生铁
合金
含碳量:
0.03%~2%
其它元素:
硅、锰(少量)、硫、磷(几乎没有)
分类:
(1)碳素钢:除铁元素外只含有碳元素。按含碳量分为:
高碳钢(含碳量0.6%—2%)
中碳钢(含碳量0.3%—0.6%)
低碳钢(含碳量0.03%—0.3%)
硬度大
韧性好
钢
合金
钢
(2)合金钢:在碳素钢基础上加入其它元素形成具有特殊性能的钢。
锰钢
钨钢
硅钢
不锈钢
合金
钢
性能:
较硬、有韧性、良炼钢的设备:好的延展性和弹性,机械性能好,可以锻、轧和铸造,性能比生铁优越。
钢的冶炼
炼钢的原料:
生铁
炼钢的设备:
平炉
转炉
电炉
合金
钢
炼钢的原理:
在高温下,用氧气或铁的氧化物把生铁中所含有过量的碳和其他杂质转变为气体或炉渣而除去。
炼钢的主要反应:
C+O2 CO2
点燃
生铁
钢
碳的质量分数
其他元素
机械性能
机械加工
用 途
2%~4.3%
0.03%~2%
较多硅、锰,
少量硫、磷
少量硅、锰,
几乎不含硫、磷
硬而脆
硬而韧,延展性好
可铸,不可锻
可铸、可锻、可压延
制造机械、交通工具、武器等
制铁锅、暖气片、机床底座等
生铁和钢的比较
合金
合金
钢铁的生产和使用是人类文明和社会进步的一个重要标志。早在春秋战国时期,我国就开始生产和使用铁器。公元1世纪时,铁在我国已经广泛应用。
伦敦奥运会的金牌味道真不错哦!
这些是什么?
好炫啊!
真气魄
!
好
壮
观啊!
你知道哪些金属?见过哪些金属?说出它们的名称和元素符号,完成学案中表格。看看谁知道的最多!
其实我们知道很多
我知道的
金属名称
元素符号
我见过的
金属名称
元素符号
钠
镁
钾
锌
钙
Na
Mg
K
Zn
Ca
铁
铝
铜
银
金
Fe
Al
Cu
Ag
Au
……
……
……
……
金属元素的名称和符号
铁锅
铝锅
金属的物理性质
铜线
常见金属的导电和导热能力顺序(由大到小):
Ag、Cu、Au、Al、Zn、Pt、Sn、Fe、Pb、Hg
导电性
和
导热性
铝锭可压成很薄的铝箔用来包装糖果等
延展性
金属的物理性质
Fe
Cu
Zn
在粉末状时,金属吸收可见光后辐射不出去,所以这时金属一般呈暗灰色或黑色。
金属光泽
金属的物理性质
金属都具有一定的金属光泽,一般都呈银白色,而少量金属呈现特殊的颜色,如:金(Au)是黄色、铜(Cu)是紫红色、铅(Pb)是灰蓝色、锌(Zn)是青白色等。
金 属 锌
铜 块
金 条
汞
熔点
金属的熔点一般较大,但高低差别较大。最难熔的是钨,最易熔的是汞、铯和镓。
金属的物理性质
硬度和密度
金属的硬度一般较大,但它们之间有很大差别。
大多数的金属密度较大,少数金属(如Li、Na、K)比水轻。
金属的物理性质
金属之最
展性最强的金属——金。
延性最好的金属——铂。
导电性性最强的金属——银。
地壳中含量最高的金属——铝。
熔点最低的金属——汞。
熔点最高的金属——钨。
最硬的金属——铬。
制造新型高速飞机最重要的金属——钛,也被科学家称为“21世纪的金属”,或被称为未来的钢铁。
价格最高的金属——锎。1克锎的价格为10亿美元。
金属的物理性质
联想与启示
金属的物理性质
(1)金属纽扣表面涂的“银粉”实际上是______粉;
(2)体温计中液态的“银”是________;
(3)热水瓶胆壁的金属是________;
(4)联合国卫生组织为什么推荐使用中国的铁锅?
铝
汞
银
铁锅作炊具,可以补充人体所需的铁元素,防止缺铁性贫血。
(5)为什么铁制锅铲需要加上木柄或塑料柄?
防止烫手。因为铁具有良好的导热性,而木柄或塑料柄的导热性较差,这样就可以防止手拿锅铲时被烫伤。
(6)选择铸造硬币的金属材料需要考虑哪些因素?
需要考虑价格、硬度、无毒、耐磨、耐腐蚀、色泽美观、性质稳定等因素。
金属的物理性质
金属的化学性质:
1、金属与氧气的反应:将镁带、锌粒、铝片、铜片用砂纸打磨后用镊子夹持在酒精灯上点燃或加热,观察现象。
实验内容
实验现象
化学方程式
镁带在空气中点燃
锌粒在空气中加热
铝片在空气中加热
铁丝在氧气中燃烧
铜片在空气中加热
剧烈燃烧,发出耀眼的强光,放热,生成白色固体
锌粒熔化,呈灰白色,失去金属光泽
铝片熔化,但不滴落,呈灰白色,失去金属光泽
剧烈燃烧,火星四射,放出大量的热,生成黑色固体
表面由红色变成黑色
3Fe+2O2 Fe3O4
点燃
2Cu+O2 2CuO
△
2Mg+O2 2MgO
点燃
4Al+3O2 2Al2O3
△
2Zn+O2 2ZnO
△
反应物
反应现象
反应速度
反应方程式
稀盐酸 或
稀硫酸
镁
铝
锌
铁
铜
剧烈反应,金属逐渐减少,产生大量气泡
剧烈反应,金属逐渐减少,产生大量气泡
剧烈较反应,金属逐渐减少,产生大量气泡
反应缓慢,金属逐渐
减少,有气泡产生,
溶液由无色变为浅绿色
不反应
Mg + H2 SO4 == MgSO4 + H2 ↑
Mg + 2HCl == MgCl2 + H2 ↑
Zn + H2 SO4 == Zn SO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Fe + H2 SO4 == FeSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
2Al + 6HCl = 2AlCl3 +3H2↑
很快
很快
较快
较慢
不反应
金属的化学性质:
2、金属与酸的反应:将镁带、锌粒、铝片铁丝、铜片用砂纸打磨后放入小试管中,分别加入2mL左右的稀盐酸或稀硫酸,观察现象。
3、金属与某些盐的反应:将铁丝用砂纸打磨后放入小试管中,加入2mL左右的硫酸铜溶液,观察现象。
金属的化学性质:
实验内容
实验现象
化学方程式
铁丝与硫酸铜溶液反应
铜片与硝酸银溶液反应
铁片表面覆盖一层红色物质,溶液由蓝色逐渐变为浅绿色
铜片表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Fe+CuSO4=FeSO4+Cu
Cu+AgNO3=Cu(NO3)2+2Ag
金属的化学性质:
小结:
金属化学性质总结:
1、金属与氧气在一定条件下反应生成金属氧化物
金属+氧气→金属氧化物
2、活泼金属与酸反应生成盐和氢气
金属+酸→盐+氢气
3、某些金属与某些盐反应生成另一种金属和另一种盐
金属+盐→新金属+新盐
Mg + 2HCl = H2↑ + MgCl2
从物质分类的角度分析,反应物与生成物有何相同点:
单质
化合物
单质
化合物
Fe + H2SO4 = H2↑ + FeSO4
Fe + CuSO4 = Cu + FeSO4
讨论与分析
置换反应:
置换反应:
由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应
11
特点:
A
B
C
A
A
B
下列反应都是置换反应吗?
3CO + Fe2O3 ==== 2Fe + 3CO2
高温
点燃
化合反应:A+B+…→C
分解反应:A→B+C+…
置换反应:A+BC→B+AC
置换反应:
Cl2 + 2KI ==== I2 + 2KCl
CH4 + 2O2 ==== CO2 + 2H2O
C
不是
不是
是
铁和稀盐酸
镁和稀盐酸
锌和稀盐酸
铜和稀盐酸
金属活动性顺序:
盐酸
God
Save
me!
无所谓, 我无所谓…
为什么受伤的总是我!
我得意的笑,又得意的笑…
金属与盐酸的反应
镁、锌、铁、铜的金属活动性由强到弱
Al
金属活动性顺序:
小结:
1。根据金属能否与酸反应或反应的剧烈程度也可以来比较金属的活动性较强弱。
2.金属活动性顺序:
人们经过长期的实践,总结出常见金属在溶液中的活动性顺序如下:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序中,金属的位置越靠前,它的活动性就越强;
在金属活动性顺序中,排在氢前面的金属能与酸反应放出氢气,而排在氢后面的金属不能与酸反应放出氢气。
金属活动性顺序:
在金属活动性顺序中,位于前面的金属能把位于其后面的金属从它们盐溶液中置换出来。(不适用于K、Ca、Na)
达标检测
1、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl====2AlCl3+3H2↑( )
(2)H2CO3====CO2↑+H2O ( )
(3)Fe+CuSO4====FeSO4+Cu ( )
(4)CaO+H2O====Ca(OH)2 ( )
C
B
C
A
金属活动性顺序:
2.判断下列物质能否发生反应?若能,写出相关化学方程式。
(1)银与稀盐酸
(2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液
(5)银与氯化铜溶液
(6)镁与硫酸亚铁溶液
(2) Zn + CuSO4 = Cu + ZnSO4
(4) Al + 3AgNO3 = Al(NO3)3 + 3Ag
(6) Mg + FeSO4 = MgSO4 +Fe
(1) 金属活动性顺序中,银在氢后
(3) 金属活动性顺序中,铜在锌后
(5) 金属活动性顺序中,银在铜后
金属活动性顺序:
氢气的制取
1、原料:
锌粒
、稀硫酸
2、原理:
Zn+H2SO4=ZnSO4+H2↑
不选用镁的原因是
反应速度过快,难以控制
不选用铁的原因是
反应速度过慢
不选用浓硫酸和硝酸的原因是
浓硫酸和硝酸有强氧
化性,与金属反应不产生氢气
不使用盐酸的原因是
盐酸有挥发性,挥发出氯化氢
气体使氢气不纯
3、装置:
氢气的制取
a、b、c三种装置均可用于制取氢气,其中
a装置的优点在于
装置简单
b装置的优点在于
便于添加液体药品
c装置的优点在于
便于使反应随时发生随时停止
4、收集方法:
氢气的制取
排水法
(氢气难溶于水,且不与水反应)
向下排空气法
(氢气密度小于同条件下空气)
5、操作步骤:
实验室用右图装置制取氢气有如下操作步骤:
①检查装置的气密性
②按要求装配好仪器
③注入液体药品
④加入固体药品
⑤收集气体
⑥验纯
找出正确的操作顺序______________________。
② ① ④ ③ ⑤ ⑥
定 义:合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
合金是混合物,不是纯净物哟!
有金属光泽、硬度、延展性…
合金
铜 合 金
钛 合 金
合 金 钢
铂 铱 合 金
几种合金
合金
记 忆 合 金
不 锈 钢
高 温 合 金
合金
通常所说的“金属材料”,既包括各种纯金属,也包括各种合金。
人类历史上使用最早的青铜是由铜、锡等元素形成的合金。世界上最常见、应用最广的钢是由铁、碳等元素形成的合金。
合金
合金具有许多良好的物理、化学或机械性能。
合金的硬度一般比各成分金属大;
多数合金的熔点低于组成它的成分金属。
——合金的性能一般由组成它的成分元素的种类和数量决定。
合金
名称
主要组
成元素
特性
用途
黄铜
铜、锌
坚硬、耐腐蚀
制造机械零件、电器零
件等
青铜
铜、锡
耐腐蚀、易铸造成形
制造形状复杂的铸件、
精致的工艺品、塑像等
硬铝
铝、铜、
镁、锰
质轻而坚硬
制造飞机、汽车、作建
筑材料等
焊锡
锡、铅
熔点低、能粘接金属
焊接电子元件、金属片等
不锈钢
铁、铬、镍
耐腐蚀
制造医疗器械、化工设
备、日用品等
碳素钢
铁、碳
坚硬
作建筑材料、制造机器零件、铁轨、船舶、桥梁等
常见合金的性质和用途
合金
生铁:
合金
含碳量:
2%~4.3%
其它元素:
较多硫、磷、硅、锰(少量)等
分类:
白口铁
灰口铁
球墨铸铁
性能:
坚硬、韧性差,一般用于铸造
生铁的冶炼
合金
炼铁的原料:
铁矿石、焦炭、石灰石和空气
炼铁的设备:
高炉
炼铁的原理:
在高温条件下,利用还原剂一氧化碳从铁的氧化物中将铁还原出来。
炼铁的过程及反应(以赤铁矿为例):
合金
炼铁产物:
生铁
合金
含碳量:
0.03%~2%
其它元素:
硅、锰(少量)、硫、磷(几乎没有)
分类:
(1)碳素钢:除铁元素外只含有碳元素。按含碳量分为:
高碳钢(含碳量0.6%—2%)
中碳钢(含碳量0.3%—0.6%)
低碳钢(含碳量0.03%—0.3%)
硬度大
韧性好
钢
合金
钢
(2)合金钢:在碳素钢基础上加入其它元素形成具有特殊性能的钢。
锰钢
钨钢
硅钢
不锈钢
合金
钢
性能:
较硬、有韧性、良炼钢的设备:好的延展性和弹性,机械性能好,可以锻、轧和铸造,性能比生铁优越。
钢的冶炼
炼钢的原料:
生铁
炼钢的设备:
平炉
转炉
电炉
合金
钢
炼钢的原理:
在高温下,用氧气或铁的氧化物把生铁中所含有过量的碳和其他杂质转变为气体或炉渣而除去。
炼钢的主要反应:
C+O2 CO2
点燃
生铁
钢
碳的质量分数
其他元素
机械性能
机械加工
用 途
2%~4.3%
0.03%~2%
较多硅、锰,
少量硫、磷
少量硅、锰,
几乎不含硫、磷
硬而脆
硬而韧,延展性好
可铸,不可锻
可铸、可锻、可压延
制造机械、交通工具、武器等
制铁锅、暖气片、机床底座等
生铁和钢的比较
合金
合金
钢铁的生产和使用是人类文明和社会进步的一个重要标志。早在春秋战国时期,我国就开始生产和使用铁器。公元1世纪时,铁在我国已经广泛应用。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
