沪教版化学九年级上册 第四章 认识化学变化 复习课件(16张ppt)
文档属性
| 名称 | 沪教版化学九年级上册 第四章 认识化学变化 复习课件(16张ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 136.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-22 09:10:18 | ||
图片预览






文档简介
第四章 认识化学变化 复习
燃烧:
定义:
燃烧是一种发光、发热的剧烈的化学反应
燃烧条件:
1、物质要有可燃性
2、可燃物与氧气充分接触
3、温度达到可燃物的着火点
灭火方法:
1、移走可燃物
2、隔绝氧气
3、降低温度到可燃物的着火点以下
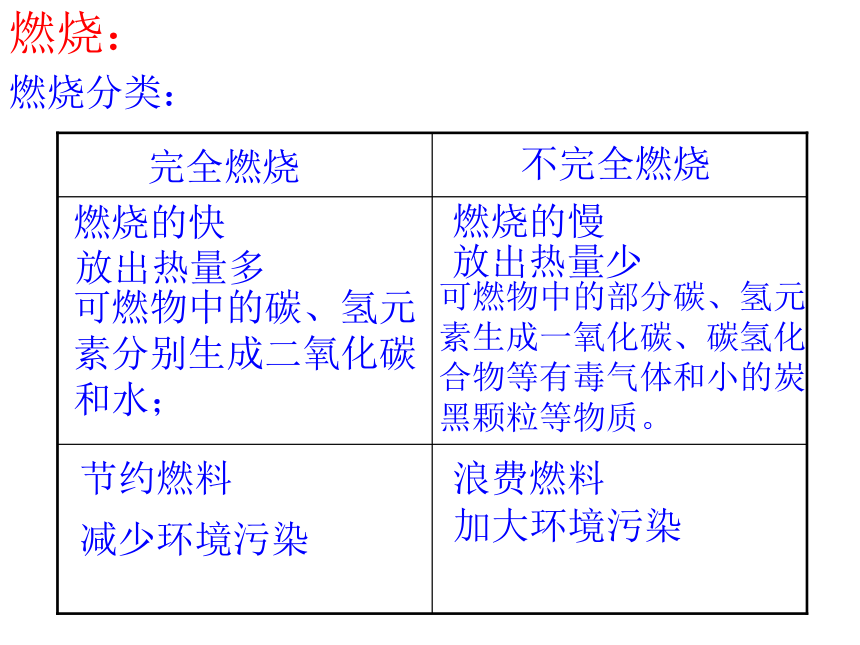
燃烧:
燃烧分类:
完全燃烧
不完全燃烧
燃烧的快
燃烧的慢
放出热量多
放出热量少
可燃物中的碳、氢元素分别生成二氧化碳和水;
可燃物中的部分碳、氢元素生成一氧化碳、碳氢化合物等有毒气体和小的炭黑颗粒等物质。
节约燃料
减少环境污染
浪费燃料
加大环境污染
燃烧:
爆炸:
在有限的空间内,发生急速的燃烧,短时间聚积大量的热,使气体的体积迅速膨胀。
易燃易爆物:
在遇到明火、高温或撞击时,极易发生燃烧和爆炸的物质。
爆炸极限:
容易导致爆炸的空气中可燃性气体的体积分数范围
火灾逃生:
质量守恒定律
定义:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
成立原因:
根据化学反应的本质,原子的重组,即参加反应的各原子的种类、数目不变,质量也基本不变
引申:
反应前后,元素的种类和质量也不变
应用:
(1)解释化学变化
(2)配平化学方程式
(3)确定化学式
(4)确定反应物生成物质量关系
化学方程式
化学方程式的含义
“质”的含义:
表示反应的反应物、生成物及反应条件
“量”的含义:
通过相对分子质量表示反应的反应物、生成物的质量比
化学方程式的书写
化学方程式的计算:
化学方程式要配平,须以纯量代方程。
关系式对准关系量,计算单位不能忘。
左右相比列比例,解设比答要齐全。
本章作业
1.给煤炉生火时,用于引火的木柴不宜紧密地堆在一起,而应该架空放置。请说明这样做的目的。
答:增大木材与空气的接触面积,使燃烧充分。
2.下列灭火方法不恰当的是 ( )。
A.酒精灯不慎打翻起火,立即用湿抹布扑灭
B.图书档案起火,用二氧化碳灭火器扑灭
C.炒菜时油锅中的油不慎着火,可用锅盖盖灭
D.油库着火,用水浇灭
D
3.已知某两种物质在光照条件下能发生化学反应,其微观示意图如下,图中相同小球代表同种原子,原子间的短线代表原子的结合。下列从图示获得的信息中正确的是 ( )。
本章作业
A.图示中共有3种不同的分子
B.图示反应符合质量守恒守律
C.该反应没有单质参加
D.说明化学反应中分子不可分
B
4.乙醇(用X表示)完全燃烧的化学方程式为
试推断乙醇的化学式是 ( )。
A.C3H8 B.C2H6 C.C2H6O D.C4H6O2
本章作业
X+3O2 2CO2+3H2O
点燃
C
本章作业
5.用化学方程式表示下列变化,并指出其中有哪些属于化合反应,哪些属于分解反应。
(1)生石灰(CaO)和水反应生成熟石灰[Ca(OH)2]。
(2)铁丝在氧气中点燃,生成四氧化三铁(Fe3O4)。
(3)将二氧化碳通入澄清石灰水中,出现浑浊。
(4)双氧水(H2O2)分解,生成水并放出氧气。
(5)氢气在加热条件下使氧化铜(CuO)还原为铜,同时生成水蒸气。
化合反应______________分解反应_______________
CaO+H2O=Ca(OH)2
3Fe+2O2 Fe3O4
点燃
CO2+Ca(OH)2=CaCO3↓+H2O
2H2O2=2H2O+O2↑
CuO+H2 Cu+H2O
△
(1)
(2)
(4)
6.二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑救,因为镁可以在二氧化碳中继续燃烧,生成氧化镁和碳单质。试写出镁在二氧化碳气体 中燃烧的化学方程式。
本章作业
2Mg+CO2 2MgO+C
点燃
本章作业
7.(1)高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现煅烧含有500 kg碳酸钙的贝壳,最多可得到氧化钙多少千克?
解:设可得到氧化钙的质量为x
CaCO3 CaO + CO2↑
高温
100
56
500kg
x
100:56=500kg:x
x =280kg
答:最多可得到氧化钙280kg。
本章作业
(2)要使多少克水完全电解才能得到l00 L氢气(密度为0.09 g.L-1)?
解: 0.09 g.L-1×100L=9g
设可得到氧化钙的质量为x
2H2O 2H2 ↑ + O2↑
通电
36
4
x
9g
36:4=x :9g
x =81g
答:完全电解水81g。
本章作业
8.化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g 石灰石样品,把20g稀盐酸(氯化氢的水溶液)分4次加入样品中(样品中除 碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀盐酸的用量
剩余固体的质量
第一次加入5 g
1.5 g
第二次加入5 g
1.0 g
第三次加入5 g
0.5 g
第四次加入5 g
0.3 g
(1)从以上数据可知,这四次实验中,第________次石灰石样品中碳酸钙已完全反应。
(2)求石灰石样品中碳酸钙的质量分数。
四
2g-0.3g
2g
×100%=85%
本章作业
9.有人设计如右图所示的实验来验证质量守恒定律:把装有稀盐酸的小试管放入盛有碳酸钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡。取下烧杯并将其倾斜,使两种溶液混合,发生反应,再把烧杯放到天平上,观察天平是否平衡(碳酸钠和盐酸反应生成氯化钠、水和二氧化碳)。
你认为上述实验设计是否合理?请说明理由。若不合理,应如何改进?
答:不严密。原因是反应生成的二氧化碳逸出溶液到空气中,因此不能用于验证质量守恒定律。可以用密封性良好的锥形瓶代替烧杯,完成两溶液的混合反应。
10.火力发电厂用石灰石浆吸收废气中的二氧化硫,以防止污染环境,其反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2。若l000 g废气中含有l.6 g二氧化硫,这些二氧化硫可以和多少克碳酸钙反应?
本章作业
解:设反应的碳酸钙的质量为x
200
128
1.6g
x
200:128=x : 1.6g
x =2.5g
答:这些二氧化硫可以和1.6g碳酸钙反应。
2CaCO3+2SO2+O2=2CaSO4+2CO2
燃烧:
定义:
燃烧是一种发光、发热的剧烈的化学反应
燃烧条件:
1、物质要有可燃性
2、可燃物与氧气充分接触
3、温度达到可燃物的着火点
灭火方法:
1、移走可燃物
2、隔绝氧气
3、降低温度到可燃物的着火点以下
燃烧:
燃烧分类:
完全燃烧
不完全燃烧
燃烧的快
燃烧的慢
放出热量多
放出热量少
可燃物中的碳、氢元素分别生成二氧化碳和水;
可燃物中的部分碳、氢元素生成一氧化碳、碳氢化合物等有毒气体和小的炭黑颗粒等物质。
节约燃料
减少环境污染
浪费燃料
加大环境污染
燃烧:
爆炸:
在有限的空间内,发生急速的燃烧,短时间聚积大量的热,使气体的体积迅速膨胀。
易燃易爆物:
在遇到明火、高温或撞击时,极易发生燃烧和爆炸的物质。
爆炸极限:
容易导致爆炸的空气中可燃性气体的体积分数范围
火灾逃生:
质量守恒定律
定义:
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和
成立原因:
根据化学反应的本质,原子的重组,即参加反应的各原子的种类、数目不变,质量也基本不变
引申:
反应前后,元素的种类和质量也不变
应用:
(1)解释化学变化
(2)配平化学方程式
(3)确定化学式
(4)确定反应物生成物质量关系
化学方程式
化学方程式的含义
“质”的含义:
表示反应的反应物、生成物及反应条件
“量”的含义:
通过相对分子质量表示反应的反应物、生成物的质量比
化学方程式的书写
化学方程式的计算:
化学方程式要配平,须以纯量代方程。
关系式对准关系量,计算单位不能忘。
左右相比列比例,解设比答要齐全。
本章作业
1.给煤炉生火时,用于引火的木柴不宜紧密地堆在一起,而应该架空放置。请说明这样做的目的。
答:增大木材与空气的接触面积,使燃烧充分。
2.下列灭火方法不恰当的是 ( )。
A.酒精灯不慎打翻起火,立即用湿抹布扑灭
B.图书档案起火,用二氧化碳灭火器扑灭
C.炒菜时油锅中的油不慎着火,可用锅盖盖灭
D.油库着火,用水浇灭
D
3.已知某两种物质在光照条件下能发生化学反应,其微观示意图如下,图中相同小球代表同种原子,原子间的短线代表原子的结合。下列从图示获得的信息中正确的是 ( )。
本章作业
A.图示中共有3种不同的分子
B.图示反应符合质量守恒守律
C.该反应没有单质参加
D.说明化学反应中分子不可分
B
4.乙醇(用X表示)完全燃烧的化学方程式为
试推断乙醇的化学式是 ( )。
A.C3H8 B.C2H6 C.C2H6O D.C4H6O2
本章作业
X+3O2 2CO2+3H2O
点燃
C
本章作业
5.用化学方程式表示下列变化,并指出其中有哪些属于化合反应,哪些属于分解反应。
(1)生石灰(CaO)和水反应生成熟石灰[Ca(OH)2]。
(2)铁丝在氧气中点燃,生成四氧化三铁(Fe3O4)。
(3)将二氧化碳通入澄清石灰水中,出现浑浊。
(4)双氧水(H2O2)分解,生成水并放出氧气。
(5)氢气在加热条件下使氧化铜(CuO)还原为铜,同时生成水蒸气。
化合反应______________分解反应_______________
CaO+H2O=Ca(OH)2
3Fe+2O2 Fe3O4
点燃
CO2+Ca(OH)2=CaCO3↓+H2O
2H2O2=2H2O+O2↑
CuO+H2 Cu+H2O
△
(1)
(2)
(4)
6.二氧化碳是常用的灭火剂,但金属镁着火却不能用二氧化碳扑救,因为镁可以在二氧化碳中继续燃烧,生成氧化镁和碳单质。试写出镁在二氧化碳气体 中燃烧的化学方程式。
本章作业
2Mg+CO2 2MgO+C
点燃
本章作业
7.(1)高温煅烧贝壳(主要成分是碳酸钙)可以生成氧化钙和二氧化碳。现煅烧含有500 kg碳酸钙的贝壳,最多可得到氧化钙多少千克?
解:设可得到氧化钙的质量为x
CaCO3 CaO + CO2↑
高温
100
56
500kg
x
100:56=500kg:x
x =280kg
答:最多可得到氧化钙280kg。
本章作业
(2)要使多少克水完全电解才能得到l00 L氢气(密度为0.09 g.L-1)?
解: 0.09 g.L-1×100L=9g
设可得到氧化钙的质量为x
2H2O 2H2 ↑ + O2↑
通电
36
4
x
9g
36:4=x :9g
x =81g
答:完全电解水81g。
本章作业
8.化学兴趣小组为了测定一批石灰石样品中碳酸钙的质量分数,取用2g 石灰石样品,把20g稀盐酸(氯化氢的水溶液)分4次加入样品中(样品中除 碳酸钙外,其余成分既不与盐酸反应,也不溶解于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下:
稀盐酸的用量
剩余固体的质量
第一次加入5 g
1.5 g
第二次加入5 g
1.0 g
第三次加入5 g
0.5 g
第四次加入5 g
0.3 g
(1)从以上数据可知,这四次实验中,第________次石灰石样品中碳酸钙已完全反应。
(2)求石灰石样品中碳酸钙的质量分数。
四
2g-0.3g
2g
×100%=85%
本章作业
9.有人设计如右图所示的实验来验证质量守恒定律:把装有稀盐酸的小试管放入盛有碳酸钠溶液的烧杯中,将烧杯放到托盘天平上,用砝码平衡。取下烧杯并将其倾斜,使两种溶液混合,发生反应,再把烧杯放到天平上,观察天平是否平衡(碳酸钠和盐酸反应生成氯化钠、水和二氧化碳)。
你认为上述实验设计是否合理?请说明理由。若不合理,应如何改进?
答:不严密。原因是反应生成的二氧化碳逸出溶液到空气中,因此不能用于验证质量守恒定律。可以用密封性良好的锥形瓶代替烧杯,完成两溶液的混合反应。
10.火力发电厂用石灰石浆吸收废气中的二氧化硫,以防止污染环境,其反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2。若l000 g废气中含有l.6 g二氧化硫,这些二氧化硫可以和多少克碳酸钙反应?
本章作业
解:设反应的碳酸钙的质量为x
200
128
1.6g
x
200:128=x : 1.6g
x =2.5g
答:这些二氧化硫可以和1.6g碳酸钙反应。
2CaCO3+2SO2+O2=2CaSO4+2CO2
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
